基于网络药理学和分子对接探讨淫羊藿抗肿瘤作用机制
2022-06-07杨家军原明月牛野陈杨春华张会宗袁子民
杨家军,原明月,牛野,陈杨春华,张会宗,袁子民*
(1.辽宁中医药大学药学院,辽宁 大连 116600;2.辽宁中医药大学,辽宁 沈阳 110847)
肿瘤是一种严重危害人类健康的疾病。每年癌症患者数量日益增加,预计到2040年,全球新增癌症病例将达到2 840万例。癌症在我国发病率高,全球约有一半的胃癌、肝癌和食道癌病例来自中国[1]。癌症早期可通过手术切除、移植、局部消融等方法治疗[2]。肿瘤的发病机制和信号转导途径比较复杂,目前利用单一的治疗方式很难取得良好的效果,现代研究表明靶向药物可调控多种信号通路,为肿瘤的治疗提供了新范式[3]。有研究表明多种中药对癌细胞的生长、增殖均有抑制作用[4]。淫羊藿中主要有效成分淫羊藿苷、淫羊藿素具有抗肿瘤作用[5-6]。但目前对淫羊藿抗肿瘤作用机制研究较少,其抗肿瘤作用靶点及机制尚未完全明确。本文运用网络药理学及分子对接的方法,探讨淫羊藿抗肿瘤的潜在作用机制,为其后续研究提供参考。
1 资料与方法
1.1 淫羊藿活性成分的筛选及其靶点的收集 在TCMSP数据库(http://tcmspw.com/tcmsp.php)检索“淫羊藿”,以口服生物利用度(OB)≥30%、类药性(DL)≥0.18对其成分进行筛选,并获得其相关靶点,再通过Uniprot数据库(https://www.uniprot.org/)将其转换为标准基因名。
1.2 疾病靶点的收集 利用Genecards数据库(https://www.genecards.org/)、OMIM数据库(https://omim.org/)以关键词“tumor”进行检索,合并去重后,获取肿瘤疾病相关靶点,其中Genecards数据库获得的疾病靶点以Relevance score≥1作为筛选条件。
1.3 淫羊藿活性成分与疾病共同靶点的筛选 通过在线韦恩图分析工具(http://bioinformatics.psb.ugent.be/webtools/Venn/),将淫羊藿活性成分靶点与疾病靶点导入,绘制韦恩图,获得其共同靶点,将其作为淫羊藿抗肿瘤的潜在靶点。
1.4 淫羊藿活性成分-疾病靶点网络关系图的构建 利用Cytoscape 3.8.2软件,构建“淫羊藿活性成分-疾病靶点”网络关系图,对其进行可视化处理。
1.5 蛋白与蛋白互作PPI网络构建与核心靶点的筛选 将活性成分与疾病共同靶点导入STRING V11.5数据库(https://www.string-db.org/),设置物种为Homo sapiens,其他参数保持默认,获得其PPI网络信息,将其导入Cytoscape 3.8.2软件,使用CytoNCA插件对其进行网络拓扑分析,以度值(degree)、中介中心性(betweenness)和接近中心性(closeness)作为参考值,筛选出疾病的核心靶点。
1.6 GO功能与KEGG通路富集分析 利用R x64 4.0.5软件,借助脚本文件,将药物与疾病共同靶点的基因名转化为Entrez ID,将DOSE、clusterProfiler和enrichplot软件包导入R x64 4.0.5软件,通过运行脚本文件,对淫羊藿抗肿瘤靶点进行GO功能与KEGG富集分析,设定阈值P<0.05,筛选出具有显著性差异的生物学过程和通路。
1.7 活性成分-核心靶点分子对接 将筛选的淫羊藿的化合物成分与关键靶点进行半柔性分子对接和构象打分。在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)和PDB数据库(https://www1.rcsb.org/)中分别下载淫羊藿活性成分的2D结构的sdf文件和度值较高的核心靶点蛋白的PDB格式文件,利用ChemBio3D Ultra 14.0软件将活性成分的sdf文件转化为mol2格式文件。将靶点蛋白及活性成分导入SYBYL 2.0软件,对靶点蛋白提取配体小分子、去除水分子、加氢等,然后进行分子对接,利用打分函数进行评价。取高分的结合构象绘制分子对接示意图。
2 结果
2.1 淫羊藿活性成分的筛选 通过TCMSP数据库,检索到淫羊藿活性成分130个,其中符合口服生物利用度(OB)≥30%、类药性(DL)≥0.18的活性成分23个(见表1)。
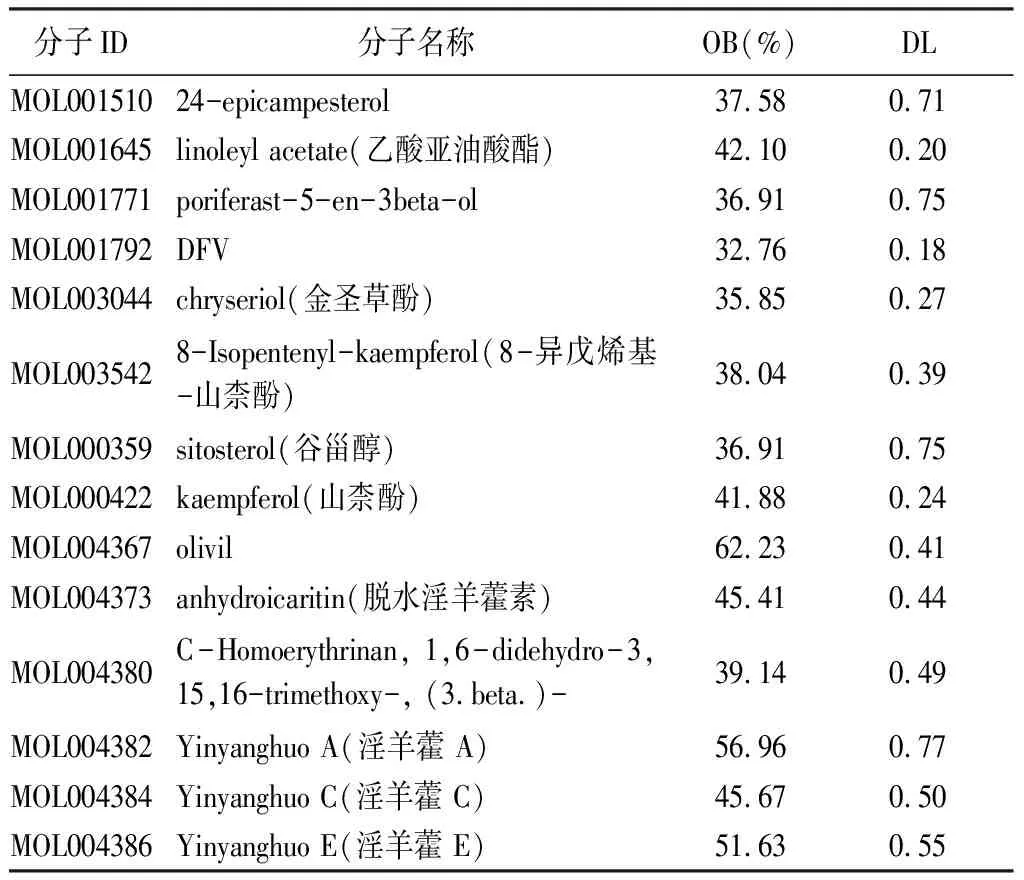
表1 淫羊藿活性成分筛选
2.2 淫羊藿活性成分靶点与疾病靶点收集 筛选得到淫羊藿23个活性成分的相关靶点193个,肿瘤疾病相关靶点8 169个。活性成分与疾病相关靶点的交集靶点173个。韦恩图见图1。
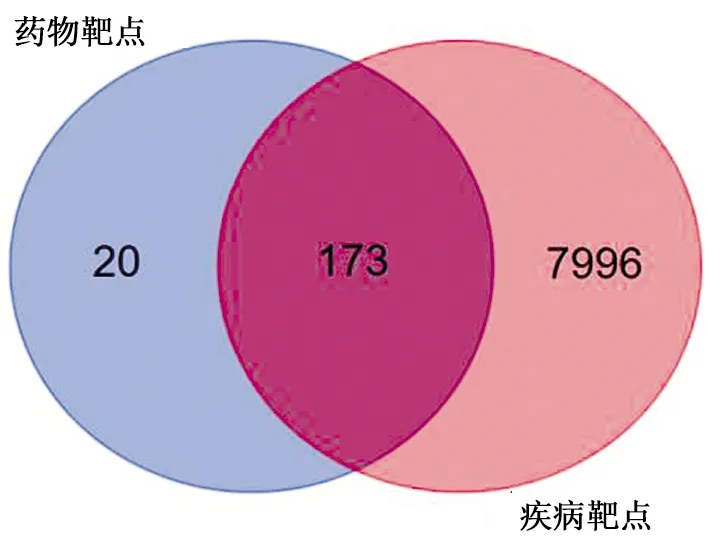
图1 淫羊藿与疾病靶点韦恩图
2.3 淫羊藿活性成分-疾病靶点网络关系图的构建 该网络共有196个节点(23个潜在活性成分和173个靶基因),413条连线(见图2)。潜在活性成分与疾病靶点有连线说明两者之间存在靶向关系,表明淫羊藿中23个潜在活性成分与173个疾病靶点有靶向关系。度值排名前五的潜在有效活性成分为MOL000098-槲皮素、MOL000006-木犀草素、MOL000422-山柰酚、MOL004373-脱水淫羊藿素(anhydroicaritin)、MOL004391-(8-(3-甲基-2-苯基)-2-苯基色原酮),其degree值分别为127、52、49、30、25。度值越大表明该成分可能在网络中越重要。
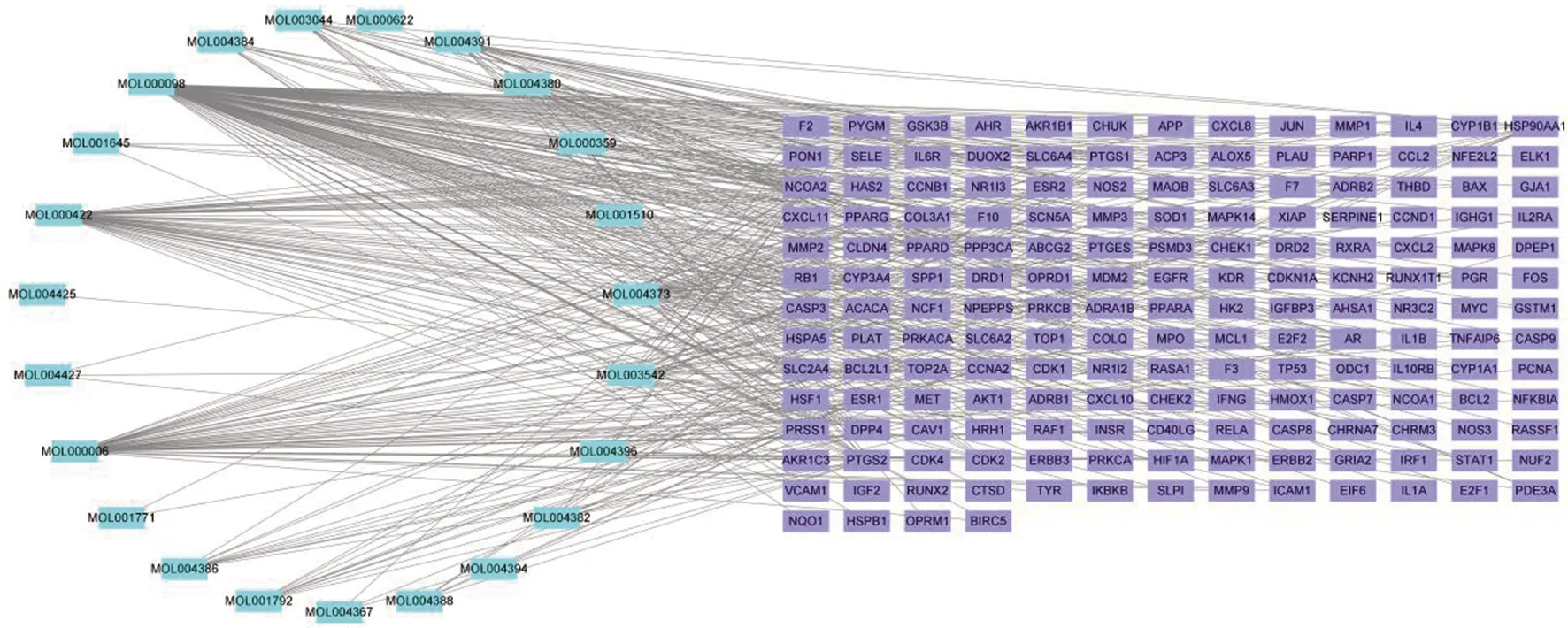
图2 淫羊藿活性成分-疾病靶点网络关系图
2.4 淫羊藿抗肿瘤潜在靶点的PPI网络关系分析 PPI网络关系见图3,蛋白与蛋白相互作用中共涉及172个节点和2 901条边,平均度值(degree)为33.7。把大于度值(degree)、中介中心性(betweenness)和接近中心性(closeness)的中位值作为核心靶点的筛选条件,利用CytoNCA插件进行网络拓扑分析,值越大表明该节点在PPI网络中越重要,可能发挥着越重要的生物学功能。做两次筛选后获得27个核心靶点(见图4),面积越大代表degree值越大。其相关拓扑参数见表2。
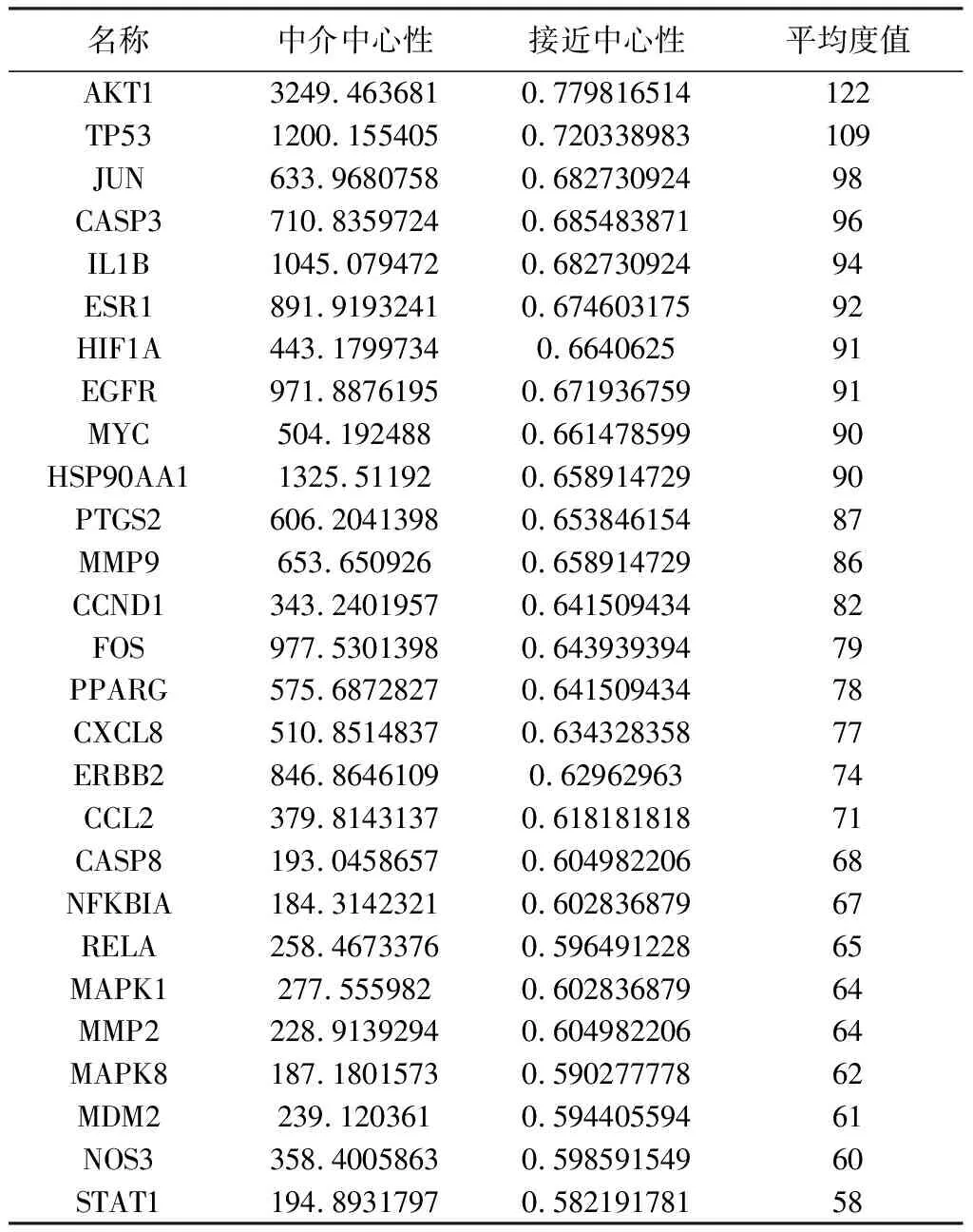
表2 核心靶点及拓扑参数
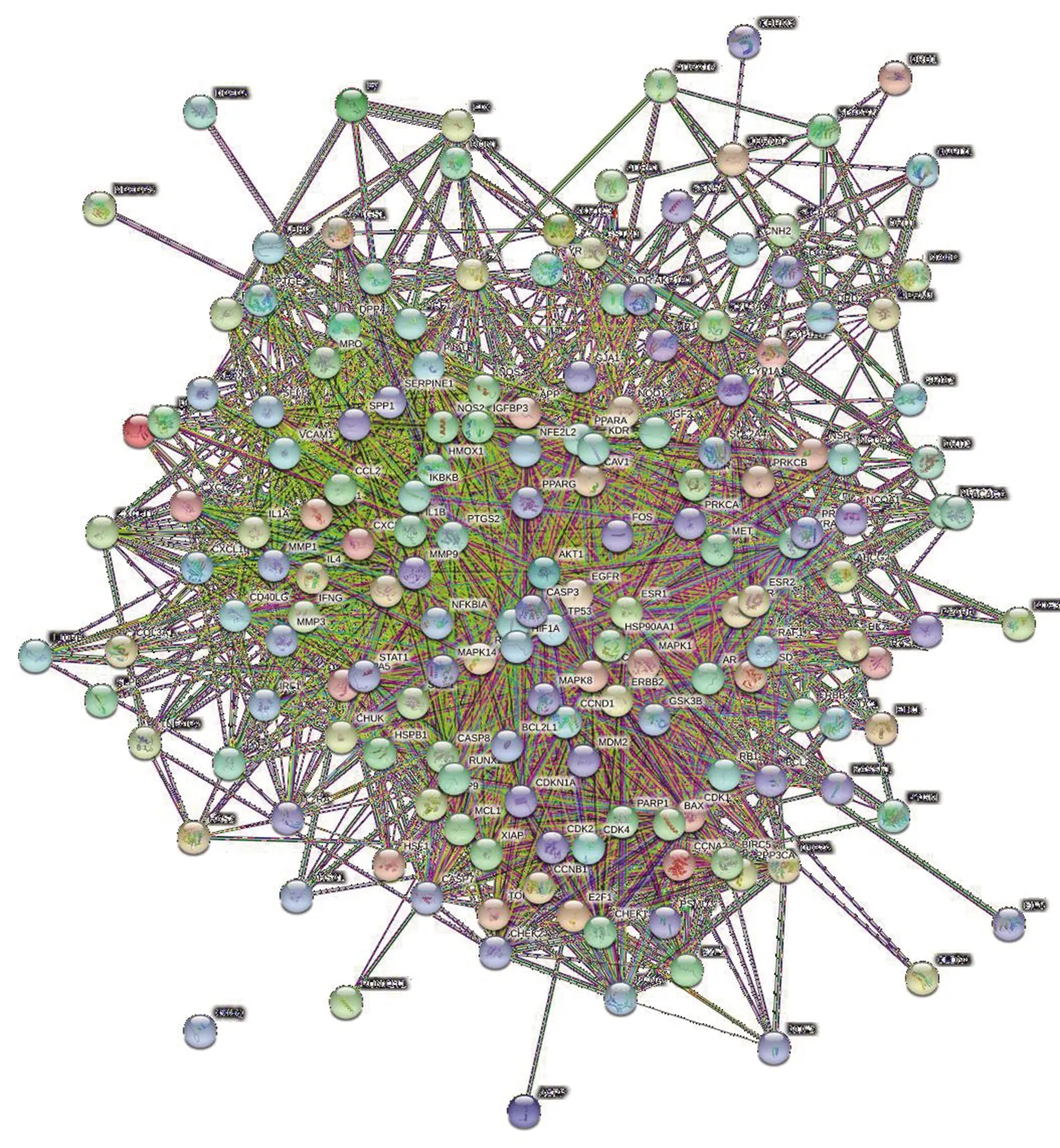
图3 PPI网络关系图
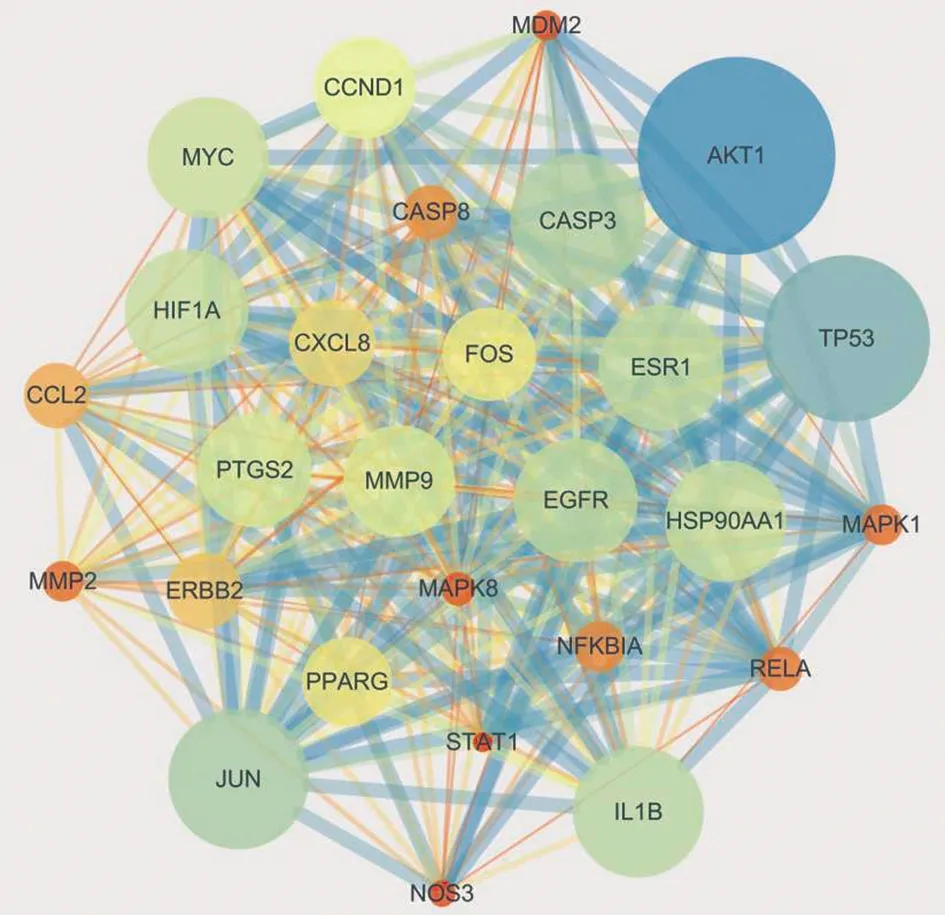
图4 核心靶点网络关系图
2.5 GO功能富集分析 GO功能富集分析结果共计2 592条,包括生物学过程(BP)2 311条、细胞组成(CC)89条、分子功能(MF)192条。根据q值排序,值越小,颜色越红,则表示富集程度越高,分别筛选出前 10 位并绘制成气泡图,如图5所示。据图可以推测出淫羊藿治疗抗肿瘤的生物学过程主要涉及细胞对化学应激的反应(cellular response to chemical stress)、氧化应激的反应(response to oxidative stress)以及金属离子反应(response to metal ion)等;细胞组成主要与膜筏(membrane raft)、膜微结构域(membrane microdomain)、膜区(membrane region)等相关;在分子功能中,主要涉及DNA 结合转录因子结合(DNA-binding transcription factor binding)、核受体活性(nuclear receptor activity)等。
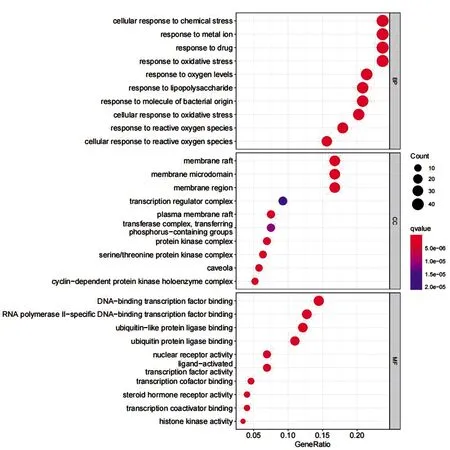
图5 GO富集分析气泡图
2.6 KEGG通路富集分析 KEGG通路富集分析结果显示潜在作用靶点参与的通路有176条。根据q值排序,值越小,颜色越红,则富集程度越高,筛选出前30位绘制气泡图,如图6所示。据图可知,淫羊藿抗肿瘤所涉及的生物学通路包括IL-17、p53、PI3K-Akt、TNF、MAPK等信号通路,淫羊藿还可能对乙型肝炎(hepatitis B)、丙型肝炎(hepatitis C)、前列腺癌(prostate cancer)、胰腺癌(pancreatic cancer)、人巨细胞病毒感染(human cytomegalovirus infection)、肺癌等具有治疗作用,表明淫羊藿的有效成分在多条通路同时发挥作用。
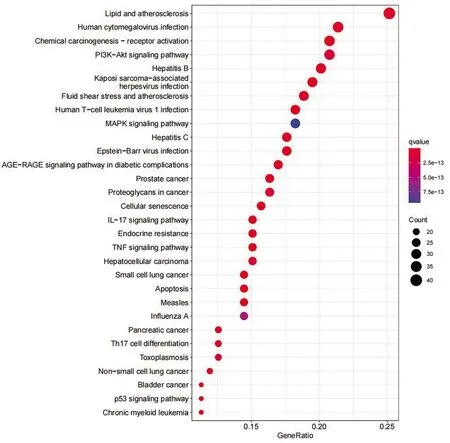
图6 KEGG富集分析气泡图
2.7 分子对接 利用SYBYL 2.0软件进行半柔性分子对接,验证活性成分与疾病靶点相互作用活性。将筛选所得淫羊藿23 个潜在活性成分与度值较高的TP53、AKT1、JUN、CASP3进行分子对接,其PDB ID分别为1MA3、5WBY、6Y3V、1NMS。对接结果以打分函数Total_Score≥5为阈值,结合自由能越小,配体与受体结合越稳定,Total_Score值越大[7]。Total_Score≥5表示活性成分与靶点蛋白结合较好,Total_Score>7说明结合活性很强烈[8]。分子对接结果见表3。结果显示,淫羊藿中12个活性成分均能与4个关键靶点对接成功。24-epicampesterol、poriferast-5-en-3beta-ol和谷甾醇(sitosterol)与TP53和CASP3均有强烈的结合活性;Anhydroicaritin-3-O-alpha-L-rhamnoside和淫羊藿苷(icariin)与TP53、AKT1、JUN、CASP3均有较好结合。其中对接评分较高的为淫羊藿苷与CASP3靶点蛋白。分子对接示意图如图7所示。淫羊藿苷通过形成6个氢键结合在GLY125、LYS137、TYR197及LEU136等氨基酸残基所形成的疏水性口袋中, 结合力强, 因此活性也较高。
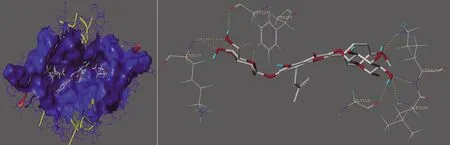
图7 淫羊藿苷与CASP3分子对接示意图
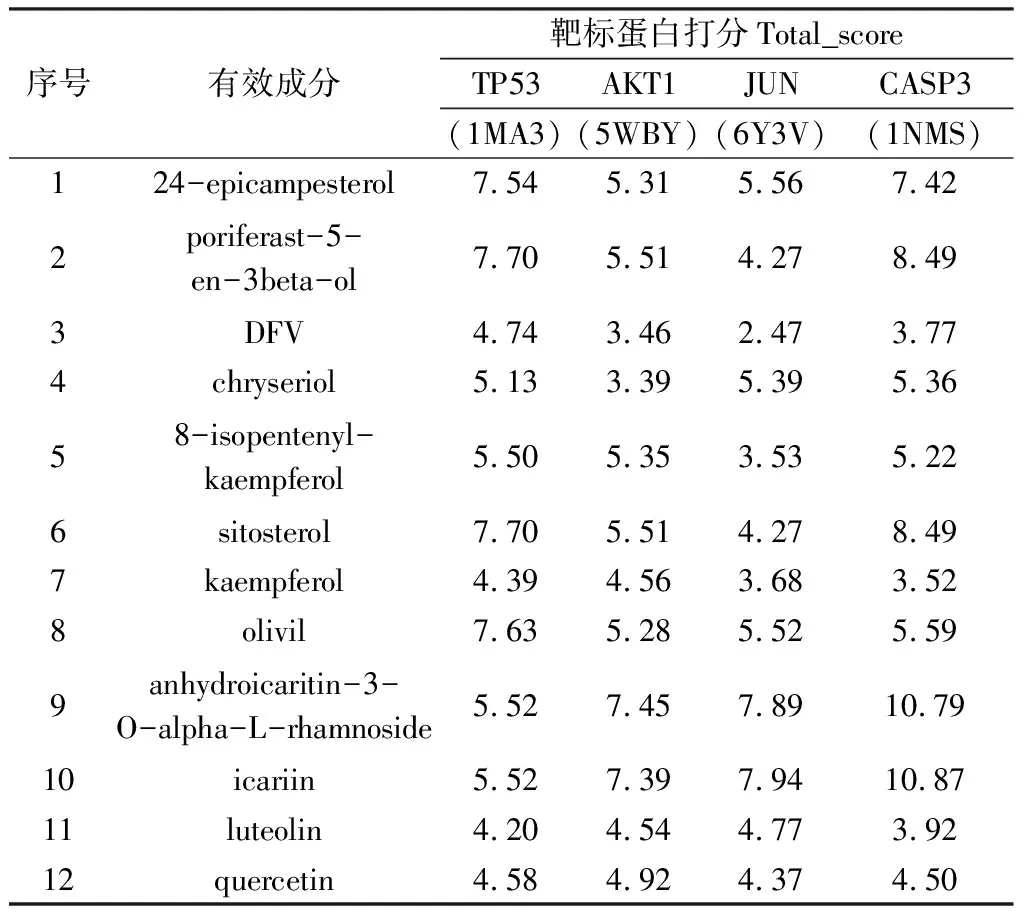
表3 淫羊藿活性成分与核心靶点分子对接信息表
3 讨论
淫羊藿中含有黄酮、多糖、生物碱类等多种成分[9],本研究筛选得到的活性成分如槲皮素、淫羊藿苷、木樨草素等均具有抗肿瘤的作用,并通过多种机制抑制癌症。如木樨草素和槲皮素可分别抑制乳腺癌细胞MDA-MB-231和体内外HepG2肝癌细胞的增殖并诱导其凋亡[10-11]。
本研究发现淫羊藿抗肿瘤的潜在作用的关键靶点有TP53、JUN、CASP3、MMP9、MMP2、PTGS2 等。miR-1269a可通过靶向调控TP53促进肝癌细胞的迁移[12]。JUN是与肝细胞癌相关的原生基因[13],c-Jun是一种细胞转录因子,可促进细胞周期的进展和细胞增殖,可通过结合肿瘤的启动子来调节影响肿瘤侵袭和转移的一些基因的表达[14],c-Jun在乙型肝炎病毒相关肿瘤发生过程中具有重要作用,可促进肝细胞增殖和不典型增生的进展[15]。李元洪等[16]利用射频消融联合化疗治疗原发性肝癌,发现能明显降低AFP、MMP、GP73水平。苦参碱能不同程度上调人肝癌SMMC-7721细胞CASP3蛋白的表达,且抑制MMP2蛋白的表达[17]。Chen等[18]研究显示抑制PTGS2可激活PINK1/PRKN介导的有丝分裂,从而加速细胞凋亡,抑制肝癌细胞的生长。
淫羊藿总黄酮有促进免疫调节、抗炎、抗肿瘤、抗衰老等作用[19],淫羊藿苷作为其中的代表性成分,对肺癌、卵巢癌、食管癌等多种癌细胞均具有抑制作用[20-23],可通过下调MMP2、MMP9 表达水平,从而抑制卵巢癌的侵袭和转移。淫羊藿苷可促进抑癌基因p27表达,增高p27 mRNA水平从而抑制HepG2肝癌细胞的增殖[24],还可激活线粒体内ROS/JNK信号通路,诱导人肝癌SMMC-7721细胞的凋亡[25]。淫羊藿素也能够显著下调基质金属蛋白酶(MMP)的表达,从而抑制胶质母肿瘤细胞的黏附、迁移和侵袭能力[26]。
GO功能富集分析可知淫羊藿的活性成分通过参与DNA转录和氧化反应等过程发挥抗肿瘤作用。KEGG富集发现淫羊藿抗肿瘤涉及的生物学通路有IL-17、p53、PI3K-Akt等信号通路,可能对乙型肝炎、丙型肝炎、前列腺癌、胰腺癌、人巨细胞病毒感染等具有治疗作用,表明淫羊藿的有效成分在多条通路同时发挥作用。肝细胞癌的主要病因是乙型肝炎病毒和丙型肝炎病毒的慢性感染[27-28]。恶性肿瘤的发生与人巨细胞病毒感染有关[29],如人巨细胞病毒感染可能通过STAT3信号通路上调内皮细胞特异性分子的表达促进胶质瘤的发展[30],还可能激活HIF-1α途径、调节下游迁移及侵袭基因表达从而促进结肠癌细胞的迁移、侵袭[31]。分子对接结果显示淫羊藿苷与多个疾病靶点蛋白对接评分较高,表明其结合力强,活性较高。PI3K-Akt信号通路是调节机体内细胞生存、生长、分化及凋亡的重要信号通路,可催化相关蛋白的磷酸化发挥促癌作用[32]。有研究表明阻断PI3K-Akt信号通路可抑制miR-182过表达,降低MMP9、c-Myc、VEGF等相关蛋白的表达,从而抑制肝癌细胞的增殖、侵袭和迁移[33]。淫羊藿苷可促使 caspase-3、caspase-9蛋白表达上调,从而诱导人肝癌HepG2细胞凋亡[34]。分子对接结果也显示,淫羊藿苷能与CASP3靶点蛋白稳定结合,表明淫羊藿抗肿瘤作用可能与调控PI3K-Akt信号通路、CASP3蛋白有关。
综上所述,本研究采用网络药理学方法对淫羊藿有效成分潜在的抗肿瘤靶点及信号通路进行分析,探讨其抗肿瘤的潜在作用机制。通过分子对接法验证了各成分与靶点的结合。为后续研究淫羊藿抗肿瘤的作用机制提供了参考。
