猪瘟病毒免疫过氧化物酶单层细胞试验检测方法的建立
2022-06-07朱海侠查代灿张惠云胡晓涵包松英
朱海侠 陈 雷 查代灿 张惠云 胡晓涵 包松英
(兆丰华生物科技(福州)有限公司 福州 350014)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(CSFV)引起的猪和野猪高接触性、高致病性的传染病[1],给我国养猪业造成巨大经济损失。该病一年四季均可发生,但以春、夏等多雨季节多发。不同日龄、不同品种的家猪和野猪对猪瘟病毒均易感。该病被世界动物卫生组织列为A类烈性传染病,被我国农业部列为一类传染病,是目前阻碍我国养猪业健康发展的首要动物传染病[2]。疫苗免疫接种是防控该病的主要措施,猪瘟大流行现状已经得到根除,但仍存在区域性、点状散发性流行[3]。究其原因,猪瘟疫苗的抗原含量是影响猪群免疫效果的重要因素之一。
目前针对猪瘟病毒的检测主要有RT-PCR检测技术、荧光定量PCR检测方法、LAMP方法、免疫荧光技术(IFA)、兔体定型热反应等。PCR相关技术主要针对的是病毒核酸,因此,在弱毒疫苗的评定过程中很难准确确定其活病毒的含量。由于猪瘟病毒感染细胞后不产生细胞病变,其病毒含量的测定主要依赖于传统的免疫荧光技术或兔体定型热反应进行判定。兔体定型热反应作为一种检测猪瘟弱毒疫苗效价的传统方法,受大兔个体差异影响较大,且耗时较长,费用较高。IFA检测方法是目前检测CSFV的一种重要的辅助方法,但该方法对设备要求较高,不利于推广应用。
免疫过氧化物酶单层细胞试验(IPMA),其主要原理是通过抗原抗体的相互作用,产生特异性显色反应,通过光学显微镜肉眼即可观察并判定结果[4]。此外,制备的细胞板可以在4℃条件下长期保存,反应结果也可以长期储存,随时观察[5]。本研究采用免疫过氧化物酶单层细胞试验,建立一种能够快速应用于生产中的病毒含量检测方法,旨在为猪瘟疫苗生产提供快速的评价工具。
1 材料与方法
1.1 毒株、细胞系猪瘟病毒C株、ST细胞系由兆丰华生物科技(福州)有限公司保存。
1.2 主要耗材3-氨基-9-乙基咪唑(AEC)、羊抗兔HPR-IgG购自Sigma公司;试验用阳性血清为猪瘟病毒(C株)免疫家兔后制备的高免血清样品;阴性血清为健康家兔血清样品;PEDV阳性、PRRSV阳性及PCV2阳性血清均由本公司保存备用;96孔细胞培养板购自costar公司;DMEM培养基购自GBICO;BSA购自Biosharp;其余分析纯试剂购自国药公司。
1.3 IPMA步骤将生长状况良好的ST细胞铺于96孔细胞培养板,置37℃、5%CO2培养箱中进行培养,细胞长至70%~80%时,弃去培养液,接种一定浓度的猪瘟病毒,37℃、5%CO2培养箱孵育1 h,期间每20 min摇晃一次,同时设立未接毒的对照组。吸附结束后,加入一定量DMEM液体继续培养一段时间;弃去培养液,用一定量PBS进行润洗,洗涤3次,干燥后加入含0.3%H2O2的甲醇溶液进行固定,作用10 min;弃去液体,用一定量PBS进行润洗后干燥处理,加入0.02%trition作用10 min;弃去液体,用一定量PBS进行润洗后干燥处理,加入一定量5%BSA(Bovine serum albumin)进行封闭2 h;弃去液体,用一定量PBS进行润洗后干燥处理,加入一定浓度的高免血清作为一抗,37℃作用一段时间;弃去液体,用一定量PBS进行润洗后干燥处理,加入一定浓度羊抗兔HRP-IgG二抗,37℃作用一段时间;弃去液体,用一定量PBS进行润洗后干燥处理,加入AEC,37℃作用15 min,ddH2O终止,光学显微镜下观察结果。
1.3.1 IPMA反应条件的优化
1.3.1.1 最佳一抗、二抗工作浓度及病毒作用时间的确定 取细胞长至70%~80%的96孔细胞培养板,加入已知浓度的猪瘟病毒,设置不加病毒对照孔,孵育1 h后,加入DMEM液体培养基,37℃、5%CO2培养箱分别作用24 h、48 h,72 h后进行固定处理, 加 入1∶50、1∶100、1∶150、1∶200、1∶300、1∶400、1∶800、1∶1 600、1∶3 200稀释的一抗,每个稀释度加一纵列,将羊抗兔HRP-IgG抗体按照1∶250、1∶500、1∶1 000、1∶2 000比例进行稀释,每个稀释度加一横列,100 uL/孔,每个浓度设2个重复孔,同时设置阴性对照和空白对照,按照上述步骤,观察染色结果,确定最佳一抗、二抗及病毒作用时间。
1.3.1.2 固定液的选择 弃去细胞培养液,用PBS润洗3次,分别加入含0.3%H2O2的甲醇、80%丙酮、33%丙酮溶液进行固定,室温固定10 min后,弃去固定液,用PBS润洗2次,按照上述步骤进行测定,显微镜下观察结果,确定最佳固定液。
1.3.1.3 最优二抗工作时间的确定 将辣根过氧化物酶(HPR)标记的羊抗兔IgG按照1∶1 000比例进行稀释,100 uL/孔,置37℃分别孵育0.75 h、1 h、2 h,PBST洗涤3次,按照上述步骤进行测定,显微镜下观察结果,确定最优二抗工作时间。
1.3.1.4 显色时间确定 AEC试剂根据配比要求进行配制,100 uL/孔,置室温和37℃分别作用15 min、20 min、30 min,按照上述步骤进行测定,显微镜下观察结果,确定最佳显色时间。
1.3.2 IPMA检测方法的特异性分析 用PEDV、PRRSV、PCV2阳性血清和猪瘟病毒(CSFV)阳性高免血清进行特异性检测,判定该方法的特异性。
1.3.3 IPMA检测方法重复性分析 分别制备3个批次的96孔细胞培养板,选用已知浓度的病毒按照一定比例进行稀释后,接种于96孔细胞培养板中,同时设置不接病毒的空白对照,每个样本做3个重复,分别进行组内及组间的重复性测定。
1.3.4 IPMA检测方法与IFA方法符合率分析 对建立的IPMA检测方法与IFA方法进行对比,分析同一批次、相同稀释度猪瘟病毒检测情况。
2 结果与分析
2.1 IPMA条件优化本研究确定最优反应条件为:猪瘟病毒接种后继续培养72 h,用含0.3%H2O2甲醇溶液室温固定10 min,5%BSA 37℃作用2 h,一抗按照1∶200进行稀释,37℃孵育2 h,二抗按照1∶1 000进行稀释,37℃孵育45 min,置37℃显色20 min具有较好的显色效果(见图1)。
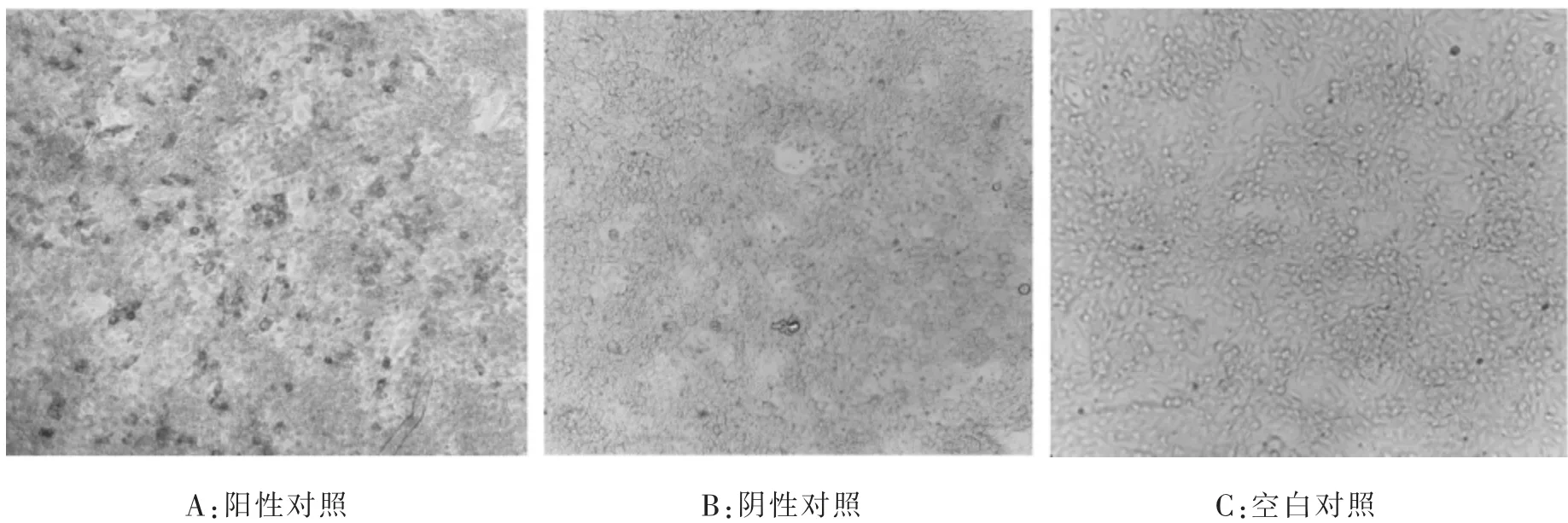
图1 不同样品AEC染色效果
2.2 最佳固定液的确定选用不同类型的固定液进行固定,结果发现33%丙酮溶液进行固定时会导致细胞迅速脱落,采用80%丙酮溶液与0.3%H2O2甲醇溶液相比,细胞会出现脱落现象,且染色后细胞边界模糊,效果稍差于0.3%H2O2甲醇溶液(见图2)。

图2 不同固定液处理后细胞染色效果
2.3 IPMA检测方法的特异性分析采用上述方法对PEDV、PRRSV、PCV2、CSFV阳性血清样品进行测定,结果表明:除猪瘟病毒阳性血清出现特异性颜色反应外,其余病毒阳性血清均无染色反应。
2.4 IPMA检测方法的重复性分析采用上述方法对不同批次制备的细胞进行猪瘟病毒含量测定,结果无明显差异,表明建立的方法具有很好的重复稳定性。
2.5 IPMA检测方法与IFA比较分析采用同一批细胞不同试验方法对同一批次、相同稀释度的猪瘟病毒进行测定,IPMA检测结果与IFA方法相符合(见图3)。
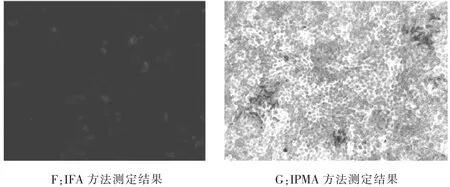
图3 不同试验方法对比分析
3 讨 论
IPMA与IFA检测方法一样,具有良好的特异性、敏感性等特点,解决了病毒感染细胞无细胞病变、难以判定细胞是否感染的难题[6]。该方法因操作简便、能够长期保存试验结果等优势在疫病检测中得到广泛应用[7-9]。本研究通过病毒感染时间、固定液选择、一抗和二抗、显色的最优工作条件确定,建立了猪瘟病毒的IPMA检测方法。通过加入一定量的Trition和BSA进行细胞通透和封闭,极大提高病毒侵染细胞的效果和降低背景的干扰,降低非特异性反应的发生,为建立猪瘟病毒的IPMA检测方法奠定基础。
疫苗免疫是预防疫病发生和流行的重要途径,虽然猪瘟弱毒疫苗的应用在一定程度上控制了猪瘟的流行,但仍出现免疫失败的情况。OIE-WAHIS实时数据显示,我国猪瘟疫情仍处于散发、流行的情况。王琴等[10]澄清了“由野毒株变异引起免疫失败”的学术争端,指出猪瘟弱毒疫苗(C株)能抵抗全世界流行的三个基因型野毒的攻击。CFSV在细胞增殖中效价高低及最终疫苗生产质量与动物免疫效果密切相关[11]。黄宝学等[12]指出,不同病毒含量猪瘟疫苗的免疫效果存在一定差异,疫苗中病毒含量过高会导致免疫耐受,病毒含量过低则不能诱导机体产生足够的抗体水平。因此,猪瘟弱毒疫苗中病毒含量是影响疫苗使用效果的关键。
本研究建立了能够快速检测猪瘟病毒复制情况的IPMA方法。虽然该方法已有在猪瘟病毒效价测定方面应用的报道[6,9],但本研究中主要采用极易获取的高免血清作为一抗,解决了单克隆抗体难以筛选的难题。采用特异性HRP-IgG作为二抗,极大提高了检测方法的特异性和推广的可行性。通过固定液的筛选及封闭条件的加入,大大降低了细胞脱落的几率及本底反应,降低了主观误判的概率。
