钛表面载银的硫酸乙酰肝素/壳聚糖抗菌涂层的构建
2022-06-06李娇娇韦章澳张维波李向阳陈佳龙
李娇娇,韦章澳,张维波,李向阳,陈佳龙
钛及其合金广泛用于牙科种植体,但种植体感染相关并发症影响其长期疗效[1]。为解决该问题,抗生素被整合在材料表面赋予材料一定的抗菌能力;但抗生素的抗菌谱狭窄、易引发细菌耐药性等问题影响其应用效果[2]。由于广谱、高效的抗菌活性和不引发细菌耐药性,银成为抗生素的潜在替代物[3],但载银表面制备成本高、费时、高耗能等缺点制约其应用[4]。故亟需寻找制备方法简单、抗菌效果优异的种植体表面载银技术。该研究旨在微纳米多孔钛表面,采用层层自组装技术(layer by layer self-assemble technology, LBL)将带负电荷的硫酸乙酰肝素(heparin sulfate, HEP)和带正电荷的壳聚糖(chitosan, CHI)交替吸附在多孔钛表面,构建出具有良好生物相容性的多层膜[5],再吸附银离子,构建出具有良好抗菌性能的涂层,为钛基植入材料抗感染表面制备提供可行的思路。
1 材料与方法
1.1 实验材料与仪器
1.1.1材料 纯钛(山西宝鸡有色金属有限公司);聚赖氨酸、硝酸银、HEP(美国Sigma Aldrich公司);丙酮(上海阿拉丁试剂有限公司);氢氧化钠、CHI、冰醋酸(上海国药集团化学试剂有限公司);脑心浸液肉汤(brain heaet infusion broth,BHI,青岛高科园海博生物技术有限公司);活/死细菌染色试剂盒(美国Invitrogen公司)。
1.1.2仪器 扫描电子显微镜(日本日立有限公司);X射线光电子能谱仪(美国热电公司);接触角测试仪(德国克吕士公司);电感耦合等离子体发射光谱仪(美国热电公司)。
1.2 材料制备及表征
1.2.1载银的HEP/CHI聚电解质多层膜制备 将直径10 mm的钛片用80、120、240、320、500、600、800、1 000、1 200、1 500和2 000目砂纸连续抛光,然后依次置于丙酮、无水乙醇、去离子水中各超声清洗3次,每次5 min,标记为Ti; 然后放入2.5 mol/L的氢氧化钠溶液中60 ℃活化12 h,取出后用煮沸去离子水超声清洗5次,每次2 min,之后将钛片放于煮沸去离子水中浸泡1.5 h,标记为pTi;然后浸入2 mg/ml聚赖氨酸溶液(PLL)中12 h,取出钛片,去离子水中漂洗,吹干,标记为pTi-P。将pTi-P依次浸于10 mg/ml的HEP溶液中(预先调节pH=7)和2 mg/ml CHI中(预先用冰醋酸调节pH=4)各15 min。重复4次,最后一层是HEP,标记为pTi-P-LBL。将pTi-P-LBL浸泡在pH为10、浓度为1 mg/ml的硝酸银溶液中,室温下浸泡0.5 h,干燥后得到表面载银的样品,标记为pTi-P-LBL-Ag。制备过程如图1所示。

图1 钛片上载银的HEP/CHI聚电解质多层膜的制备工艺
1.2.2样品表征 各组选1个样品干燥后喷金30 s,利用扫描电子显微镜观察表面形貌的变化。各组选1个样品,利用X射线光电子能谱仪分析表面元素组成和含量。各组选5个样品,利用接触角测试仪室温下测量样品表面亲水性能的改变。各组选1个样品利用硝酸/盐酸(1 ∶3)混合液溶解表面的银,通过感应耦合等离子体质谱仪测定钛片表面总载银量。
1.3 抗菌性能评价为评价制备材料的抗菌能力,使用BHI培养基将金黄色葡萄球菌制成浓度为1×107CFU/ml的细菌悬液,进行以下评价。
1.3.1抑菌圈法评价 取100 μl细菌悬液均匀涂在琼脂固体培养基上,每组取1个样品正面朝下放置在培养基上,37 ℃培养24 h,拍摄记录各个样品周围抑菌环的大小。
1.3.2浊度法评价 每组取3个灭菌样品放入24孔板,每孔加入2 ml菌液,37 ℃培养,分别于4、6、8、10、12、24 h吸取150 μl溶液用酶标仪测量波长660 nm下的吸光度,通过浊度法评价材料抗菌能力。
1.3.3活死细菌染色评价 每组取1个灭菌样品放入24孔板并加入2 ml菌液,37 ℃培养24 h,取出样品,PBS漂洗后,活/死细菌试剂盒染色10 min,荧光显微镜观察各样品表面细菌黏附数量及活死细菌比例。
1.3.4涂板法评价 每组取1个灭菌样品放入24孔板中并加入2 ml菌液,37 ℃培养24 h,取出样品PBS漂洗后,置于5 ml离心管并加入3 ml PBS,超声3 min,涡旋震荡3 min,将样品表面的细菌分散在PBS中,取100 μl涂板,37 ℃培养24 h后进行观察。
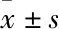
2 结果
2.1 样品表征
2.1.1表面形貌 各步反应后表面形貌的扫描电子显微镜照片显示:碱热处理形成均匀的纳米孔,并有大量的杆状物(图2A);PLL沉积后,杆状物增粗(图2B);静电层层自组装后,多孔结构的孔隙被填充、孔径明显缩小,说明多层膜成功组装在表面(图2C);载银后,表面孔隙进一步缩小,出现形状不规则的颗粒,证明载银表面构建成功(图2D)。

图2 各样品的表面形貌 ×100 000A: pTi; B: pTi-P; C: pTi-P-LBL; D: pTi-P-LBL-Ag
2.1.2元素分析 图3是各步反应后表面元素变化的X射线光电子能谱全谱图,如图所示,聚赖氨酸沉积后(pTi-P),Ti 2p峰的减少和N 1s峰的出现,证明PLL已成功吸附到多孔钛表面上;HEP/CHI组装后(pTi-P-LBL),Ti 2p峰消失和S 2p峰出现,证明了层层组装成功;硝酸银浸泡后(pTi-P-LBL-Ag),Ag 3d峰出现,证明了银已成功装载到材料表面。

图3 各组样品表面 X射线能量色散谱全谱
X射线光电子能谱元素高分辨检测获得表面各元素的原子百分比,结果显示:随着反应进行,表面钛原子百分含量持续下降,表明钛基底逐渐被覆盖;含有大量氮原子的PLL修饰后,表面N原子含量大幅上升;HEP和CHI中氮原子含量较PLL低、且HEP含有硫元素,因此,层层组装表面(pTi-P-LBL)氮含量降低和硫元素出现以证明HEP和CHI被组装在钛表面;硝酸银浸泡后表面银原子含量显著提高,证明银成功装载在涂层上。见表1。

表1 不同样品表面各元素原子百分含量(%)
2.1.3水接触角 通过接触角测量仪测量监控涂层制备过程,见表2。Ti、pTi、pTi-P 的水接触角分别为(59.79±2.50)°、(8.46±1.57)°、(11.76±0.95)°,组间差异有统计学意义(P<0.05),说明碱热活化和聚赖氨酸沉积成功实现。层层组装过程中,由于CHI比HEP更疏水,所以HEP组装表面的水接触角显著低于CHI组装表面,且呈现锯齿形波动,每次组装后表面水接触角与前一步有显著性差别(P<0.05),证明多层膜组装成功。与HEP/CHI组装膜相比,载银表面水接触角显著增加到(35.45±2.74)°,亲水性变差,间接证明银装载成功。以上结果表明多层膜和银已成功地结合在多孔钛表面。

表2 各组样品静态水接触角
2.1.4银定量 电感耦合等离子体发射光谱仪检测涂层表面载银量,结果显示表面载银总量34.24 μg,表明银成功装载到自组装涂层上。
2.2 抗菌评价
2.2.1抑菌环 抑菌圈试验测试样品对周围的金黄色葡萄球菌的生长影响,见图4,只有载银样本周围出现透亮的抑菌环,表明载银表面可以通过释放银离子以抑制或杀死周围细菌。

图4 各组样品抑菌环结果A: pTi;B: pTi-P-LBL;C: pTi-P-LBL-Ag;黑色虚线:抑菌圈
2.2.2浊度法 通过浊度法测量溶液体系中细菌数量,见图5。吸光度值与溶液中细菌的数量呈正相关,样品在与细菌共培养24 h后,只有pTi-P-LBL-Ag组吸光度值无增长,证明载银表面可以完全抑制或杀死周围细菌。
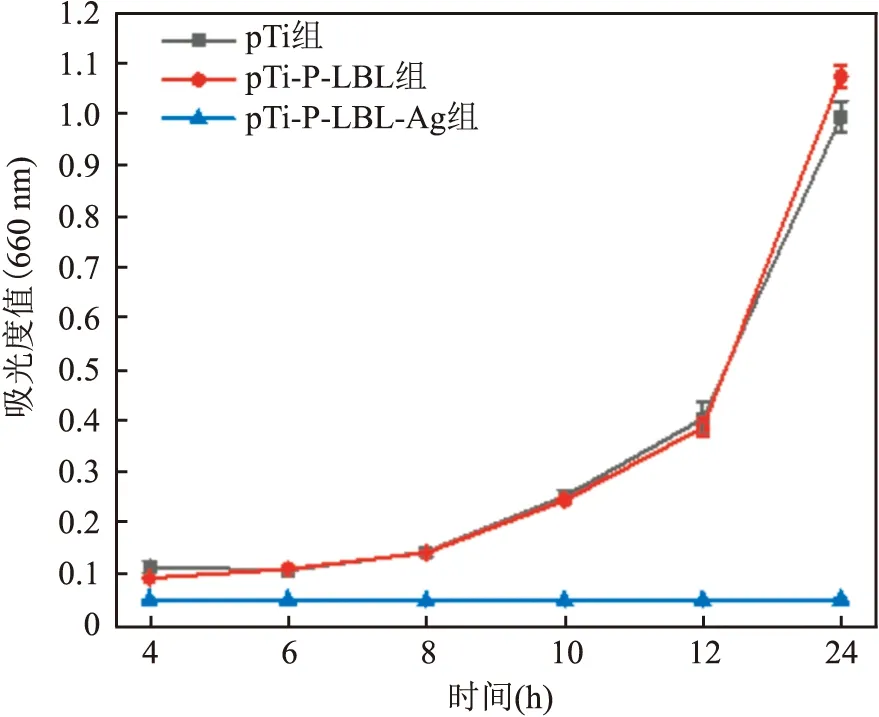
图5 浊度法检测溶液中细菌增殖结果
2.2.3活/死细菌荧光染色 原位活/死细菌荧光染色法直接检测材料表面抗菌能力,如图6所示,细菌在pTi、pTi-P-LBL表面快速和广泛黏附,表面绿色面积大于红色,表明细菌活力良好;pTi-P-LBL-Ag表面细菌附着量较未装载银的表面少,且死细菌占比高,表明载银表面具有较好的抗菌和杀菌性能。

图6 各样品表面原位活/死细菌荧光染色结果 ×100A: pTi; B: pTi-P-LBL; C: pTi-P-LBL-Ag;绿色:活菌;红色:死菌
2.2.4涂板法 样品表面黏附细菌重新分散于溶液后,采用涂板法直观显示细菌数量,结果如图7所示,pTi和pTi-P-LBL组的培养皿中几乎长满细菌,而pTi-P-LBL-Ag组没有菌落。结果表明载银表面具有良好的抑菌/杀菌性能。
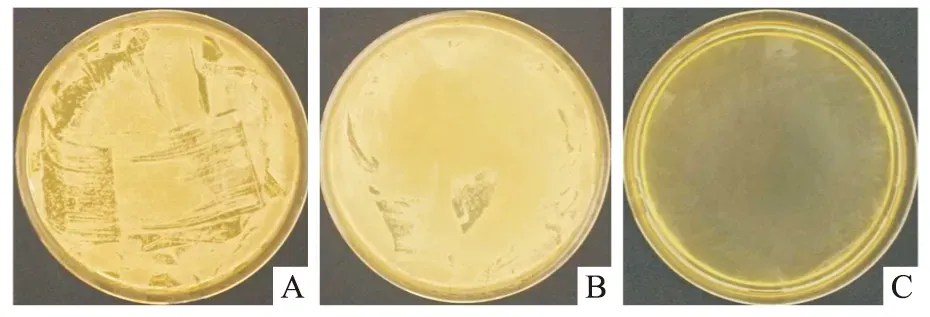
图7 样品表面黏附细菌涂板照片A: pTi; B: pTi-P-LBL; C: pTi-P-LBL-Ag
3 讨论
钛及其合金已经广泛用于牙科种植体并取得良好的临床效果,但细菌所致种植体相关并发症是导致愈合延迟、种植体失败和再次手术的主要因素[2,6]。研究[7]表明,口腔作为人体第四大菌库,细菌种类约700多种,其中部分菌种会在植入手术后,快速黏附于种植体表面且促进其它细菌定植和生物膜成熟。黏附细菌形成生物膜可以保护细菌免受抗生素和人体免疫系统的攻击[8],是细菌所致种植体并发症治疗困难的主要因素[9],所以构建抗菌涂层可以减少细菌的初始黏附和随后的生物膜形成,有效地预防该类并发症的发生[5]。
LBL是一种通过静电相互作用使多聚阴离子和多聚阳离子连续吸附在材料表面的技术。该技术具有工艺简单、制备条件温和、厚度可控的特点,适用于构造复杂医疗装置的表面修饰[6]。HEP是一种硫酸化的糖胺聚糖,在聚合物链中有高含量的硫酸基团,从而可形成高负电荷的聚合物[10]。CHI是一种天然甲壳素多糖生物高分子材料,具有成本低、无毒、可降解性高、生物相容性好等优点[5];同时,由于活性羟基和氨基官能团的存在,CHI表现出独特的成膜特性和高正电特征[11]。因此,可以将CHI与HEP通过静电组装修饰在材料表面形成平滑的涂层。Zhou et al[5]将HEP和CHI进行交联形成聚电解质多层膜并进行小鼠前成骨细胞系MC3T3-E1细胞实验,结果显示多层膜能有效促进成骨细胞在钛表面的分化和增殖。然而,很多种植体并发症都与细菌侵入有关,仅在表面上制备聚电解质多层膜无法避免细菌所致并发症,故装载抗菌物质以赋予材料抗菌性能,可以有效降低细菌所致并发症的发生率[5]。
银具有广谱抗菌性,且不易产生细菌耐药[3]。目前,银抗菌机制主要分为两种:释放杀菌和接触杀灭[12]。释放杀菌是指银及其化合物在液体环境中产生Ag+以破坏细菌并抑制细菌繁殖。接触杀灭是指当细菌直接接触载银表面而被杀死。口腔中大量致病菌会导致种植体周围软硬组织炎症,进而引发种植体周围软组织封闭能力下降和周围骨的吸收,最终导致治疗失败;另外,细菌黏附在种植体表面并形成生物膜是细菌所致并发症难以根治的主要原因,故抑制或杀死种植体表面黏附的细菌和抑制种植体周围细菌增殖是保障种植体长期疗效的有效手段[13]。金黄色葡萄球菌对钛金属亲和力高,可以快速黏附且介导其它细菌在种植体表面定植和促进生物膜成熟[7],是导致种植体周围炎症尤其是化脓性感染的重要致病菌[14],故本研究采用金黄色葡萄球菌评价修饰表面的抗菌能力。通过抑菌圈法和浊度法证明载银表面具有对周围细菌的杀灭能力,活死细菌染色和细菌涂板证明载银表面可以防止细菌黏附和生物膜形成。故载银表面可以显著降低由细菌引起并发症的发生率,是钛基植入材料表面改性的有效手段。
综上所述,该实验采用层层自组装技术在钛材的多孔表面构建聚电解质多层膜并进一步装载纳米银,实现了种植体周围抗菌和种植体表面抗菌,且对种植体感染和相关并发症有很好的防治效果。该表面技术在增加钛基种植体的抗菌性能方面有良好的应用前景。
