诺卡酮对抑郁样行为和海马中PKA/CREB/BDNF信号通路的影响
2022-06-06王凯新王三旺翟庆龄孟凡涛陈金波
王凯新,王三旺,翟庆龄,赵 娣,刘 晶,孟凡涛,李 晨,陈金波
抑郁症是一种发病率较高且容易复发的精神疾病,其特征是情绪低落、快感缺乏、思维迟缓等,严重者可有自杀倾向,近年来抑郁症的患病率呈逐年上升趋势[1]。传统抗抑郁药物一般需要几周到几个月的治疗周期,并且近50%的抑郁症患者治疗反应差或没有反应[2]。诺卡酮(nootkatone)是一种天然存在的倍半萜烯类,是有益智作用的中草药提取物[3]。研究[4]表明诺卡酮具有改善认知功能损伤的神经保护作用,但是其对慢性应激诱导抑郁表型的影响作用和机制尚不明确。海马神经再生受损与抑郁症的发生和发展密切相关,许多抗抑郁药物通过增加海马神经再生起到治疗抑郁症的作用[5],脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)作为抑郁症的重要致病基因在脑内广泛分布,尤其是海马脑区[6]。该研究用慢性不可预知应激(chronic unpredictable stress,CUS)建立小鼠抑郁模型,研究诺卡酮对小鼠抑郁表型的影响,同时检测海马脑区神经再生和蛋白激酶A(protein kinase A,PKA)/环腺苷酸反应元件结合蛋白(cyclic adenosine monophosphate response element-binding protein,CREB)/BDNF信号通路相关蛋白的表达,以探讨诺卡酮的抗抑郁作用及其机制,为新型抗抑郁药物的研发提供理论基础。
1 材料与方法
1.1 实验动物雄性24只SPF级C57BL/6小鼠(20~25 g,8周龄),购自济南朋悦实验动物繁育有限公司[许可证号:SYXK(鲁)20190003]。每笼饲养5只,饲养温度(22±2)℃、相对湿度(55±5)%、12 h/12 h光暗循环的环境,动物可以自由获取食物颗粒和水。实验过程中动物处置均符合滨州医学院附属医院动物伦理委员会标准。
1.2 试剂与仪器诺卡酮(nootkatone)购于美国Sigma公司,批号:C5724;RNA组织提取试剂盒购于广州Omega公司;RNA反转录试剂盒购于大连Takara公司;RIPA裂解液及Tween-20购自于上海碧云天生物技术有限公司;AceQ qPCR SYBR Green Master Mix试剂盒购自于南京诺唯赞生物科技股份有限公司;鼠抗β-actin、兔抗CREB、兔抗磷酸化环磷酸腺苷反应元件结合蛋白(phosphorylated cyclic adenosine monophosphate response element-binding protein,p-CREB),兔抗PKA均购于美国Cell Signaling Technology公司;兔抗BDNF、免疫荧光双皮质素(doublecortin,DCX)抗体购于英国Abcam公司;驴抗鼠二抗IR Dye680LT、羊抗兔二抗IR Dye800CW购自美国Li-COR公司;ALexafluor 546驴抗兔荧光二抗购于美国Thermo Fisher公司;小鼠自主活动试验数据用Any-maze软件分析,购自于美国Stoelting公司。双红外激光成像系统Odyssey Sa 购自美国Li-COR公司;共聚焦显微镜(FV1200)购自日本东京奥林巴斯有限公司。
1.3 实验步骤及分组将小鼠随机分为3组,即对照组、CUS 组、CUS+诺卡酮组。CUS组、CUS +诺卡酮组小鼠连续给14 d CUS,同时,每天在应激之前腹腔注射等剂量的0.9%氯化钠溶液或10 mg/kg诺卡酮,对照组仅每天腹腔注射等剂量的0.9%氯化钠溶液。CUS是按照实验室先前研究报道的步骤进行[7],应激包括束缚1 h、摇晃和拥挤1 h、夹尾20 min、24 h光照、8 ℃冷水中游泳5 min、湿盒4 h、电击10 min,每天随机给予小鼠任意一种上述应激,以确保实验的不可预测性。第15天进行蔗糖偏好试验,第16天进行强迫游泳试验,第17天进行自主活动试验。第18天将部分小鼠断头处死,在冰盘上取脑,用0.9%氯化钠溶液冲洗干净后,将小鼠左右侧海马迅速剥离取出,并放入液氮速冻,储存在-80 ℃中备用。部分小鼠进行灌注固定,取脑进行免疫荧光。
1.4 糖水偏好试验在整个CUS过程中,给予对照及实验小鼠双瓶纯水适应,小鼠可以自由选择饮水,以免小鼠对饮水位置偏好导致结果偏差;实验前禁水4 h,测试时小鼠单笼饲养,一侧给予一瓶纯水,另一侧放置一瓶1%(w/v)蔗糖溶液,使小鼠可以自由选择纯水或蔗糖溶液;在测试结束时,通过称重来计算摄入量。根据以下公式计算蔗糖偏好值:蔗糖摄入量/(蔗糖摄入量+水摄入量)。
1.5 强迫游泳试验小鼠被放在装有新鲜自来水(温度:24 ℃±1 ℃,高度:15 cm)的圆柱形玻璃容器(高25 cm,直径10 cm)中测试6 min游泳,前2 min内记录小鼠首次出现静止不动状态的时间即潜伏期,后4 min中记录小鼠不动状态的总持续时间。小鼠在水面漂浮或只有维持呼吸和漂浮的必要轻微运动被定义为不动状态。
1.6 自主活动试验小鼠在单笼适应4 h后,轻轻放在测试装置(40 cm×40 cm×40 cm)的中心位置,小鼠可以自由活动。小鼠的运动通过安装在笼子上的红外光电传感器进行监控,记录小鼠30 min内的运动情况。
1.7 实时荧光定量PCR(RT-PCR)按照Omega公司的组织RNA提取试剂盒说明书提取总RNA,用RNA反转录试剂盒生成cDNA,然后用AceQ qPCR SYBR Green Master Mix试剂盒进行荧光定量PCR,具体反应条件:95 ℃、5 min,95 ℃、10 s,60 ℃、30 s,40个循环;相关引物序列如下:BDNF,(Forward)5′-CCCTGGCTGACACTTTTGAG-3′,(Reverse)5′-TCCAGCAGAAAGAGCAGAGG-3′;β-tubulin,(Forward)5′-AGCAACATGAATGACCTGGTG-3′,(Reverse)5′-GCTTTCCCTAACCTGCTTGG-3′。根据荧光曲线的循环阈值(cycle threshold,Ct),按照2-ΔΔCt方法计算目的基因的相对表达量。
1.8 Western blot用RIPA组织细胞裂解液从海马组织中提取总蛋白。用BCA法进行蛋白质定量,随后加入5×蛋白上样缓冲液,在100 ℃条件下煮沸8 min。各个样品用8%~15%的分离凝胶进行SDS-PAGE电泳,并转到PVDF膜上,后用TBST溶液(20 μmmol/L Tris-HCl,pH 7.4,150 μmmol/L NaCl,0.1% Tween-20)配制的5%脱脂奶粉封闭90 min,之后加入一抗(1 ∶1 000),4 ℃摇床孵育过夜。之后孵育二抗(1 ∶5 000),室温摇床90 min。经双红外激光成像系统成像并识别灰度进行分析。
1.9 免疫荧光实验
1.9.1灌注小鼠 使用4%水合氯醛将小鼠深度麻醉,用0.1 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)经左心室灌注,肝脏变白后更换4%多聚甲醛灌注固定,断头取脑后,4%多聚甲醛固定过夜,30%蔗糖溶液脱水。用OCT冷冻切片包埋剂包埋脑组织,冰冻切片,切片厚度为40 μm。
1.9.2免疫荧光染色 取含有海马区域的切片进行DCX免疫荧光染色。将含有1%牛血清白蛋白、3% Triton X-100、0.3%驴血清的PBS液室温封闭1 h;兔抗DCX(1 ∶1 000)一抗,4 ℃过夜; 加Alexa Fluor 546驴抗兔(1 ∶300),室温孵育4 h;用抗荧光衰减封片剂封片。在共聚焦荧光显微镜下观察海马齿状回染色结果并拍照。
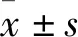
2 结果
2.1 诺卡酮对CUS诱导的小鼠抑郁行为的影响根据流程图(图1A)进行CUS刺激和诺卡酮注射,之后测定抑郁行为。单因素方差分析显示CUS刺激和诺卡酮给药对糖水偏好值有影响,差异有统计学意义(F=20.88,P<0.05)。进一步比较分析结果显示,与对照组比较,CUS组糖水偏好百分比降低(P<0.05);与CUS组比较,CUS+诺卡酮组糖水偏好百分比增加(P<0.05),见图1B。单因素方差分析显示CUS刺激和诺卡酮给药对强迫游泳潜伏期有影响,对强迫游泳的不动时间亦有影响,差异皆有统计学意义(F=19.11,P<0.05;F= 9.46,P<0.05)。进一步比较分析结果显示,与对照组相比,CUS组强迫游泳潜伏期降低(P<0.05)和不动时间增加(P<0.05);与CUS组比较,CUS+诺卡酮组强迫游泳潜伏期增加(P<0.05)和不动时间降低(P<0.05),见图1C。为评估小鼠运动活动情况,对小鼠进行自主活动试验,比较分析结果显示各组之间小鼠每2 min的运动距离(P>0.05)及30 min内运动总距离差异均无统计学意义。见图1D。

图1 诺卡酮对CUS诱导的小鼠抑郁行为的影响A:实验设计图;B:糖水偏好试验;C:强迫游泳的潜伏期及不动时间测试;D:自主活动试验;1:对照组;2:CUS 组;3:CUS + 诺卡酮组;与对照组比较:*P<0.05;与CUS 组比较:#P<0.05
2.2 诺卡酮对CUS模型小鼠海马BDNF的表达的影响单因素方差分析显示,CUS刺激和诺卡酮给药对BDNF mRNA和蛋白表达有影响,差异有统计学意义(F= 9.98,P<0.05;F= 6.58,P<0.05)。进一步比较分析结果显示,与对照组比较,CUS组海马中BDNF mRNA和蛋白表达水平降低(P<0.05);与CUS组比较,CUS+诺卡酮组BDNF mRNA和蛋白表达水平升高(P<0.05)。见图2。
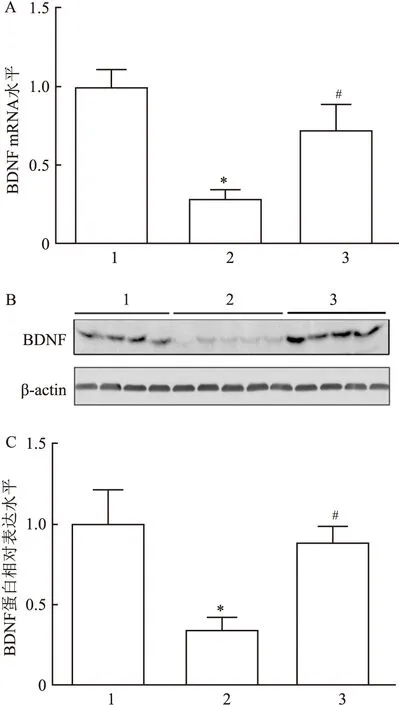
图2 诺卡酮对CUS诱导的小鼠海马脑区BDNF表达的影响(n=5)A:BDNF mRNA相对表达水平;B:BDNF蛋白检测Western blot图;C:BDNF蛋白水平统计图;1:对照组;2:CUS组;3:CUS +诺卡酮组;与对照组比较:*P<0.05;与CUS组比较:#P<0.05
2.3 诺卡酮对CUS模型小鼠海马PKA/CREB信号通路的影响单因素方差分析显示,CUS刺激和诺卡酮给药对PKA和p-CREB的表达水平有影响,差异有统计学意义(F=14.90,P<0.05;F=11.46,P<0.05)。进一步比较分析结果显示,与对照组比较,CUS 组海马中PKA和p-CREB表达水平降低(P<0.05);与CUS组比较,CUS+诺卡酮组海马中PKA和p-CREB的表达水平升高(P<0.05)。见图3。
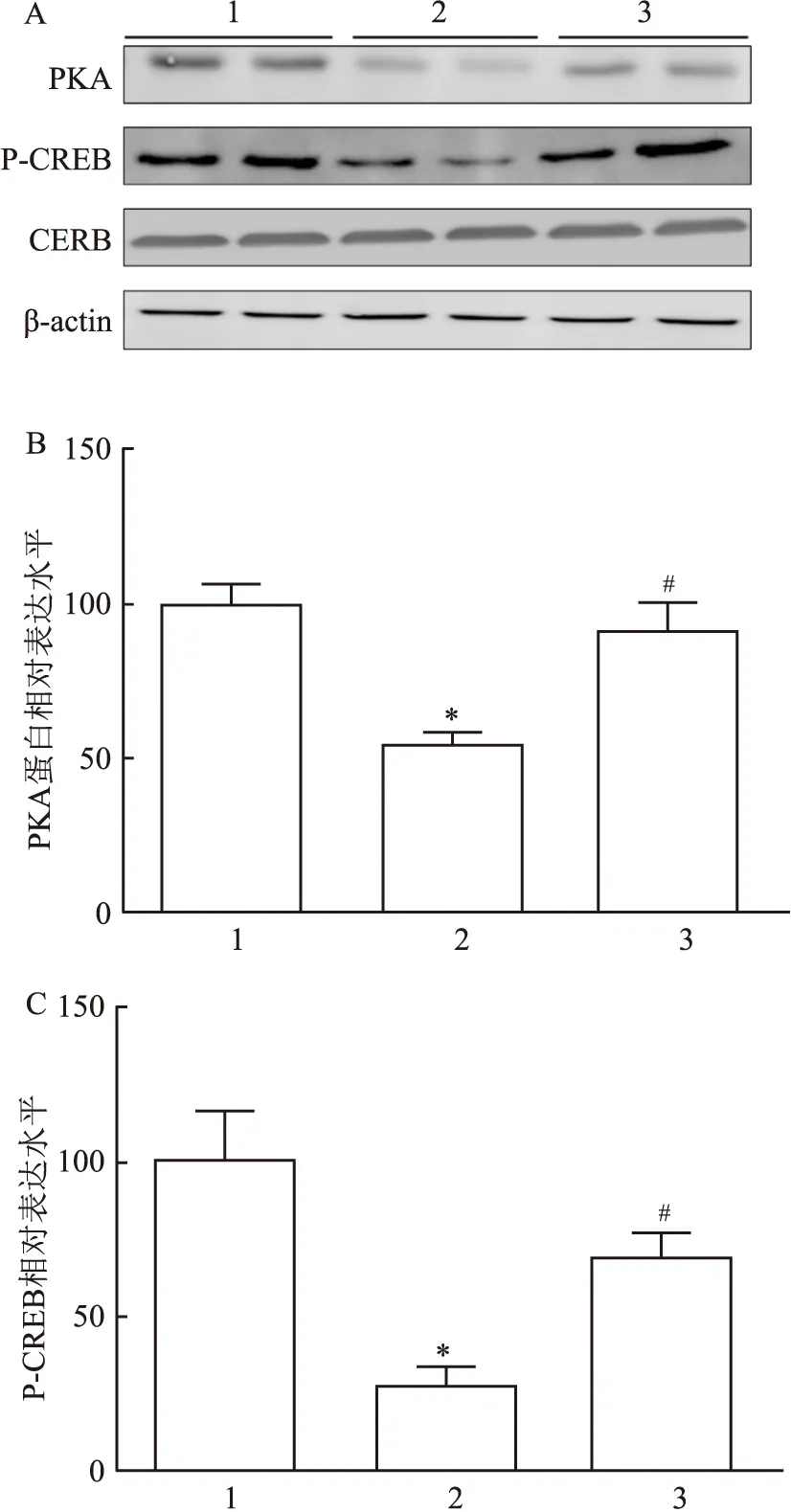
图3 诺卡酮对CUS诱导的小鼠海马脑区PKA和p-CREB表达的影响A:PKA和p-CREB蛋白检测Western blot图;B:PKA蛋白定量分析;C:p-CREB蛋白定量分析;1:对照组;2:CUS组;3:CUS+诺卡酮组;与对照组比较:*P<0.05;与CUS组比较:#P<0.05
2.4 诺卡酮对CUS模型小鼠海马齿状回神经元再生的影响单因素方差分析显示,CUS刺激和诺卡酮给药对DCX标记的神经元数量有影响,差异有统计学意义(F=8.01,P<0.05)。进一步比较分析结果显示,与对照组比较,CUS组海马DCX标记神经元数量降低(P<0.05);与CUS组比较,CUS+诺卡酮组DCX标记神经元数量增加(P<0.05)。见图4。
图4 诺卡酮对CUS诱导的小鼠海马脑区DCX标记神经元数量的影响A:DCX免疫荧光图 ×40;B:DCX阳性细胞定量结果;箭头所示:海马齿状回;1:对照组;2:CUS组;3:CUS+诺卡酮组;与对照组比较:*P<0.05;与CUS组比较:#P<0.05
3 讨论
研究表明,诺卡酮具有多种药理特性,如杀菌、抗氧化和抗过敏活性[8];诺卡酮具有通过TLR4/NF-κB/NLRP3通路抑制神经炎症而发挥神经保护和改善认知功能障碍的作用[9]。最近研究[10]报道诺卡酮具有通过激活Keap1/Nrf2/HO-1抗氧化途径而发挥抗肝损伤诱导的抑郁和焦虑的活性。因此,该研究在CUS所诱导的小鼠抑郁模型上验证了诺卡酮的抗抑郁活性。结果显示,诺卡酮具有明显的抗抑郁作用,与以前的报道一致[11],表明诺卡酮对多种方式导致的抑郁症均有治疗作用。
BDNF是脑内一种非常重要的神经营养因子,具有广泛的神经保护和再生的作用[12],是抑郁症发病和治疗的重要标志蛋白[13]。该研究结果显示,诺卡酮可以明显改善CUS诱导的抑郁表型的同时,也明显改善了CUS诱导的BDNF表达降低,表明BDNF可能在诺卡酮的抗抑郁活性中发挥重要作用。研究[14]表明抑郁症的发病和一些抗抑郁作用均涉及到PKA/CREB通路的调控,并且PKA/CREB通路具有明显的调控BDNF表达的活性;该研究进一步评价了诺卡酮对PKA/CREB通路的影响,结果显示诺卡酮可以显著增加CUS导致的PKA和p-CREB表达的降低,提示PKA/CREB通路可能参与了诺卡酮对BDNF表达的调控作用。
情绪的掌控主要由海马脑区负责,同时研究[15]证明哺乳动物的海马脑区中存在一个最独特的现象,即整个生命过程中都可以有神经再生。而神经再生在抑郁症的发病机制中起着重要作用,是应对压力应激的关键修复反应。DCX仅出现于神经元形成的前3周,是未成熟神经元的可靠标记。研究[15]表明DCX阳性神经元主要存在于海马齿状回脑区中,CA1、CA3中没有DCX信号,即神经再生主要发生在海马齿状回脑区,而在CA1、CA3中较少,因此主要通过检测海马齿状回的DCX阳性神经元来判断神经再生的情况。该研究表明CUS可导致海马齿状回神经再生障碍,而诺卡酮可以改善海马齿状回的神经再生,说明诺卡酮可能通过改善神经再生而发挥抗抑郁作用。
综上所述,该研究表明诺卡酮可能通过增加海马齿状回神经再生及激活PKA/CREB通路增加BDNF的表达而发挥抗抑郁活性。诺卡酮可作为抗抑郁药物研究的新的候选化合物,该研究为新的抗抑郁药物开发奠定了基础。
