TLR4/NF-κB 信号通路在SiO2所致矽肺模型肺泡巨噬细胞脂质代谢调控中的作用
2022-06-06赵婧焦卓亚王娟刘璐
赵婧,焦卓亚,王娟,刘璐
山西医科大学汾阳学院预防医学教研室,山西 汾阳 032200
作为常见的职业病,矽肺是由于长期暴露在游离二氧化硅(SiO2)中引起肺组织出现弥漫性纤维化病变的全身性疾病。临床尚缺乏针对该病的根治性治疗手段。肺泡炎症性应激、弥漫性肺纤维化、矽结节的产生是矽肺的主要病理改变[1]。研究表明肺泡上皮细胞炎症性应激是矽肺病程中的重要节点,缓解或阻断该进程可阻滞病程;SiO2激活肺泡巨噬细胞(macrophage)是致使肺泡上皮细胞炎症的“扳机”[2,3]。Zhang 等[4]指出,在正常生理状态,巨噬细胞中的脂质的摄入与代谢处于动态平衡,受粉尘中SiO2等的刺激其脂质代谢进程受阻,巨噬细胞中脂质沉积,促进细胞泡沫化,释放多种炎性因子,加重肺组织损伤。Hou 等[5]报道肺泡上皮巨噬细胞过度载脂以致细胞泡沫化贯穿在整个矽肺纤维化的病理过程中。因此进一步揭示巨噬细胞脂质代谢的调控机制,有可能阻滞矽肺的病程发展甚至是逆转。Hegde 等[6]指出许多生化信号分子如转化生长因子β1(transforming growth factor-β1,TGF-β1)、结缔组织生长因子(connnective tissue growth factor,CTGF)等参与肺泡的脂质代谢过程。近来Toll 样受体4(Toll like receptor4,TLR4)/核因子κB(nuclear factor-κB,NF-κB)通路在矽肺肺间质纤维化中的作用引起关注。大量的动物实验证实巨噬细胞中TLR4/NF-κB 信号被激活后,促进下游炎性介质的释放,加重炎性应激以及引起更重的肺损伤[7],但是TLR4/NF-κB 信号是否参与巨噬细胞脂质代谢的调控,尚未有定论。本研究通过建立大鼠矽肺模型,分离并培养其肺泡巨噬细胞,研究TLR4/NF-κB信号对巨噬细胞脂质代谢的调控,初步探讨矽肺的病理机制,为临床提供研究数据。
1 材料和方法
1.1 实验动物、主要试剂和主要仪器
实验动物:SPF 级SD 雄性大鼠36 只,7~8 周龄,体质量(200±20)g,从中国医学科学院医学实验动物研究所采购,动物使用许可证号:SCXK(京)2018-0039;本研究经本院实验动物管理伦理委员会审核批准(IACUC 批准号:2019-079)。
主要试剂:二氧化硅,纯度99.99%,粒径(2.25±2.08)μm(美国Sigma 公司)。TLR4、MyD88、NF-κB抗体(德国Rebstock 公司),兔抗大鼠磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(美国Santa 公司),免疫组化试剂盒(南京建成生物有限公司),苏木精-伊红染色(hematoxylin-eosinstaining,HE)试剂盒(上海碧云天生物技术公司),酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(美国Amresco 公司),油红O 染色试剂盒(北京华夏远洋科技有限公司)。
主要仪器:LIOOS600T 生物显微镜(日本尼康公司),-80 ℃深冷冰箱(德国维根斯公司),Leica RM2135 组织切片机(德国Leica 公司),高速低温离心机(北京六一仪器厂),实时定量PCR 仪(加拿大Delong America 公司)。
1.2 实验方法
1.2.1 大鼠矽肺模型构建和分组处理 所有SD 大鼠适应性喂养1 周后,按随机数字表法分为正常组(Normal)、模型组(Model)、抑制剂组(Inhibitor),每组12 只。矽肺模型大鼠采用如下方法制作[8]:将SiO2粉尘与生理盐水制成悬浮液(SiO2浓度为100 mg/mL),使用前先用高压锅进行灭菌。将大鼠麻醉后,模型组、抑制剂组大鼠一次性气管内缓慢滴注(速度过快会导致大鼠呛咳,呼吸困难)1 mL SiO2悬浮液,滴注过程中留意大鼠粗大湿罗音,表明已经滴注到气管,轻抚大鼠双肺,使药液分散均匀,正常组大鼠一次性滴注等剂量生理盐水。2 周后,从模型组挑选2 只大鼠处死,取出肺,肉眼可看到椭圆形灰白色,质地较硬的白色小结节,视为造模成功。
2 周后开始给药,抑制剂组大鼠每天耳缘静脉注射TAK-242(TLR4/NF-κB 信号特异性抑制剂),剂量为0.5 mg/kg,每日1 次,正常组和Model 组每天定时耳缘静脉注射等剂量的生理盐水。
1.2.2 支气管灌洗液标本采集 4 周后,将大鼠诱导麻醉处死,无菌剥离气管,左主支气管处插管,以丝线结扎,以PBS 缓冲液反复冲洗左肺,收集支气管灌洗液(bronchial lavage fluid,BALF),离心,留取上清,置入深冷冰箱中;打开大鼠胸腔,无菌操作台上取出肺,肉眼观察各组大鼠肺组织的解剖学变化,然后以液氮封存,置入深冷冰箱中,待测。
1.2.3 肺组织病理学改变 取出各组10%大鼠肺组织,采用10%甲醛固定24 h 切片,HE 染色,光镜下观察病理改变。
1.2.4 ELISA 测定大鼠BALF 中IL-6 和TNF-α 含量取出各组BALF,离心后留取上清,严格按照ELISA试剂盒要求进行,采用多功能酶标仪检测各组大鼠BALF 中IL-6 和TNF-α 的含量。
1.2.5 肺泡巨噬细胞的分离 使用双层医用灭菌纱布过滤BALF,重复操作5 次后,离心,收集沉淀,用无血清的培养液冲洗3 次,每次2 min,置于培养皿中,加入适量RPMI1640 培养液,置入37 ℃,5% CO2,饱和湿度条件下培养,弃去未贴壁生长的细胞,培养皿中贴壁生长的即为大鼠肺泡巨噬细胞。
1.2.6 油红O 染色观察大鼠肺泡巨噬细胞脂滴形成调整各组肺泡巨噬细胞浓度,以3×104个/孔接种于6孔培养板中,置入37 ℃,5% CO2培养箱常规培养24 h后,4%甲醛固定30 min,PBS 清洗2 次,每次5 min,进行油红O 染色,无菌水清洗后,显微镜下观察细胞中脂滴的形成。
1.2.7 PCR 检测肺泡巨噬细胞中各脂质代谢基因表达 采用RT-PCR 检测脂质代谢相关基因脂肪酸合成的乙酰辅酶A 羧化酶(ACC)基因、固醇调节元件结合蛋白-1(SREBP)基因、脂肪酸合成酶(FAS)基因的表达。步骤如下:调整各组肺泡巨噬细胞浓度,以5×104个/孔接种于96 孔培养板中,置入37℃,5% CO2培养箱常规培养24 h,常规提取各组细胞的总RNA,测定其纯度和完整度[9,10],逆转录合成cDNA,PCR 仪进行扩增。以2−ΔΔCt表示基因的相对表达量。
1.2.8 Western blot 检测肺泡巨噬细胞中TLR4、MyD88、NF-κB 表达水平 调整各组肺泡巨噬细胞浓度,以1×104/孔接种于24 孔板中,置入37 ℃,5% CO2培养箱常规培养24 h,常规提取目标蛋白TLR4、MyD88、NF-κB,测定蛋白浓度,准确量取50 μg,电泳将蛋白分离,转膜,脱脂奶粉封闭,以(1:500)比例稀释,维持4 ℃过夜孵育,次日,加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(1:1500),经显色,曝光、显影、定影后,以GAPDH 为内参表示蛋白的表达水平。
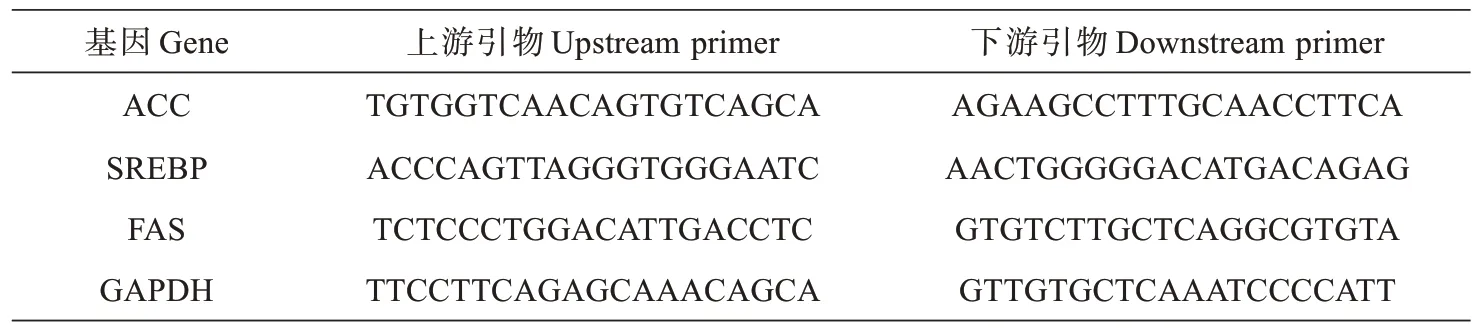
表1 引物序列Tab.1 Primer sequences
1.3 统计学分析
数据统计采用SPSS 16.0 软件,作图工具采用Graphpad5.01,组间比较采用t检验,P<0.05 表示具有统计学差异。
2 结果
2.1 大鼠肺组织损伤
HE 染色结果显示,正常组大鼠肺组织结构完整,未见充血、扩张、出血以及纤维增生现象,肺泡腔结构清晰,肺泡壁厚度均匀,无水肿、增宽、渗出等,肺部微血管未见异常;模型组大鼠肺泡腔内大量炎性细胞填充,肺泡壁增厚明显,正常肺泡结构数量明显减少,间质充血明显,可见较多的粉尘样物质,出现结节性的细胞颗粒,部分结节纤维化明显,呈现片状分布,肺部微血管壁明显增厚;抑制剂组大鼠肺组织的病理损伤明显缓解,稍见结节,正常肺泡结构数量较模型组明显增多,见图1。
2.2 大鼠BALF 中IL-6 和TNF-α 含量
ELISA 结果显示,与正常组相比,模型组、抑制剂组大鼠BALF 中IL-6 和TNF-α 的水平明显升高(P<0.05),与模型组相比,抑制剂组大鼠BALF 中IL-6 和TNF-α 的水平明显下降(P<0.05),见图2。
2.3 大鼠肺泡巨噬细胞的脂滴形成
油红染色结果显示,与正常组相比,模型组、抑制剂组大鼠肺泡巨噬细胞油红O 阳性细胞的比例明显升高(P<0.05),与模型组相比,抑制剂组大鼠肺泡巨噬细胞油红O 阳性细胞的比例明显降低(P<0.05),见图3。
2.4 大鼠肺泡巨噬细胞脂质代谢基因的表达
PCR 结果显示,与正常组相比,模型组、抑制剂组大鼠肺泡巨噬细胞中ACC、SREBP、FAS 的表达明显升高(P<0.05),与模型组相比,抑制剂组大鼠肺泡巨噬细胞中ACC、SREBP、FAS 的表达明显降低(P<0.05),见图4。
2.5 肺泡巨噬细胞中TLR4、MyD88、NF-κB 表达水平
Western blot 结果显示,与正常组相比,模型组、抑制剂组大鼠肺泡巨噬细胞中TLR4、MyD88、NF-κB 的表达明显升高(P<0.05),与模型组相比,抑制剂组大鼠肺泡巨噬细胞中TLR4、MyD88、NF-κB 的表达明显降低(P<0.05),见图5。
3 讨论
矽肺是主要由职业暴露、自身免疫降低引起的慢性炎症性纤维化疾病,属于一种职业病,在我国玻璃行业、水泥行业、矿山行业、石材加工以及陶瓷行业中的发病率逐年升高,致使从业人员出现慢性阻塞性肺病和肺结核等诸多疾病,危害健康,严重影响这些行业生产力的提高[11]。因SiO2诱发矽肺的机制尚未完全明确,目前的治疗以免疫抑制以及给予糖皮质激素为主,不能有效控制纤维化进展[12]。因此深入研究矽肺机制,寻求其可靠的靶向位点,在临床药物的开发中具有重大意义。
机体肺组织对于粉尘颗粒(主要含SiO2)的清除主要是通过肺泡巨噬细胞穿过上皮细胞层易位实现的。因此肺泡上皮巨噬细胞的病变在矽肺机制中扮演着重要的作用。Du 等[13]研究显示当机体暴露于SiO2环境中,作为抵御外界刺激的第一道防线,肺泡巨噬细胞借助脂质和蛋白质分子间的相互作用将进入组织的SiO2吞噬,但是无法将SiO2消化掉,而造成脂质(多为胆固醇)多度负载。Fang 等[14]报道巨噬细胞胆固醇代谢紊乱,SREBP 表达升高,胆固醇合成骤增是巨噬细胞泡沫化的关键因素,而以脂滴形式存在的胆固醇刺激ACC 和FAS 的合成,致使巨噬细胞中脂质摄入、酯化、排出紊乱,最终造成巨噬细胞的生物活性降低,崩解死亡。本研究构建大鼠矽肺模型,提取、分离、培养肺泡中的巨噬细胞,结果显示模型组大鼠的巨噬细胞的脂质沉积明显增加,脂质代谢因子基因的表达明显升高,进一步证实巨噬细胞的脂质代谢在矽肺中的作用。
研究显示巨噬细胞受吞噬的SiO2的毒性作用,释放大量的致炎性因子,并将炎性信号逐级放大,大量炎性细胞在肺组织中浸润,释放更多的炎症介质如IL-6 和TNF-α 等,引起炎性级联反应,肺组织微循环正常功能受阻,上皮细胞通透性改变,内皮细胞功能障碍明显,致使患者肺损伤[15]。TLR4/NF-κB 信号是机体内重要的炎症介导通路。Liu 等[16]研究指出TLR4 主要在肺组织的血管内皮细胞、巨噬细胞、平滑肌细胞以及气道上皮细胞中表达,在各种肺损伤中发挥调控作用。TLR4 极易被炎症介质TNF-α、IL-6 等激活,将胞外炎性信号递至胞内MyD88,募集转导因子,将炎性级联放大,使NF-κB 发生核移位,启动下游基因的转录,释放炎性介质和趋化因子,发挥炎性正反馈调节,促进肺损伤的病理进程[17]。本研究中注射TLR4/NF-κB 信号特异性抑制剂TAK-242,抑制剂组大鼠的肺组织病理损伤明显减轻,BALF 中IL-6 和TNF-α 的含量明显下降,肺组织中TLR4、NF-κB 的表达随之下降,说明该组大鼠的炎性应激明显受限。对巨噬细胞的研究结果显示,抑制剂组巨噬细胞的脂质沉积明显降低,脂质代谢基因的表达明显下降,说明TLR4/NF-κB 信号参与巨噬细胞的脂质代谢的调控。
综上所述,在SiO2所致大鼠矽肺模型中,TLR4/NF-κB 信号参与肺泡巨噬细胞的脂质代谢的调控,抑制该信号的表达,能明显抑制矽肺的病理损伤。但是如何将这种抑制作用应用到临床矽肺的治疗,尚需更为深入的探讨。
