视黄酸通过TLR4/NF-κB 通路对脂多糖诱导血管炎症与氧化应激的影响
2022-06-06李琛张英杰孙洋王洪新
李琛,张英杰,孙洋,王洪新
1.锦州医科大学附属第一医院心内科,辽宁 锦州 121001;2.锦州医科大学心脑血管药物研究重点实验室,辽宁 锦州 121001
在多种血管疾病中观察到不同程度的血管炎症和氧化应激,包括动脉粥样硬化,高血压和血管老化[1~3]。通常,血管炎症和氧化应激与内皮功能障碍和血管损伤密切相关。二者在心血管疾病中的作用已经得到了广泛的研究。炎症是由血管损伤引起的一个有序过程,它能增强白细胞的粘附性和趋化性,最终引起原位激活。这一过程由细胞因子的局部分泌协调,这些细胞因子的表达是由血管损伤诱导的信号转导网络引起的[4]。氧化应激反映出氧化剂和抗氧化剂之间的不平衡,朝着有利于氧化剂的方向发展[5]。Toll 样受体(TLRs)能够识别病原体相关分子模式(PAMPs)的微生物结构成分。在识别PAMPs 时,TLRs 触发促炎介质的产生[6]。TLRs 也参与了氧化应激的发生[7]。
RA 作为维生素A 的活性衍生物,具有多种免疫调节作用,广泛参与了各种生理进程的调节[8]。同时,RA 具有多种生理功能,包括抗炎[9]和抗氧化[10]。大量研究表明,RA 具有抗炎和抗氧化的作用,但其具体作用机制尚不清楚。因此,本实验进一步探讨RA对血管炎症和氧化应激的影响。
1 材料与方法
1.1 实验对象、实验药品和试剂
健康雄性SD 大鼠40 只,5~6 周龄,体重(200±10)g,由锦州医科大学实验动物中心提供,动物许可证号:SCXK(辽)2014-0004。
视黄酸(纯度≥98%,美国Sigma 公司);视黄酸(RA)乙酰胆碱(Ach)和脂多糖(LPS)(美国Sigma 公司);TLR4 抑制剂(美国Abmole 公司);p-eNOS、TLR4 和NF-κB p65 抗体(美国ABclonal 公司);IL-18、IL-1β、TNF-α、IL-6 和GSH-px ELISA 试剂盒(上海Mlbio 生物科技有限公司);一氧化氮测定试剂盒、总超氧化物歧化酶(SOD)测定试剂盒和丙二醛(MDA)测定试剂盒(南京建成生物技术有限公司);DHE 荧光探针(碧云天生物技术有限公司);eNOS 和β-actin抗体(美国Proteintech 公司)。
1.2 方法
1.2.1 分组及给药 健康雄性SD 大鼠40 只,置于适宜的环境中[(25±2)℃,12 h 光暗循环],适应性喂养7 d后,将大鼠随机分为5 组(n=8):对照组、LPS 组、RA 3 mg/kg 组、RA 15 mg/kg 组和TLR4 抑制剂组(3 mg/kg)。大鼠经RA 和TLR4 抑制剂连续灌胃治疗2 周后,除空白组外,其余大鼠通过腹腔注射LPS (10 mg/kg)以建立急性血管炎症模型。8 h 后收集血清与主动脉,用于血管张力、免疫组化、ELISA 和免疫印迹等实验。
1.2.2 体内离体血管环实验 SD 大鼠经20%乌拉坦麻醉后,取出胸主动脉,并置于冰冷的PSS 溶液中(mM):NaCl (130);KH2PO4(1.18);KCl (4.7);NaHCO3(14.9);CaCl2(1.16);EDTA(0.026);MgSO4·7H2O(1.17),然后小心剔除血管表面的脂肪组织和结缔组织。将长度为1~2 mm 的胸主动脉环悬挂于张力换能器上。在无任何外力的作用下,仪器张力调零。血管环在15 mN 的张力下稳定1h。时间结束后,在浴槽中加入60 mmol/L KCl 诱发胸动脉环收缩,PSS 溶液清洗3次。然后10-6mmol/L 的PE 预收缩胸动脉环,待张力达到平衡稳定时,累积添加梯度浓度的Ach (10-9~10-5mol/L),观察并记录胸动脉环张力的变化情况。PE 诱发胸动脉环的最大血管收缩幅度与初始血管张力之间的差值,作为胸主动脉的最终收缩幅度,在加入梯度的Ach 后张力的变化幅度与最终加入相应剂量Ach 的收缩幅度之比,反应张力的变化。
1.2.3 ELISA 法 按照ELISA 试剂盒说明书,测定血清中IL-18、IL-1β、TNF-α、IL-6 和GSH-px 的水平。
1.2.4 免疫组化法 石蜡切片在60℃烘箱中放置60 min 后进行脱蜡脱水。然后将处理完的切片置于含有抗原修复液的高压锅内,121℃抗原修复3 min。切片冷却至室温后,PBS 清洗3 次,使用3% H2O2室温孵育15 min。然后血清封闭10 min,滴加一抗NF-κB p65(1:100),在4℃中孵育过夜。PBS 清洗切片3 次,滴加二抗,室温孵育30 min。PBS 清洗3 次,滴加有辣根过氧化物酶的切片,在37℃水浴锅孵育30 min。DAB显色,苏木素5min。最后经酒精脱水,二甲苯透明后,封片观察。采用LEIKA 显微镜进行拍摄,LAS V4.3软件分析NF-κB p65的阳性率,核棕色即为阳性。
1.2.5 Western blotting 冻存的新鲜组织从冰箱中取出后,将剪碎的20 mg 组织置于100 μl 的裂解液(RIPA+1% PMSF)中裂解30 min。蛋白浓度通过BCA 法进行蛋白定量。制备10%的分离胶和5%浓缩胶,在90V 的电压下,运行2 h。通过半干转法将蛋白转移至PVDF 膜上。5% BSA 常温封闭2 h。PVDF膜在含有TLR4(1:1000)、eNOS(1:1000)、p-eNOS(1:1000)和β-actin(1:1000)一抗的孵育盒中4℃孵育过夜。TBST 清洗3 次,每次5 min。PVDF 膜在辣根过氧化物酶标记的二抗(1:5000)溶液中,常温孵育1.5 h,ECL 发光显影。
1.2.6 DHE 荧光 将浓度为2 μmol/L DHE 荧光探针滴加在冰冻切片上,在37℃孵育15 min,DAPI 染色5 min。PBS 在暗处清洗3 次,每次5 min。然后在荧光显微镜下进行拍摄。相对荧光强度通过Image J 软件进行分析。
1.2.7 NO、SOD 和MDA 的测定 大鼠血清中的NO、SOD 和MDA 分别通过硝酸还原酶法、WST-1 法和TBA 法进行测定,具体操作方法按照试剂盒说明书进行。
1.3 统计学分析
采用SPSS25.0 统计软件进行数据分析,数据均以表示。多组间显著性检验采用单因素方差分析和LSD 法。P<0.05 认为差异具有统计学意义。
2 结果
2.1 RA 对体内血管舒张功能的影响
在本实验,与对照组相比,LPS 组血管舒张功能显著的降低。经RA 和TLR4 抑制剂治疗后,LPS 组血管的舒张功能得到显著的改善(见表1)。
表1 RA 对大鼠血管舒张功能的影响(,n=4,mN)Tab.1 Effects of RA on vasodilation function in rats (Mean±SD, n=4,mN)
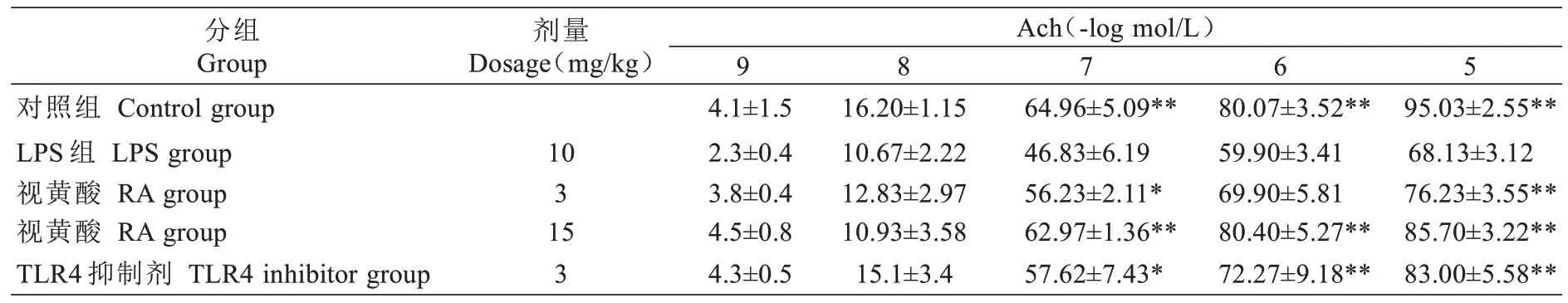
表1 RA 对大鼠血管舒张功能的影响(,n=4,mN)Tab.1 Effects of RA on vasodilation function in rats (Mean±SD, n=4,mN)
与LPS 组比较*P<0.05,**P<0.01
2.2 RA对血管eNOS、p-eNOS和血清NO水平的影响
与对照组相比,LPS 组血管p-eNOS 的表达和NO水平显著的降低,而经过RA 和TLR4 抑制剂治疗之后,p-eNOS的表达和NO水平显著升高(见图1、表2)。
表2 RA 对血管p-eNOS、eNOS 蛋白和NO 水平的影响(, n=3)Tab.2 Effects of RA on the levels of p-eNOS,eNOS protein and NO in blood vessels (Mean±SD, n=3)
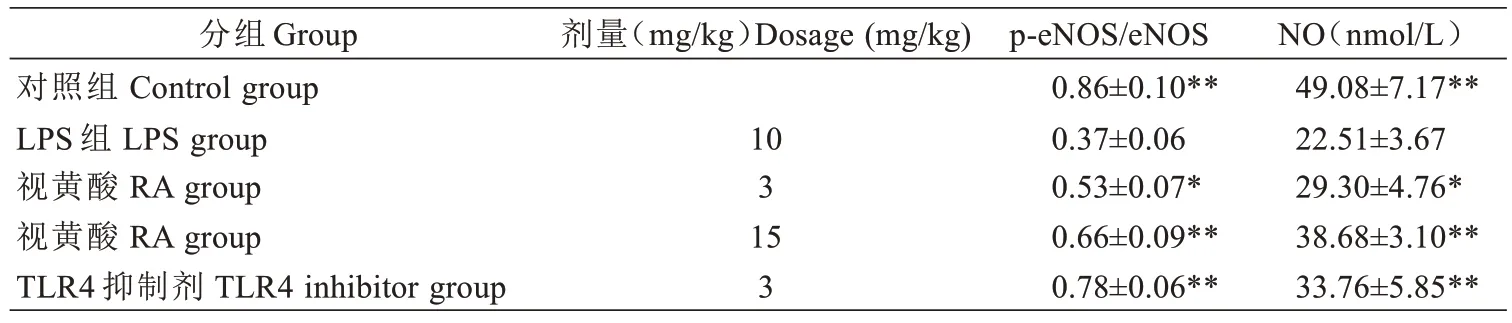
表2 RA 对血管p-eNOS、eNOS 蛋白和NO 水平的影响(, n=3)Tab.2 Effects of RA on the levels of p-eNOS,eNOS protein and NO in blood vessels (Mean±SD, n=3)
与LPS 组比较*P<0.05,**P<0.01
2.3 RA 对血清IL-18、IL-1β、TNF-α 和IL-6 的影响
对照组大鼠经LPS 处理后,LPS 组大鼠血清炎症因子IL-18、IL-1β、TNF-α 和IL-6 显著升高,而RA 组相关炎症因子显著的降低,并且呈浓度依赖性,其中RA 剂量为15 mg/kg 的治疗效果最佳。同时,LPS 组经过TLR4 抑制剂处理后,炎症因子IL-18、IL-1β、TNF-α 和IL-6 也显著的降低(见表3)。
表3 大鼠血清IL-18、IL-1β、TNF-α 和IL-6 含量的变化(, n=8)Tab.3 Changes of serum levels of IL-18,IL-1 β,TNF-α and IL-6 in rats (Mean±SD, n=8)
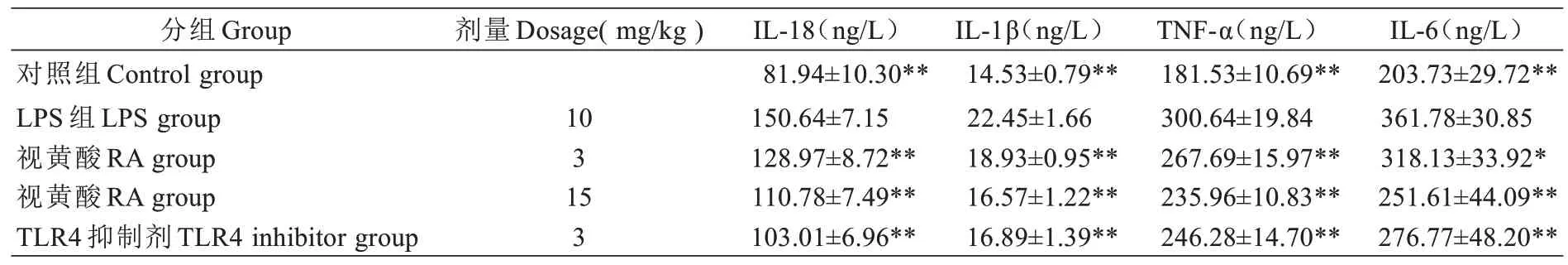
表3 大鼠血清IL-18、IL-1β、TNF-α 和IL-6 含量的变化(, n=8)Tab.3 Changes of serum levels of IL-18,IL-1 β,TNF-α and IL-6 in rats (Mean±SD, n=8)
与LPS 组比较*P<0.05,**P<0.01
2.4 RA 对氧化应激指标ROS、SOD、MAD 和GSH-px的影响
与对照组相比,LPS 组MDA 和ROS 显著升高,而SOD 的生成和GSH-px 释放量显著降低。经过RA和TLR4 抑制剂治疗后,以上的变化得到逆转(见图2、表4)。
表4 RA 对ROS、SOD、MAD 和GSH-px 含量的影响(,n=6)Tab.4 Effects of RA on the contents of ROS,SOD,MAD and GSH-px (Mean±SD, n=6)
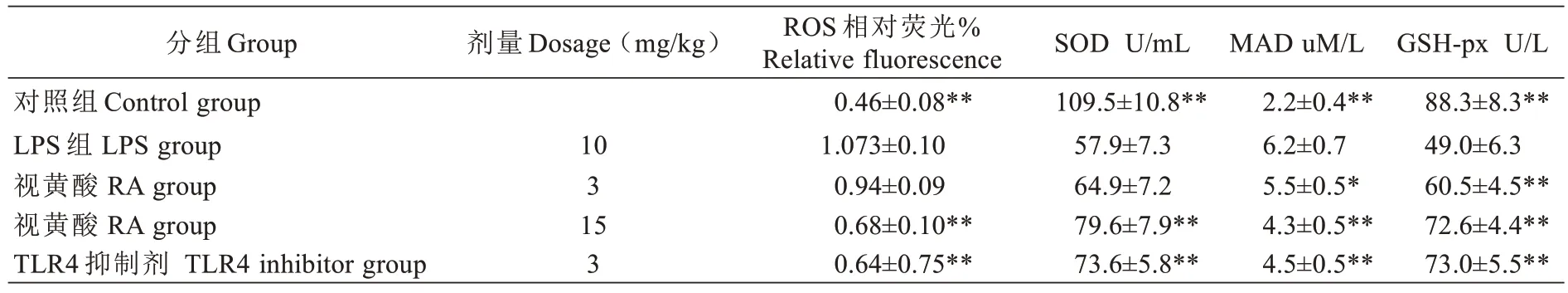
表4 RA 对ROS、SOD、MAD 和GSH-px 含量的影响(,n=6)Tab.4 Effects of RA on the contents of ROS,SOD,MAD and GSH-px (Mean±SD, n=6)
与LPS 组比较*P<0.05,**P<0.01
2.5 RA 对血管TLR4 和NF-κB p65 蛋白表达的影响
与对照组相比,LPS 糖组TLR4 蛋白表达和核NF-κB p65 阳性表达率显著升高,而RA 组能显著的降低TLR4 和核NF-κB p65 阳性表达率,且RA 的作用与TLR4 抑制剂相似(见图3、表5)。
表5 RA 对血管TLR4 的表达和核NF-κB p65 阳性表达率的影响(, n=3)Tab.5 Effects of RA on TLR4 and NF-κB p65 expression rate(Mean±SD, n=3)

表5 RA 对血管TLR4 的表达和核NF-κB p65 阳性表达率的影响(, n=3)Tab.5 Effects of RA on TLR4 and NF-κB p65 expression rate(Mean±SD, n=3)
与LPS 组比较*P<0.05,**P<0.01
3 讨论
氧化应激和炎症密切相关,氧化应激可引起炎症,而炎症又影响氧化应激。二者都可以导致内皮功能障碍的细胞损伤。而内皮功能障碍又促使炎性环境的形成[4]。内皮功能障碍的特征在于血管收缩增加和对Ach 的反应性降低。内皮NO 是关键的血管扩张剂之一,其生物利用度降低可导致内皮功能障碍,而eNOS 控制着NO 的合成[11,12]。实验结果表明,RA能够改善LPS 诱导的血管内皮功能障碍,同时能够增加NO 和p-eNOS 的表达。这表明RA 可能通过增加eNOS 磷酸化,促进NO 的合成释放,最终改善血管内皮功能障碍。
血管炎症和氧化应激参与了内皮功能障碍的发生[4]。炎症是对机体损伤或感染的保护性反应。这是一个复杂的过程,炎症细胞首先识别受影响的组织,白细胞招募进入组织,清除致病因子,修复损伤部位。炎症需要细胞膜,细胞外基质和促炎介质之间的相互作用,而过度炎症可导致慢性疾病的进展,如动脉粥样硬化[2]。氧化应激和促炎过程通常被认为是相互依赖的,许多研究表明氧化应激是炎症直接刺激的结果,反之亦然[13]。在氧化应激中,通常产生过量的ROS,增加MDA,同时,抗氧化系统受损导致SOD和GSH 的降低。实验结果表明,RA 能够降低LPS 诱导升高的炎症因子IL-18、IL-1β、TNF-α 和IL-6 的水平,同时也能够降低ROS 和MDA,升高SOD 和GSHpx。这表明RA 具有抗炎和抗氧化的作用。
LPS 是革兰氏阴性细菌的成分,可以激活TLR4的表达。TLR4 激活后,一些多分子复合物触发信号级联,导致NF-κB 和MAP 激酶的早期激活,并控制促炎细胞因子如TNF-α 和IL-6 的产生[6]。NF-κB 是炎症和氧化应激共同的转录因子,NF-κB 激活后,进一步的促进炎症因子和促氧化基因的转录激活,最终导致血管功能降低[13]。实验结果表明,RA 能够降低LPS诱导升高的TLR4 和NF-κB p65 的表达。而在给予TLR4 抑制剂TAK-242 后,炎症与氧化应激显著的降低,同时,血管内皮功能障碍得到改善。
本研究结果表明,RA 对LPS 诱导的血管内皮功能障碍具有保护作用,同时RA 降低炎症因子的表达并抑制氧化应激的产生,其作用机制可能与抑制TLR4/NF-κB p65 信号通路有关。
