生命早期PM2.5暴露对子代雄性大鼠前额皮层的影响*
2022-06-01梁晓天韩春蕾林本成谢晓倩袭著革
梁晓天,韩春蕾,林本成,石 玥,谢晓倩,李 康△,袭著革△
(1.滨州医学院公共卫生与管理学院,山东 烟台 264000;2.军事科学院军事医学研究院环境医学与作业医学研究所,天津 300050)
世界卫生组织的最新数据表明,全球每年约650万人因空气污染而死亡,占所有死亡人数的1/8,已成为全球最大的健康风险因素之一[1]。对公众健康影响较大的空气污染物包括颗粒物、一氧化碳、臭氧、二氧化氮和二氧化硫。
颗粒物按照其空气动力学直径(aerodynamic diameter,AD)可分为总悬浮颗粒物(AD≤100 μm)、可吸入颗粒物(AD≤10 μm)以及细颗粒物(AD≤2.5 μm)。其中细颗粒物(PM2.5)是健康风险的一个特别重要的来源,因为这些细小的颗粒可以沉积肺部,进入血液循环,并进入器官,对人体产生更大危害。关于PM2.5暴露所引发的呼吸系统疾病[2,3]和心血管系统疾病[4]已经有了许多深入研究,近年来越来越多的研究已经开始注意PM2.5暴露与神经系统疾病的联系。
神经发育障碍又称广泛性发育障碍,美国精神障碍诊断与统计手册(第5版 DSM-Ⅴ)将神经发育障碍归纳为8种:智力障碍、交流障碍、孤独症(自闭症)谱系障碍、注意缺陷/多动障碍、特定学习障碍、运动障碍、抽动障碍和其他神经发育障碍[5]。流行病学研究已经发现,PM2.5暴露会导致神经发育障碍(如:自闭症)发病率的升高,动物实验发现PM2.5暴露能够引起海马炎性反应[6],且发现妊娠期[7]和出生早期[8,9]的PM2.5暴露均对正常神经发育造成影响。
虽然流行病学研究和动物实验的结果表明,妊娠期和出生早期暴露于PM2.5都会影响正常的神经发育,但是在哪一时期暴露于PM2.5更容易对神经发育造成影响此前尚未有相关研究。在本研究中,我们采用PM2.5全身系统性吸入式暴露的方法建立生命早期不同阶段PM2.5暴露动物模型,以神经发育障碍性疾病常见受累脑区——前额皮层为切入点,研究PM2.5暴露对神经发育影响的关键敏感期。
1 材料与方法
1.1 PM2.5采样和处理
在天津市环境医学与作业医学研究所二楼实验室,于2020年11月至2020年12月期间,使用动物全身动态暴露系统(HRH-MNE3026型,北京慧荣和科技有限公司)和PM2.5在线浓缩富集系统(HRH-PM286型,北京慧荣和科技有限公司),为模拟人体在大气中暴露于PM2.5的真实情况,通过实时在线采样8倍恒定浓缩以富集大气环境中的PM2.5,在此期间严格控制全身系统性吸入暴露过程中对颗粒物沉积造成影响的相关因素。外界大气在涡旋气泵的作用下由管道进入颗粒物虚拟切割系统,经过含有PM10和PM2.5冲击模块的冲击切割器,这一过程能够有效除去大气中粒径>2.5 μm的颗粒,将≤2.5 μm的颗粒通入稀释系统。实验方案预先在空压机控制界面设置完成,将过滤后的清洁空气与颗粒物混合后通入暴露舱室,进行全身系统性吸入暴露。
1.2 动物分组及暴露
本实验经天津市环境医学与作业医学研究所动物伦理学委员会批准(批准号:IACUC of AMMS-04-2020-002),所有动物实验均按照相关指南和规定进行。
受孕的SPF级Sprague-Dawley孕鼠12只,购自北京维通利华实验动物技术有限公司,动物合格证号SCXK(京)2016-0006。将孕鼠按体重随机分为对照组(Control group,CG)、母亲孕期暴露组(Maternal pregnancy exposure group,MG)、出生早期暴露组(Early postnatal exposure group,EP)和全围产期暴露组(Perinatal period exposure group,PP),每组3只,进行孕鼠与子鼠的清洁空气或8倍浓缩PM2.5的暴露。其中CG组全程暴露于清洁空气;MG组从妊娠第1日(Gestational Day 1,GD1)起暴露到子鼠出生,即GD21(大鼠妊娠期为21 d),暴露完成后置于清洁空气环境中继续饲养;EP组孕鼠先于清洁空气环境中饲养至分娩,子鼠从出生第1日(Postnatal Day 1,PND1)起暴露到PND21,PP组从GD1一直暴露到PND21。暴露时间为4 h/d。监测结果显示,GD1~21及PND1~21期间暴露舱内PM2.5平均浓度分别为0.398 mg/m3和0.354 mg/m3。实验设计见图1。
为了避免不确定的性别依赖性差异,在这项研究中我们选择雄性子鼠进行相关实验,且对各组的雄性子鼠进行组内平均处理,以排除子鼠数量不同对其体重的影响。最终各组受试雄性子鼠数量为:CG组n=6、MG组n=6、EP组n=6、PP组n=6。所有动物都被饲养在天津市环境医学与作业医学研究所实验动物中心一个光照/黑暗周期为12 h,温度(22±2)℃,相对湿度为50%~70%的房间里。实验过程中大鼠自由摄取食物和水。
1.3 组织收集
暴露结束之后,使用快速断头法处死子鼠,以避免麻醉剂对神经化学的影响。应用4%多聚甲醛对完整剥离的部分大脑进行组织固定,其余大脑迅速在冰上分离出子鼠的前额皮层,并立即放入液氮中冷冻储存,直至使用。
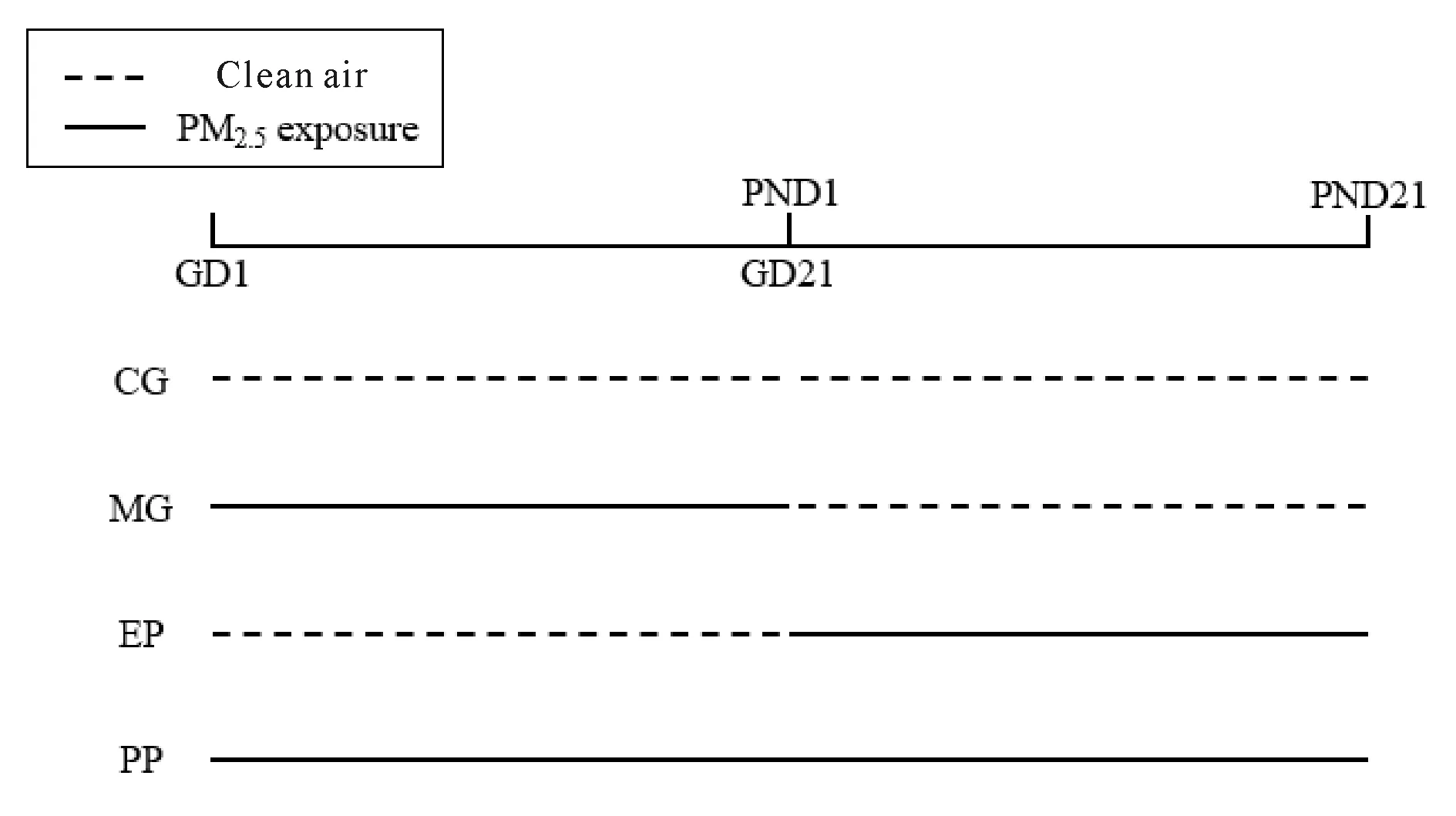
Fig. 1 Experimental protocol for PM2.5 exposure
1.4 病理学检测
子鼠前额皮层组织经过乙醇脱水和石蜡包埋后,切成厚度3 μm的切片,进行常规HE染色,并在Olympus DP26显微镜下观察。
1.5 神经炎性因子检测
采用酶联免疫吸附实验(ELISA)检测子鼠前额皮层神经炎性因子白介素-1(interleukin-1,IL-1)、白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)以及相关生物标志物褪黑素(melatonin,MT)和催产素(oxytocin,OT)的水平。将冷冻的子鼠前额皮层在磷酸盐缓冲液中进行匀浆。总蛋白的测定使用BCA法,使用市售的酶联免疫吸附实验试剂盒(Omnimabs),按照说明书测定IL-1、IL-6、TNF-α、MT和OT水平。
1.6 神经递质检测
采用高效液相色谱-质谱进行子鼠前额皮层神经递质(乙酰胆碱,acetylcholine,Ach)检测。选择前额皮层组织称重,加入4倍量冰冷的0.2%甲酸水,在低温下研磨仪中匀浆得组织匀浆液。取组织匀浆液0.2 ml,加入冰冷的乙腈(0.2%甲酸)0.4 ml,混匀后于4℃静置30 min,然后于4℃离心机中12 000 r/min离心5 min,取上清,每200 μl上清液中加入内标液(0.3 g/L DHBA) 20 μl,取20 μl 上机检测。上机条件:柱温35℃,流动相为乙腈:6 mmol甲酸铵水pH5.5(v∶v)=67.5∶32.5,流速为0.2 ml/min,电喷雾电离方式进行离子化,以正离子多反应检测(MRM)模式进行扫描,离子源及其他相关参数优化为喷雾电压4 500 V,加热温度为450℃,Gas1为50Psi,Gas2为50Psi。
1.7 星形胶质细胞标志物检测
采用免疫印迹实验(Western blot)检测子鼠前额皮层星形胶质细胞标志物。称取冻存的前额皮层组织,放入离心管中,加入适量的组织裂解液RIPA和蛋白酶抑制剂Cocktail,低温下于研磨仪中进行研磨匀浆,冰上裂解30 min,于4℃离心机中12 000 r/min离心15 min,取上清并加入等体积2×SDS-PAGE蛋白上样缓冲液,100℃金属浴10 min,使蛋白充分变性。然后将10 μl总蛋白加样到聚丙烯酰胺凝胶电泳中,转印到PVDF膜上,用5%脱脂奶粉封闭1 h。然后将PVDF膜与Ⅰ抗(CST #80788、GTX 100118)4℃孵育过夜,第2日,用TBST洗涤3次PVDF膜,每次5 min。在室温下与抗兔辣根过氧化物酶Ⅱ抗(ABS20031)孵育90 min后,使用增强化学发光溶液对PVDF膜进行显影。通过使用Image J进行定量的密度分析脑内星形胶质细胞标志物胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)的变化。
1.8 脑组织氧化应激指标检测
采用比色法检测子鼠前额皮层中的氧化应激指标。低温下利用生理盐水在研磨仪中对子鼠前额皮层进行匀浆,于4℃离心机中12 000 r/min离心15 min,取上清使用 BCA 蛋白质定量试剂盒测定蛋白浓度,采用相关试剂盒测定过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和活性氧(reactive oxygen species,ROS)的水平。
1.9 统计学处理
2 结果
2.1 生命早期PM2.5暴露对组织结构的影响
病理学检测结果见图2。CG组:脑皮层组织整体结构基本正常,神经元排列整齐,未见神经元固缩坏死,神经元数量未见明显减少。MG组:脑皮层组织整体结构基本正常,神经元排列整齐,未见神经元固缩坏死,神经元数量未见明显减少。EP组:脑皮层组织整体结构基本正常,神经元排列整齐,个别神经元固缩坏死。PP组:脑皮层组织整体结构异常,部分神经元固缩坏死,可见病理性纤维缠结。
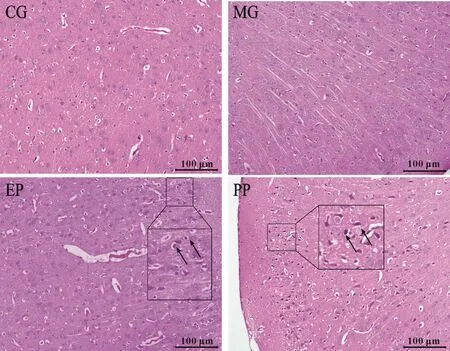
Fig. 2 Pathological examination results
2.2 生命早期PM2.5暴露对神经炎性因子的影响
与MG组和CG组子鼠相比,PP组和EP组子鼠的神经炎性因子IL-1、IL-6和TNF-α水平均有显著升高(P<0.01,表1);MT水平显著减少(P<0.05,表1);我们只观察到了OT的下降趋势,但是没有发现统计学差异(表1)。
2.3 生命早期PM2.5暴露对神经递质的影响
与MG组(0.552±0.043)和CG组(0.493± 0.061)子鼠相比PP组(0.808±0.106)和EP(0.763±0.087)组子鼠Ach水平显著增加(P<0.01)。
2.4 生命早期PM2.5暴露对星形胶质细胞标志物的影响
与MG组(0.697±0.236)和CG组(0.728± 0.239)子鼠相比,PP组(1.091±0.190)和EP组 (0.910±0.167)子鼠GFAP水平呈升高趋势(图3),但是我们发现MG组(0.697±0.236)子鼠的GFAP低于CG组(0.728±0.239)子鼠(图3)。

Tab. 1 Neuroinflammatory factor test results n=6)

Fig. 3 The levels of astrocyte markers were detected by Western blot
2.5 生命早期PM2.5暴露对氧化应激标志物的影响
与CG组子鼠比较,PP组子鼠的CAT显著减少(P<0.01),与MG组子鼠比较PP组子鼠的CAT显著减少(P<0.05,表2);与CG组子鼠比较,EP组子鼠的CAT显著减少(P<0.05)。与MG组和CG组子鼠比较,PP组和EP组子鼠的SOD显著减少(P<0.01)。与MG组和CG组子鼠比较,PP组和EP组子鼠的ROS显著增加(P<0.01)。

Tab. 2 Results of oxidative stress in brain n=6)
3 讨论
神经发育从胚胎期延伸到青春期,依赖增殖、迁移、分化、突触形成、髓鞘形成和凋亡等关键发育过程,处于这些发育关键过程中的神经系统比较脆弱,容易受到干扰,导致各种疾病(如精神分裂症和自闭症)的发生[10]。妊娠期和出生早期是神经系统生长发育的关键期,也是PM2.5暴露导致神经发育毒性的关键期。我们采用PM2.5全身系统性吸入式的方法对大鼠进行暴露,从前额皮层水平对PM2.5暴露影响神经发育的敏感时期进行探索研究,此前相关的研究尚未有报道。
病理学结果显示,全围产期暴露组子鼠和出生早期暴露组子鼠的前额皮层受到PM2.5影响,部分神经元固缩坏死,在一定程度上发生了病理学的改变。而母亲孕期暴露组子鼠和对照组子鼠的前额皮层未发生变化。乙酰胆碱是中枢及周边神经系统中常见的神经传导物质,于自主神经系统及体运动神经系统中参与神经传导。已有研究表明乙酰胆碱偏高可能会导致思维迟缓、记忆力下降、反应能力迟缓等症状。本研究中全围产期暴露组子鼠和出生早期暴露组子鼠神经递质乙酰胆碱的水平高于母亲孕期组暴露子鼠和对照组子鼠。表明PM2.5暴露能够引起前额皮层出现病理损害,而这种病理损害可能是神经性疾病发生的形态学基础。
PM2.5暴露不仅会导致脑组织形态发生病理学改变 ,与胶质细胞活性的改变及神经炎症反应亦密切相关[11]。研究发现,PM2.5暴露通过引发脑内神经炎症对神经发育(如:自闭症)产生影响[12]。炎性因子在PM2.5暴露所致神经毒性中扮演的角色至关重要,在已有研究中,炎性因子在PM2.5暴露后的改变是最为显著和常见的[13]。多项研究表明,神经发育障碍(自闭症)患者体内促炎因子IL-1、IL-6和TNF-α浓度显著高于正常人[14,15]。胶质细胞是大脑中的固有免疫细胞,实时监测脑内环境变化,胶质细胞活性的改变也是PM2.5神经毒性的潜在机制之一。神经炎症通常涉及星形胶质细胞和小胶质细胞的激活[16],GFAP为中枢神经系统受到损伤或者应激之后星形胶质细胞活化的最佳标记之一[17]。有研究发现无论在围产期的PM2.5暴露中还是在出生早期的PM2.5暴露中,GFAP的表达都会发生显著变化[18,19]。MT具有很强的抗炎和抗氧化应激作用,能够通过减缓炎症反应,抑制胶质细胞的过度活化,进而降低神经系统的损伤。MT在自闭症患者体内的合成异常,致使其表达水平降低,从而加剧神经性疾病的发生和发展。临床研究发现,神经性疾病如自闭症、焦虑症等多存在社会功能的异常,而催产素能有效改善社会行为,缓解焦虑情绪[20,21]。研究证实,自闭症儿童患者的外周血中的OT水平低于正常人群[22]。本研究结果显示,与母亲孕期暴露组子鼠和对照组子鼠相比,全围产期暴露组子鼠和出身早期暴露组子鼠的促炎因子IL-1、IL-6和TNF-α表达水平升高,MT水平和OT表达水平降低,GFAP的蛋白表达水平升高。表明炎性反应是PM2.5暴露造成神经损害的基本机制,促炎因子的释放能直接导致神经元凋亡,激活星形胶质细胞,促使其释放更多的细胞因子,对神经系统造成不可逆转的损伤,诱导神经性疾病的发生。
研究表明,氧化应激是PM2.5暴露引起神经毒性的重要机制[23]。当机体遭受PM2.5暴露等外界毒物刺激时,干扰机体的抗氧化防御系统,产生大量的 ROS,破坏原有氧化还原状态的平衡,导致组织细胞发生氧化应激。PM2.5通过诱导氧化应激的产生导致神经元损伤[24]。氧化应激的发生,伴随着CAT、SOD水平的降低和ROS水平的升高。本研究中,与母亲孕期暴露组和对照组子鼠相比,全围产期暴露组和出生早期暴露组子鼠的CAT和SOD的水平均降低,ROS水平升高。表明PM2.5暴露环境下,与母亲孕期暴露组和对照组子鼠相比,全围产期暴露组和出生早期暴露组子鼠更易发生氧化应激反应,从而对神经系统造成损伤。
综上所述,在PM2.5暴露环境下,全围产期暴露组和出生早期暴露组子鼠在病理学表现、神经递质、氧化应激和神经炎症方面的变化要比母亲孕期暴露组子鼠和对照组子鼠更为显著,且全围产期暴露组子鼠与出生早期暴露组子鼠之间无显著性差异。表明出生早期子鼠对PM2.5暴露更为敏感,在此期间PM2.5暴露对子鼠前额皮层发育造成的不利影响更为严重。
