两个大白菜株高相关分子标记在不同群体中的分布检验
2022-06-01马关鹏周麟笔赵大芹赵夏云
马关鹏,周麟笔,2,赵大芹,3*,杨 巍,刘 炼,赵夏云,瞿 飞,王 堃
(1.贵州省园艺研究所,贵州贵阳 550006;2.贵州省农科院山茂园艺工程技术有限公司,贵州贵阳550006;3.贵州省园艺工程技术研究中心,贵州贵阳550006)
大白菜是起源于我国的大宗型蔬菜,在全国均有较大面积的种植[1-3]。大白菜的株高是重要的农艺性状,关系到大白菜的株型、产量等性状,前人研究表明,株高同时受到环境和基因的影响[4]。分子标记作为一种可以有效提高选育品种的手段,受到较多育种人员的青睐。开发适合的分子标记对品种选育有事半功倍的效果。分子标记有AFPL 标记、RAPD 标记、SSR 标记、InDel 标记等。前人已有利用不同的标记进行性状与标记之间的关联开发[5-6]。高颖等[4]利用SSR 标记通过关联分析发现与大白菜抽薹开花时间相关的标记13 个,同时翟文等[5]也发现与植株叶片形态、植株形态等相关的标记76 个。虽然在白菜类蔬菜已有功能标记的开发,但是受限于群体,标记的通用性不强,实际运用不够广泛。利用高密度的SNP构建遗传图谱虽然可达到较高密度的遗传图谱,从而进行QTL 定位开发分子标记,但是成本较高,开发较少,大多数集中在基础研究领域,因此开发的标记不一定能被使用。
贵州省园艺研究所大白菜课题组搜集鉴选了大量矮化的大白菜种质资源,其中现有较矮化的资源105份,进行分离纯化后的资源53 份,使用BC1 不育系进行回交选育的雄性不育系11份,通过小孢子培养获得的DH 系8份,并且构建了诱变纯化60 份材料。且前期构建的高密度遗传图谱进行了株高QTL 的定位,开发了2 个株高相关的InDel 标记,为鉴定其在不同的群体中的情况,使用多个群体进行鉴定研究(其中使用的群体包括85 份F2群体、搜集鉴选的105 份、纯化材料53 份群体,诱变材料纯化60份群体。),以期为提高大白菜的育种效率,降低品种选育的工作量提供科学依据。
1 材料与方法
1.1 材料及其处理
试验材料包括由贵州省园艺研究所大白菜课题组搜集的105份材料(未能完全纯化)、纯化的自交系53 份、经过辐射诱变纯化自交的材料60 份。自购建的(亲本为Gh-4,LL-3)F2代群体85份(表1)。

表1 供试大白菜材料信息
自交系材料经催芽后,低温春化5 d,于2021年6月使用花盆种植于人工气候室,前20 d 保持8℃,后期23℃,长日照条件(12 h 光照,8 黑暗);自交系、搜集资源及诱变资源材料于2020年10月播种育苗,11月定植于蔬菜试验地,定植株距18 cm,行距25 cm。F2代材料分别为株高较高材料Gh-4、株高交矮材料LL-3,以Gh-4 为母本,于2019年进行人工杂交后获得F1代种质,自交后获得F2代种子,2020年播种于育苗盘后选择85 株定植试验地,播种定植时间、株行距和其他材料相同。
试剂:EDTA、NaCl、CTAB、异戊醇、Tris、乙醇购买自索莱宝公司;RNase、琼脂糖购买自上海生工公司;PCR 反应试剂购买自南京诺唯赞生物科技有限公司的Taq DNA Polymerase 购自南京诺唯赞生物科技有限公司。
仪器:超微量紫外分光光度计,德国Implen。
1.2 株高性状调查及InDel 引物来源
参考大白菜DUS 测定标准,对大白菜株高展开测量,测定标准为从植株播种开始后的第65 天后,调查统计株高性状数据进行计算。采用的2 对引物均来自于课题组大白菜基因重测序、进行遗传图谱构建及株高QTL开发得到的InDel标记,引物由南京金斯瑞生物科技有限公司合成。

表2 大白菜株高标记引物
1.3 NDA提取及PCR扩增
采用CTAB 法提取DNA;DNA 提取后使用超微量紫外分光光度计测定浓度。体系如下:ddH2O 13 μL,10 × Taq Buffer(Mg2+plus)2 μL,dNTP Mix(10 mM each)1 μL,Primer1(10 μM)1μL,Primer2(10 μM)1μL,模板DNA 1 μL,Taq DNA Polymerase(5 U/μL)1 μL;反应程序95℃预变性5 min,95℃变性15 s,55℃退火15 s,72℃延伸20 s,72℃彻底延伸5 min。采用琼脂糖凝胶进行电泳,凝胶成像仪进行观察分析,观察条带的有无,有条带记为1,无则记为0。
1.4 数据分析
为简单鉴定分子标记是否可以反应株高情况,就PCR 电泳后各份材料的条带进行统计,并统计材料的株高,使用Microsoft Excel,SPSS19.0进行分析。
2 结果与分析
2.1 株高性状的变异
从图1可知,105群体和53自交系的株高分布较为集中,60 诱变系和F2群体的株高分布较宽。表明F2群体、60诱变系的变异较大,群体间株高的差异较大,自交系群体间的差异较小,株高分布相对集中。

图1 不同群体的株高分布
从表3 可知,在不同群体中,植株株高的差异不一致,由于前期搜集资源时选择的105份资源属于相对较矮的种质,自交系也是在相关矮化的种质里面鉴选出来进行自交纯化的,因此105 群体和53 自交系的变异系数较小,分别为25.24 和22.94,且群体的极差差值也较小。研究的分子标记是根据F2群体构建后的相关数据开发鉴选的,在选择亲本时是属于株高差异较大的组合,因此后代中株高差异较大,变异系数较大,为32.74;诱变纯化的60 份材料经过栽培验证,可能是辐射对植株的遗传物质起到了一定的改变,因此在株高的变异范围也较大,变异系数为31.63,变异系数相较于105 群体及53 自交系群体较大,但是变异程度小于F2群体。

表3 大白菜不同群体的株高性状统计
2.2 分子标记与株高的关系
通过统计分析(表4)发现,试验进行分子标记的4个群体中,每个群体个体均出现无条带情况。统计计数分类表明,在105 群体中,引物1 和引物2 在大部分植株中均未出现标记条带,只在少数个体中出现条带。归类统计计算平均值显示,具有条带的个体平均株高偏矮,但是差异很小,没有明显差异。在53群体及60 群体中,平均株高与条带的有无没有显见的趋势关系,群体株高之间的平均差异小。在F2群体中,引物1出现条带的个体平均值比没有出现的高4.51 cm,引物2 出现条带的个体平均值比没有出现的高3.6 cm,有较为相近的差异;进一步分析发现,如果把2 对引物合计在一起计算,2 对引物都出现条带的植株平均株高比没有出现条带的植株高32.39%(8.23 cm),出现一条带的植株平均株高比未出现条带的植株高29.59%(7.52 cm)。说明可以使用开发的2 个株高相关的InDel标记进行一定范围的筛选工作。
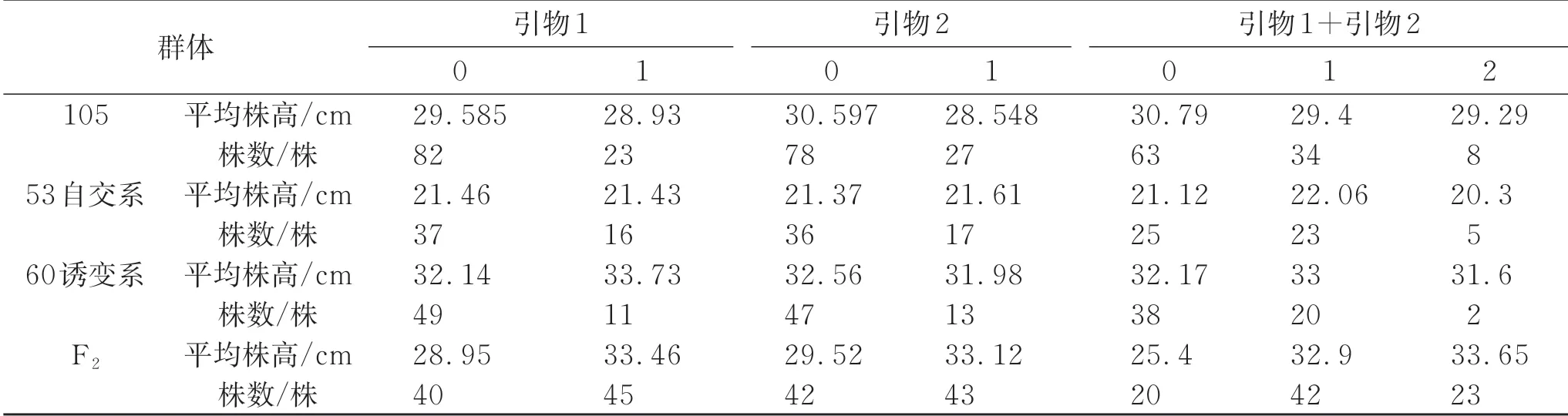
表4 不同引物在不同群体株高中的标记显示情况
3 结论与讨论
分子标记已经广泛用于种质遗传资源多样性等方面的研究[7-8]。但是受限于种质资源、开发成本等条件,广泛用于性状的标记较少[9-10]。大多数标记开发成本高、复杂程度高、使用计算统计复杂阻碍了分子标记的实际应用,因此在育种过程中能使用的分子标记较少。研究利用前期开发的2 个分子标记在不同群体中进行简单统计分析,目的在于探究鉴定较简单的统计方法分析分子标记是否可以反应标记所代表的性状。
研究表明,在105、53、60 群体中的InDel标记和株高关系不明确,分子标记不具鉴定作用;在以Gh-4 为父本的F2群体中,具有双标记的植株高比不具有双标记的植株高32.39%(8.23 cm)。开发的2 个InDel 分子标记可在具有Gh-4 为亲本的群体中进行株高的检验。
由于开发的2 个InDel 分子标记是利用F2群体中的一个亲本进行的,因此在F2的群体中可以简单的按照分子标记的有无大致把植株的高矮分成2 个群体,从其中具有2 个标记的群体中鉴选出具有较高株高性状的植株概率较大,可最大限度的降低投入,提高效率。但在鉴选的过程中也注意到,性状的表现和环境的影响较大,不表示具有双分子标记的植株一定高于没有标记的植株。且选育品种的过程是多性状的综合考量,单独看一个性状可能导致其余性状较差,需要较大的群体数量保证除去目标性状外的其他性状有足够的变异空间,否则过分依赖于分析标记可能导致选育不到需要的性状。因此,分子标记的开发只能减少部分育种工作量,不能代替田间的鉴定。
