水稻高温白化复绿突变体tcd52的遗传分析和分子定位
2022-06-01李军朱梦珂田激旋陈瑜林冬枝董彦君
李军 朱梦珂 田激旋 陈瑜 林冬枝 董彦君


摘 要: 粳稻品種“嘉花1号”经甲基磺酸乙酯(EMS)化学诱变处理,获得一个稳定遗传水稻幼苗高温白化复绿突变体.该突变体在高温(>24 ℃)条件下,二叶期叶色呈白色失绿,三叶期开始复绿,四叶期后与野生型没有明显差异;而在低温(20 ℃)条件下,突变体苗期叶色与野生型一致呈绿色,无白化现象.利用该突变体与“培矮64S”杂交构建F遗传群体,发现苗期的高温白化复绿叶色性状受到一对隐性核基因控制,并将该突变基因()定位在水稻第5染色体上的ID05M16025和ID05M16113分子标记之间的127 kb区间内,经测序推定突变基因是编码PPR蛋白的基因.结果表明:是一个受高温响应且影响水稻早期叶绿体发育的关键基因.今后将进一步对基因进行研究,以加深了解温度对水稻叶绿体分子发育机理.
关键词: 水稻; 叶色突变; 高温敏感; 遗传分析; 分子定位
中图分类号: Q 344 文献标志码: A 文章编号: 1000-5137(2022)02-0243-08
Genetic analysis and molecular mapping of high-temperature albino regreen mutant in rice
LI JunZHU MengkeTIAN JixuanCHEN XuLIN DongzhiDONG Yanjun
(1.College of Life Sciences, Shanghai Normal University, Shanghai 200234, China;2.Institute of Genetics, Shanghai Normal University, Shanghai 200234, China)
Japonica rice variety “Jiahua 1” was treated with Ethyl methyl sulfone (EMS) chemical mutagenesis to obtain a stable genetic rice seedling high temperature albino and regreening mutant . Under high temperature (>24 ℃), the mutant showed white chlorosis at the 2-leaf stage, re-greening at the 3-leaf stage, and no significant difference from the wild type after the 4-leaf stage. By contrast, under low temperature (20 ℃), the leaf color of the mutant at the seedling stage was the same as that of the wild type, and it was green, and there was no albino phenomenon. The F genetic population was constructed by hybridizing the mutant with Peiai 64S. It was found that the high temperature albino regreen leaf color trait at seedling stage was controlled by a pair of recessive nuclear genes. The mutant gene () was located in the 127 kb interval between ID05M16025 and ID05M16113 molecular markers on rice chromosome 5. The mutant gene was presumed to be the gene encoding PPR protein. Collectively, is a key gene that responds to high temperature and affects early rice chloroplast development. In the future, further study of gene will help to deepen the understanding of temperature on the molecular development mechanism of rice chloroplast.
rice; leaf-color mutant; high-temperature sensitive; genetic analysis; molecular mapping
0 引 言
高质量的水稻生产对于保障我国的粮食安全有着极为重要的作用.光合作用能否顺利进行是影响水稻生长发育及产量最主要的因素之一.水稻叶色变化与叶绿体的发育是影響水稻光合作用的主要因素.关于水稻叶色突变的研究已开展多年,目前至少有150种叶色突变体被发现,其中多数突变体基因已经被定位与克隆.在这些叶色基因中不少是温敏感基因,如低温敏感基因有:编码三角状五肽重复序列(PPR)蛋白,,,],,编码50S核糖体L13蛋白;编码RNA聚合酶,与类囊体膜的稳定性有关,编码叶绿体核糖体小亚基蛋白S6的;编码S-磺基半胱氨酸合酶的,编码合成苏氨酰-tRNA合成酶的以及编码伪尿嘧啶合酶等等;但已报道的高温敏感基因仅有:与类胡萝卜素合成相关-()、编码Deg蛋白酶的以及编码谷氨酰-tRNA合成酶()等,且在高温条件下又能复绿的更为少见.因此,对高温白化复绿相关基因进行定位与克隆,可以为进一步解释水稻叶绿体发育的复杂机制奠定基础.
本研究所用的高温白化复绿突变体是水稻品种“嘉花1号”经过甲基磺酸乙酯(EMS)诱变获得的.对该突变体的叶色、光合色素含量、叶绿体显微结构进行了观察和分析,并利用了SSR及InDel分子标记对该突变基因进行了定位,为该基因的分子克隆及分子机理的研究奠定基础.
1 材料与方法
实验材料
本实验所用的突变体是“嘉花1号”干种子经过EMS化学诱变形成的,经多次自交繁殖,当其农艺性状稳定后,再与“培矮64S”杂交获得F代,F代自交得到F代,F代群体作为遗传分析和基因定位材料.
方 法
1.2.1 突变体苗期表型观察
将已发芽的突变体与野生型“嘉花1号”(WT)的种子分别播种于塑料盘中,再将它们分别置于20,24,28,32 ℃的光照培养箱(宁波江南仪器,GXZ智能型)中培养,每日光照12 h,光照强度为180 μmol∙m·s,每天观察幼苗的生长状况,并分别在二叶期、三叶期和四叶期进行拍照.
1.2.2 苗期叶片叶绿素含量的测定
分别剪取在20,24,28,32 ℃培养箱中培养的野生型“嘉花1号”和突变体第3片叶子的中间区域,剪碎后并称取0.02 g,倒入10 mL离心管中,并加入5 mL叶绿素提取液((乙醇)∶(丙酮)∶(水)=5∶4∶1),室温条件下避光处理20 h;然后,将已经溶解全部色素的提取液加入到比色皿中,用分光光度计(METASH-UV5100型)分别测定470,645,663 nm波长的吸光值,并推算苗期叶片中叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(CAR)的含量.实验重复3次,取平均值.
1.2.3 叶绿体亚显微结构的观察
叶片取样过程与1.2.2节相同,然后沿着叶脉方向剪成约8 mm长的片段,放进离心管中,加入2.5%(体积分数)的戊二醛进行固定,随后抽真空,4 ℃下避光保存,之后再经过磷酸缓冲液冲洗,锇酸再固定,乙醇梯度去水,丙酮置换、浸渍、包埋、聚合、修块、切片、醋酸铀染色等一系列处理后,在透射电镜(Hitachi765型)下进行观察拍照.
1.2.4 遗传群体的构建
本研究将“培矮64S”与杂交后代F种子作为遗传分析和基因定位的群体,然后,将发芽F种子播在装有水稻土的托盘中,放置在32 ℃的培养箱中生长,观察叶色变化及其分离比,并选取突变型白化幼苗作为基因定位遗传群体.
1.2.5 DNA的提取
将挑取的亲本幼苗及F代白化幼苗分别利用十六烷基三甲基溴化铵(CTAB)法和TPS法提取其基因组DNA.
1.2.6 基因定位
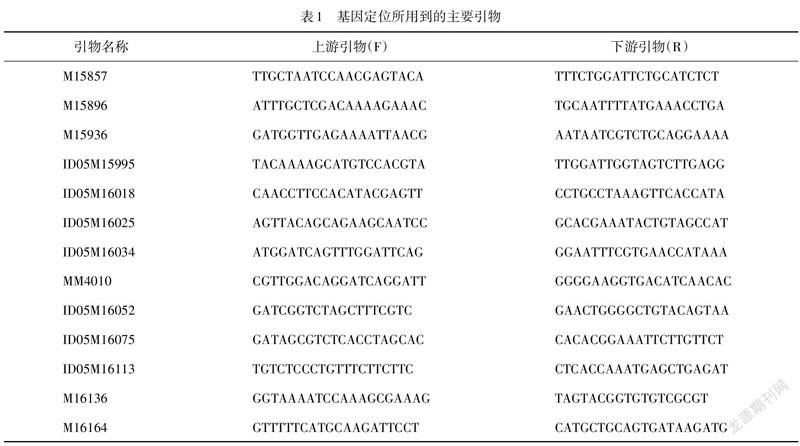
在本实验中,首先利用在“培矮64S”和之间多态性良好的SSR及InDel分子标记,对F代群体的具有白化表型的幼苗进行突变基因定位,确定突变基因在哪条染色体后,扩大遗传群体和更多DNA分子标记(表1),对突变基因进行精细定位.通过网站(http://rice.uga.edu/cgi-bin/gbrowse/rice/)查询得到区间内的全部预测基因,并通过测序验证突变位点.
2 结果与分析
突变体苗期表型
通过对突变体苗期叶色表型的观察(图1),发现在20 ℃时,的叶色从二叶期到四叶期都为绿色,与WT一致;在24 ℃和28 ℃时,其在二叶期表现出叶片白化现象,在三叶期迅速转绿,叶色与WT相仿,在四叶期与WT无明显差异;而在32 ℃时,突变体在二叶期同样表现出白化,三叶期仍为白叶,四叶期基本转绿. 观察结果表明:突变体在低温下(20 ℃)叶色正常,在高温下(>24 ℃)苗期叶色都有白化现象,并随幼苗生长逐渐转绿,是一个高温白化复绿突变体,但其复绿的速度与温度呈负相关.
突变体叶绿素含量变化
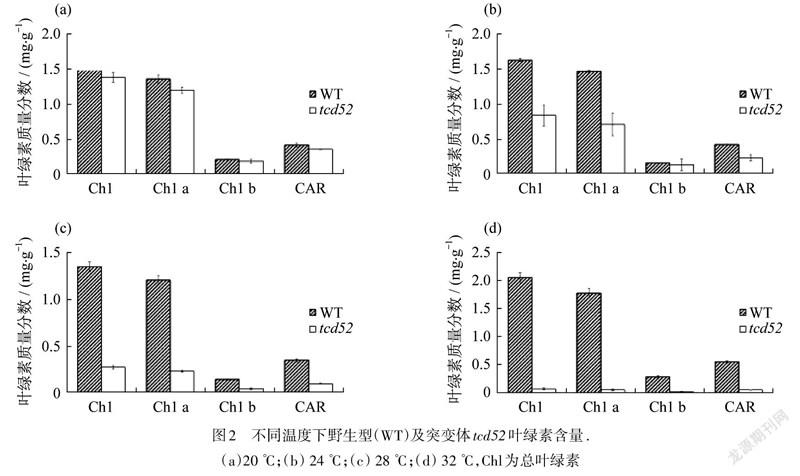
对20,24,28,32 ℃下生长的WT及tcd52突变体的三叶期幼苗的叶片的叶绿素含量进行测定,结果如图2所示.在20 ℃时,WT与tcd52的叶绿素含量无显著差异;24 ℃时,tcd52叶绿素下降到WT的一半;28 ℃时,下降至WT的1/4;而32 ℃时,tcd52中几乎检测不到叶绿素.由此可知,温度越高,tcd52突变体的叶绿素含量下降幅度越大,这与叶色表型变化一致.
突变体叶绿体显微结构
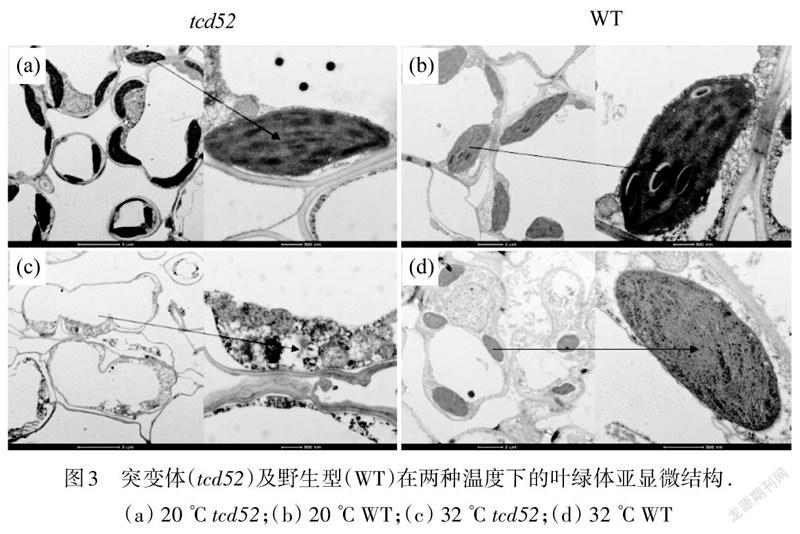
通过透射电镜观察第3叶叶绿体的亚显微结构(图3),发现在32 ℃时,叶片细胞中基本没有完整的、成形的叶绿体结构;而在20 ℃时,与WT的叶绿体结构没有显著差异,与2.1和2.2节叶色和光合色素的变化完全吻合.
群体的遗传分析
“培矮64S”与突变体杂交得到的F代在高温(32 ℃)条件下全表现为绿色,无白化现象,而F代自交得到的F代则苗色分离.对其中F代772株群體调查发现,绿色植株582株,白色植株190株,对其进行卡方检验(=0.062 17),符合分离比3∶1的标准. 由此,推断该高温白化复绿性状是由一对隐性核基因()控制.
基因定位
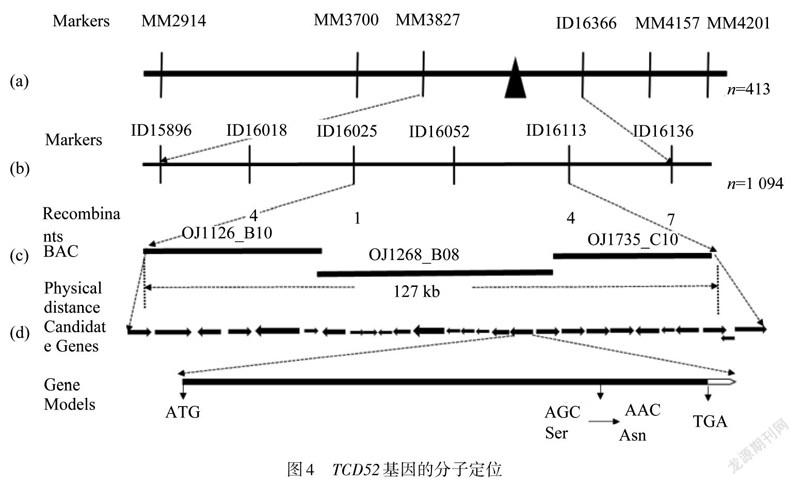
选取22株F代突变型白苗进行连锁分析,发现水稻第5染色体上的分子标记MM2914(图4(a))有强烈的偏态扩增,初步确定位于第5染色体上. 然后将群体扩大到413株,将基因定位在MM3827和MM4201两个分子标记之间(图4(a)),随后将定位群体扩大到1 094株,把该基因定位在ID16025和ID16113两个分子标记127 kb的区间内(图4(b),4(c)).该区域跨越3个BACs(OJ1126_B10,OJ11268_B08,OJ1735_C10)(图4(c))共有27个候选基因,经测序只发现编码PPR蛋白基因()的编码区第2219个碱基G到A的突变,导致第740个氨基酸由丝氨酸变(Ser)为天冬酰胺(Asn)(图4(d)).
3 讨 论
水稻不仅是重要粮食作物,也是单子叶植物和禾本科的模式植物,所以,对水稻叶绿体发育相关基因的研究极其重要.叶绿体是植物特有的半自主性细胞器,自身能够合成部分蛋白质,也受到核基因的调控,在植物的生长发育过程中起到关键作用.叶绿体的发育是影响叶色的最主要因素之一,温敏感的叶色突变体是研究叶绿体发育温度响应机制的理想材料.温敏感的叶色突变体可以分为低温敏感和高温敏感两种类型.在高温敏感的叶色基因中,的破坏会使植株在四叶期后致死;的突变会使水稻的叶色在高温条件下呈现黄色的表型;本研究发现基因只对水稻三叶期前的叶绿体的发育起到重要的作用,它的突变在高温下使叶绿体的结构出现严重缺陷,从而出现白化现象,但在三叶期后其对水稻叶绿体发育的影响显著降低,植株出现复绿.经过基因定位,推定是在水稻第5染色体上的编码PPR蛋白()基因上,由于第2 219位碱基G替换为A,导致第740位的氨基酸由丝氨酸变(Ser)为天冬酰胺(Asn),造成基因功能改变.有趣的是,TANG等也报道了在的突变体说明是复等位突变基因,而是第1 103个碱基C替换成T,导致其编码的第368位氨基酸由苏氨酸(Thr)变为异亮氨酸(Leu)(图5).更有意思的是,虽同为复等位突变基因,但是这两个突变体的表型却有着明显的差异,突变体只有在高温下,才会出现白化表型,并且随着幼苗的生长而逐渐复绿,后期并不会影响植株的生长,是高温白化复绿表型突变体;但突变体表现出苗白化,不受温度的影响,也不会转绿,植株最终枯萎而死,是致死突变体. 比较发现,的突变位置比更加靠前(图5),但两者均未造成提前翻译终止.由此,推测的突变位点所在蛋白结构域对水稻叶绿体发育和植株生长极其重要,并影响着水稻植株生死存亡,而突变位点所在DYW蛋白结构域只影响水稻幼叶绿体发育,并受到温度调控. 结合两个突变体的表型情况及基因的突变情况,还有DYW结构域对叶绿体和线粒体转录本成熟的重要作用,更加确定基因对叶绿体发育以及温度响应具有重要作用.
4 結 论
实验利用EMS化学诱变粳稻“嘉花1号”,获得了由一对隐性基因控制的高温白化复绿突变体.该突变体在高温(>24 ℃)下会出现白化,四叶期转绿恢复正常,叶色表型变化与其叶绿体完整性和叶绿素含量变化相一致.该基因()定位在水稻第5染色体上ID16025和ID16113两个分子标记之间127 kb内,测序发现是一个编码PPR蛋白()基因,是蛋白中一个丝氨酸变(Ser)突变成天冬酰胺(Asn)导致突变体苗色产生高温白化复绿.今后将进一步研究该基因分子机制,以加深对温度影响水稻叶绿体发育机理的理解.
参考文献:
[1] ZHENG C K, ZHOU G H, NIU S L, et al. Phenotype identification and gene localization of premature aging mutant - in rice [J/OL]. Acta Agronomica Sinica,2021:1-13[2022-01-11].http://kns.cnki.net/kcms/detail/11.1809.S.20211202.1852.002.html.
[2] GUO X Q, LUO D, ZHU Q, et al. Research progress on genetic mechanism, exploration and utilization of rice albino mutants [J/OL]. Molecular Plant Breeding,2021:1-19[2022-01-11].http://kns.cnki.net/kcms/detail/46.1068.S.20210609.0919.005.html.
[3] ZHANG P, LIU M L, YE H S, et al. Research progress of rice leaf color mutants [J]. Molecular Plant Breeding,2021,19(17):5712-5719.
[4] YAGN Y R, HUANG Q Q, ZHAO Y N, et al. Advances in rice leaf color gene cloning and molecular mechanism [J]. Journal of Plant Genetic Resources,2020,21(4):794-803.
[5] GOTHANDAM K M, KIM E S, CHO H, et al. OsPPR1, a pentatricopeptide repeat protein of rice is essential for the chloroplast biogenesis [J]. Plant Molecular Biology,2005,58(3):421-433.
[6] WANG Y. Map based cloning and functional analysis of rice white stripe gene [D]. Beijing: Chinese Academy of Agricultural Sciences,2017.
[7] GONG X, SU Q, LIN D, et al. The rice encoding a novel pentatricopeptide repeat protein is required for chloroplast development during the early leaf stage under cold stress [J]. Journal of Integrative Plant Biology,2014,56(4):400-410.
[8] LIU X, LAN J, HUANG Y, et al. WSL5, a pentatricopeptide repeat protein, is essential for chloroplast biogenesis in rice under cold stress [J]. Journal of Experimental Botany,2018,69(16):3949-3961.
[9] DU Y X, MO W P, MA T T, et al. A pentatricopeptide repeat protein DUA1 interacts with sigma factor 1 to regulate chloroplast gene expression in rice [J]. Photosynth Res,2020,147(2):131-143.
[10] SONG J, WEI X, SHAO G, et al. The rice nuclear gene encoding a chloroplast ribosome L13 protein is needed for chloroplast development in rice grown under low temperature conditions [J]. Plant Molecular Biology,2014,84(3):301-314.
[11] YU Y, ZHOU Z, PU H, et al. is required for chloroplast development in rice ( L.) at low temperature by regulating plastid genes expression [J]. Functional Plant Biology,2019,46(8):766-776.
[12] HE Y. Cloning and functional analysis of ATP binding cassette transporter gene in Rice [D]. Beijing:Chinese Academy of Agricultural Sciences,2020.
[13] WANG W J, ZHENG K L, GONG X D, et al. The rice encoding plastid ribosomal protein S6 is essential for chloroplast development at low temperature [J]. Plant Science,2017,259:1-11.
[14] WANG Y, ZHONG P, ZHANG X Y, et al. encoding a putative S-sulfocysteine synthase is involved in chloroplast development at the early seedling stage of rice [J]. Plant Science,2019,280:321-329.
[15] LIN D Z, ZHOU W H, WANG Y L, et al. Rice encoding threonyl-tRNA synthetase is needed for early chloroplast development and seedling growth under cold stress [J]. G3 (Bethesda, Md),2021,11(9):jkab196.
[16] LIN D Z, KONG R R, CHEN L, et al. Chloroplast development at low temperature requires the pseudouridine synthase gene in rice [J]. Science Letter,2020,10(1):8518.
[17] GUO T, HUANG Y X,HUANG X, et al. Map based cloning of - gene from albino to green and multi tiller dwarf in rice [J] Journal of Crops,2012,38(8):1397-1406.
[18] ZHENG K L, ZHAO J, LIN D Z, et al. The rice gene encoding a novel Deg protease protein is essential for chloroplast development under high temperatures [J]. Rice,2016,9(1):13.
[19] LIU W Z, FU Y P, HU G C, et al. Identification and fine mapping of a thermo-sensitive chlorophyll deficient mutant in rice ( L.) [J]. Planta,2007,226(3):785-795.
[20] JIANG S H, ZHOU H, LIN D Z, et al. Identification and gene localization of leaf color temperature sensitive mutants in rice seedlings [J]. Chinese Rice Science,2013,27(4):359-364.
[21] ZHANG X Z. Determination of plant chlorophyll content: acetone ethanol mixture method [J]. Liaoning Agricultural Sciences,1986(3):26-28.
[22] LI C, LIN D Z, DONG Y J, et al. Genetic analysis and gene localization of a temperature-sensitive white striped leaf mutant in rice seedling stage [J]. Chinese Rice Science,2010,24(3):223-227.
[23] POREBSKI S, BAILEY L G, BAUM B R. Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components [J]. Plant Molecular Biology Reporter,1997,15(1):8-15.
[24] ZHANG X Q, ZOU J S, ZHU H T, et al. Genetic analysis and gene localization of multi-Ovary mutant fon5 in rice early maturation [J]. Heredity,2008(10):1349-1355.
[25] GAO Y Y, ZHANG T, ZHOU W H, et al. Identification and gene localization of , low temperature sensitive mutant in rice [J]. Genomics and Applied Biology,2020,39(11):5143-5149.
[26] LEI X Q, WU L L, WANG W J, et al. Identification of , a lethal mutant of albinism at seedling stage of rice and its gene localization [J]. Journal of Shanghai Normal University (Natural Science Edition),2018,47(5):577-584.
[27] WANG X W, AN Y Q, XIAO J W, et al. Research progress on PPR protein regulation of plastoid gene expression and chloroplast development [J]. Journal of Plant Physiology,2020,56(12):2510-2516.
[28] TANG J P, ZHANG W W, WEN K, et al. OsPPR6, a pentatricopeptide repeat protein involved in editing and splicing chloroplast RNA, is required for chloroplast biogenesis in rice [J]. Plant Molecular Biology,2017,95(4/5):345-357.
(責任编辑:顾浩然)
