多表位融合蛋白对动物布鲁氏菌病的诊断价值
2022-05-31徐琳琳白琼琼张金鹏焦阳殷德辉
徐琳琳,白琼琼,张金鹏,焦阳,殷德辉
徐州医科大学公共卫生学院环境与健康重点实验室,江苏徐州 221004
近年来,人兽共患传染病呈现全球蔓延的趋势,如布鲁氏菌病,不仅对人类健康造成巨大威胁,也给世界各国经济带来巨大损失[1]。布鲁氏菌感染雌性动物后,会造成动物流产;且人群对布鲁氏菌普遍易感,人类通过直接接触感染布鲁氏菌的羊、牛、猪等牲畜及其分泌物或排泄物以及进食被布鲁氏菌污染的食品等感染[2]。由于人类布鲁氏菌病的临床表现多样,缺乏特异度,因此诊断十分困难,易被误诊为登革热、疟疾、病毒性出血疾病等[3-5]。因而改进现有的诊断方法,选择合适的诊断抗原十分必要。2015 年 8 月—2018 年 10 月,本研究利用生物信息学相关技术设计一种新的布鲁氏菌多表位融合蛋白(rMEP),并利用该蛋白构建间接酶联免疫吸附试验(iELISA),以实现对牛、羊等家畜血清的检测,旨在探索一种新的布鲁氏菌病血清学诊断方法。
1 材料与方法
1.1 主要试剂及仪器 93份羊血清、74份牛血清,经试管凝集试验(SAT)和玫瑰红平板凝集试验(RBPT)确认为布鲁氏菌病阳性样本;66份羊血清、79份牛血清样本,经SAT 和RBPT 确认为布鲁氏菌病阴性样本。牛、羊血清样本由中国动物卫生与流行病学中心(青岛)提供。大肠杆菌BL21[DE3,生工生物工程(上海)股份有限公司],异丙基-β-D-硫代半乳糖苷(IPTG,美国Sigma 公司),PBS 缓冲液[生工生物工程(上海)股份有限公司],96孔板(美国Corning公司),卵清蛋白(TCI,日本东京化成工业株式会社),HRP-重组蛋白G(美国Thermo 公司),SDS-PAGE 试剂盒(碧云天生物技术有限公司),EL-TMB 显色试剂盒[生工生物工程(上海)股份有限公司],脂多糖(LPS,中国动物卫生与流行病学中心),HRP 标记的山羊抗兔IgG(美国Bioworld 公司),兔血清(天津生物芯片技术有限责任公司);酶标仪(BioTek,美国伯腾仪器有限公司),恒温培养箱(上海精宏实验设备有限公司),电泳仪(Bio-Rad,美国伯乐公司)。
1.2 外膜蛋白选择 根据文献[6-8]选择4 个布鲁氏菌外膜蛋白(OMP),即 OMP16、OMP31、OMP2b、BP26为目标蛋白,在美国国家生物技术信息中心网站 https://www. ncbi. nlm. nih. gov/protein/下载所选蛋白的氨基酸序列,使用蛋白质序列搜索算法工具(https://blast. ncbi. nlm. nih. gov/Blast. cgi)进行氨基酸序列比对,根据比对结果选择布鲁氏菌中的保守氨基酸序列。
1.3 OMP 表位预测 利用 ABCpred(http://www.imtech.res.in/raghava/abcpred/)[9]、Bepipred(http://www.cbs.dtu.dk/services/Bepipred/0)[10]和 COBEpro(http://scratch.proteomics.ics.uci. edu/)[11]三种表位预测工具,预测线性B细胞表位,并选择三种预测工具重叠的B 细胞表位作为候选表位,利用IEDB(http://tools.iedb.org/main/tcell/)表位预测工具预测T细胞表位。
1.4 rMEP 制备 采用原核表达系统制备rMEP,用linke‘rGGGS’串联候选B、T 细胞表位,以免形成铰链区。根据得到的氨基酸序列推断出密码子,并利用优化网站(http://www.jcat.de/)对原核表达系统进行密码子优化。优化后的序列由生工生物工程(上海)股份有限公司进行基因合成,同时加入6 ×His 标签,以便随后进行纯化和鉴定。将合成的基因片段与表达载体pGEM-T 连接,并将其转入大肠杆菌 BL21(DE3)中进行培养,当 OD600值达到 0.6时,用0.5 mmol的IPTG 诱导表达,并在37 ℃下培养4 h。12 000 r/min 离心1 min,离心半径 9.5 cm,收集细菌,用超声破碎后SDS-PAGE 分离,出现目的条带,即确定rMEP表达。
1.5 rMEP纯化 采用镍琼脂糖亲和色谱法。用超声破碎菌体:将收集的细菌菌体用破碎buffer溶解,冰浴中超声破碎菌体,功率400 W,20 min(超声2 s、暂停6 s为1个循环)。超声完毕,4 ℃下12 000 r/min离心20 min,离心半径9.5 cm,弃上清液。沉淀用包涵体溶解Buffer进行溶解,冰浴中用超声破碎,功率400 W,20 min(2 s、暂停6 s 为1 个循环)。超声完毕,4 ℃下12 000 r/min 离心20 min,离心半径9.5 cm,上清做下一步纯化。镍琼脂糖亲和层析:取5 mL Ni-NTA,用10 倍柱床体积的Binding buffer 清洗平衡柱子,流速5 mL/min;上柱,流速为2 mL/min,收集穿透液;10 倍柱床体积的Binding buffer 清洗,流速10 mL/min;Wash buffer 洗杂,流速 5 mL/min,收集洗脱液;Elution buffer 洗脱,流速 2 mL/min,收集洗脱液。各洗脱组分经SDS-PAGE 分离后,将纯度较好的洗脱组分透析到buffer 中,4 ℃过夜后进行阴离子交换层析。阴离子交换层析:取10 mL Q Sefinose FF填料,用10倍柱床体积的Binding buffer清洗平衡柱子,流速5 mL/min;样品上柱,流速为3 mL/min,收集穿透液;5 倍柱床体积的Wash buffer 清洗柱子,流速 2 mL/min;Elution buffer 洗脱,流速 2 mL/min,收集洗脱液。各洗脱组分经SDS-PAGE 分离后,将高纯度组分透析到buffer中,4 ℃透析过夜,0.45µm滤膜过滤分装,-80 ℃保存。
1.6 牛、羊血清中抗布鲁氏菌抗体检测 采用iELISA。纯化的rMEP 用PBS 缓冲液稀释至浓度10 µg/mL,每孔100 µL,4 ℃过夜。PBST 洗涤4次,然后每孔加入1%卵清蛋白封闭液300 µL,37 ℃孵育1.5 h,PBST再次洗涤4次,羊和牛血清用PBS稀释(1∶400)后,每孔加入100 µL,37 ℃孵育1 h,PBST 洗涤4 次,加入1∶5 000 稀释的HRP-重组蛋白G(PBST 稀释),在室温下孵育25 min。PBST洗涤4次,根据EL-TMB显色试剂盒说明书进行显色,每孔加入显色溶液100 µL,室温下将酶标板置于黑暗处,显色5~15 min,加入终止液50µL。酶标仪检测OD450值,所有样品设有复孔。
1.7 rMEP在布鲁氏菌病诊断中的特异性检测 采用特异性试验。为了验证rMEP 在布鲁氏菌病诊断中的特异性,使用已建立的iELISA 来检测其他常见病原菌免疫的兔子血清(耶尔森菌O9、大肠杆菌O157∶H7、副溶血性弧菌、霍乱弧菌和沙门氏菌),二抗使用HRP标记的山羊抗兔IgG(1∶20 000稀释),其他步骤按1.6中iELISA,计算阳性血清OD450值(P)与阴性血清OD450值(N)的比值。P/N>2.1判定为阳性。
1.8 统计学方法 采用GraphPad Prism6.05 软件,绘制受试者工作特征(ROC)曲线,用曲线下面积评价rMEP 的诊断效能,利用约登指数计算cut-off 值,同时分析在cut-off值下的灵敏度和特异度。
2 结果
2.1 rMEP制备和纯化结果 预测并选择了25个重叠的表位作为候选表位,将选择的表位使用linke‘rGGGS’串联后,共获得532 个氨基酸。根据构建的rMEP 氨基酸序列,对原核表达系统进行了密码子优化,然后连接到表达载体pET-28b上,转化到BL21(DE3)细胞中进行IPTG诱导表达、纯化。制备的rMEP相对分子质量约为6×104,纯化后浓度为1.39 mg/mL。
2.2 rMEP 的诊断效能 用iELISA 测试了159份羊血清样本,用rMEP 作为诊断抗原时,ROC 曲线下面积 为 0.998(95%CI:0.993~1.002),cut-off 值 为0.595 5,诊断灵敏度为96.97%(95%CI:0.894 8~0.996 3)、特异度为98.92%(95%CI:0.941 5~0.999 7)。在此cut-off值下,93 份阳性样本中有92 份诊断为阳性,阳性诊断符合率为98.92%;66 份阴性样本中有64 份诊断为阴性,阴性诊断符合率为96.97%。用LPS 作为诊断的对照抗原时,ROC 曲线下面积为0.995(95%CI:0.987~1.002),cut-off 值为 0.716 5,诊断灵敏度为100%(95%CI:0.945 6~1.000 0)、特异度为 95.7%(95%CI:0.893 5~0.988 2)。在此cut-off值下,只有4例阴性样本被误诊为阳性。见表1。
用 rMEP 检测了 153 份牛血清样本,用 rMEP 作为诊断抗原时,ROC 曲线下面积为 0.997(95%CI:0.994~1.001),cut-off 值为0.772 5,诊断灵敏度为98.65%(95%CI:0.927 0~0.999 7)、特异度为96.20%(95%CI:0.893 0~0.992 1)。在此 cut-off值下,74 份阳性样本中有73 份诊断为阳性,阳性诊断符合率为98.65%;79 份阴性样本中76 份诊断为阴性,阴性诊断符合率为96.20%。用LPS作为诊断的对照抗原时,ROC 曲线下面积为 0.987(95%CI:0.973~1.001),cut-off 值为 0.969 5,诊断灵敏度为95.65%(95%CI:0.878 2~0.990 9)、特 异 度 为97.47%(95%CI:0.911 5~0.996 9)。在此 cut-off 值下,有3 例阳性样本被误诊为阴性,2 例阴性样本被误诊为阳性。见表1。
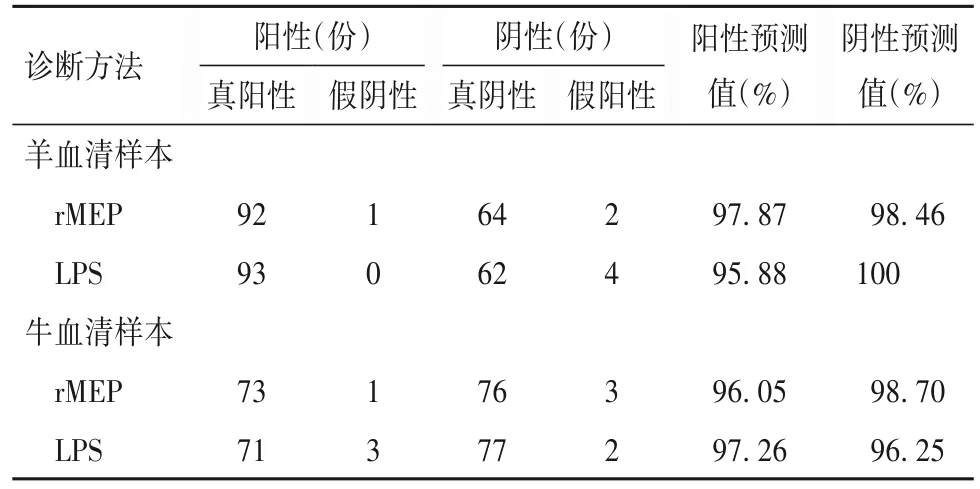
表1 rMEP诊断的阳性预测值、阴性预测值
2.3 rMEP 在布鲁氏菌病诊断中的特异度 rMEP作为抗原与所选血清无交叉反应,见表2。

表2 rMEP作为抗原诊断的特异性
3 讨论
在布鲁氏菌病流行地区,建立快速准确的诊断方法是预防和控制该疾病的前提条件。血清学抗体检测常被用来诊断动物的布鲁氏菌病[12]。由于B 细胞表位是抗体识别的分子位点[13],随着生物信息学技术的发展,已经有多种细胞表位在线预测工具。本研究使用生物信息学工具对主要布鲁氏菌OMP的优势抗原表位进行了预测。然而,使用单一的生物信息学工具预测免疫原性B细胞表位的成功率很低。因此,本研究中使用了三种不同的B 细胞预测工具(ABCpred、Bepipred 和 COBEpro)和 T 细胞表位预测工具。布鲁氏菌的各种OMP 具有高度的免疫活性,可用于疾病的血清学诊断。而当前常用的LPS抗原,存在交叉反应问题[14],OMP 有作为候选诊断抗原的潜力。同时,随着原核蛋白表达技术的发展,蛋白制备对实验室安全级别要求相对较低,而LPS制备则需要培养布鲁氏菌进行提取,对实验室的要求相对较高[15]。当前,疫苗的许多研究将热点集中在了布鲁氏菌的OMP 抗原上。这些研究表明,使用布鲁氏菌的OMP 免疫动物后,可以产生较强的免疫保护反应[16-20]。我们前期的研究结果也表明,这种融合蛋白可以在小鼠体内产生较强的Th1、Th2型免疫反应[21]。
在前期研究的基础上,将rMEP 作为诊断抗原建立了牛羊布鲁氏菌病iELISA 诊断方法。利用新建的诊断方法对159 份羊血清样本进行评估,结果显示其阳性和阴性诊断符合率分别为98.92%、96.97%;对153 份牛血清样本进行评估,结果显示其阳性和阴性诊断符合率分别为98.65%、96.20%。这表明rMEP 作为一种蛋白抗原在诊断牛羊布鲁氏菌病中准确率很高。本研究结果还表明,rMEP在区分布鲁氏菌患病动物和健康动物方面与LPS几乎不相上下,rMEP与一些常见的食源性病原体如沙门氏菌及大肠杆菌O157:H7 等也不存在交叉反应,表明该诊断方法具有较高的灵敏度和特异度,即布鲁氏菌OMP 结合生物信息学技术和iELISA 技术在疾病血清学诊断中应用价值较高,具有将理论研究应用于生产实践中布鲁氏菌病血清学检测的潜力。
总之,本研究用新设计的rMEP 建立了检测牛、羊布鲁氏菌病的iELISA方法。利用大肠杆菌表达系统过量表达了由布鲁氏菌4个主要OMP优势抗原表位组成的重组蛋白,满足了在短时间内生产大量诊断性抗原的需要,不仅节省了时间,而且避免了LPS抗原的制备,使诊断过程更加安全方便,为疾病的感染提供了一种安全简便的诊断方法。此外,这种基于rMEP 的布鲁氏菌病诊断方法可以为其他传染病的诊断提供新的思路。然而,我们建立的诊断方法尚不能区分动物所感染的布鲁氏菌类型以及区分接种疫苗、未接种疫苗的动物,这些还需深入研究。
