循环肿瘤细胞检测仪的结构设计与功能分析
2022-05-31郭冰冰胡秀枋宋子玥黄馨雨沈亦纯邹任玲谷雪莲邸元帅郭宛星徐秀林
郭冰冰,胡秀枋,宋子玥,黄馨雨,沈亦纯,邹任玲,谷雪莲,邸元帅,郭宛星,徐秀林
上海理工大学健康科学与工程学院,上海 200093
前言
在我国随着生活环境和生活压力的变化,肿瘤发病率持续上升,但与国外相比,肿瘤综合治愈率差距较大,5年生存率也较低,其原因之一为国内缺乏早期的筛查手段。近几年,国内经济稳步增长,部分患者有能力也有意愿获得高质量的精准诊疗服务,因此对于肿瘤的预防和个性化治疗的需求不断提高[1]。无创早期筛查在干预肿瘤诊治方向有巨大作用,能在肿瘤发展前期进行干涉,使患者得到及早治疗和对症精准用药,有研究表明,肿瘤侵袭与微转移先于肿瘤形成[2-3]。
循环肿瘤细胞(Circulating Tumor Cells,CTCs)[4]已被证实存在于多种癌症中,包括肺癌、前列腺癌、肝癌、乳腺癌、胰腺癌[5]、结肠癌、卵巢癌等[6]。它存活于人体的外周血液中,其含量以及活性对于癌症的早期诊断和后期复发的临床诊治有重要意义,CTCs在外周血中的含量可以用来辅助判断患者的癌症病发状况[7-11],主要应用于早期癌症诊断、预后监测、耐药性分析和靶向治疗以防止肿瘤细胞转移等方面,从而实现肿瘤的个性化治疗[12]。利用CTCs 作为了解肿瘤细胞生物学的非侵入性手段的潜在价值已被全球肿瘤学研究界所认可[13]。癌症初期,由于癌细胞体积小,含量低,传统的CT 检查很难及时发现,因此需要一种可以在早期精准检测血液中CTCs含量的仪器,以便医生提前做好临床医疗决策,有效预防和控制癌细胞的转移[14]。CTCs 检测是指直接从患者血液中检测肿瘤细胞,将人体外周循环血中的肿瘤细胞捕获并进行分析的一项技术[15]。
本研究基于当前市场对CTCs 快速度分选、高精度检测的需求,研发一台自动化程度高、进样速度快、分选时间短、检测精度高的双通道CTCs 检测仪。该仪器分为CTCs 分选和CTCs 检测,利用微流控技术的低试剂样本消耗、快速、低成本、高通量、使用简便等特点[16-17],实现对人体血液样本中CTCs 的分选与检测,对癌症患者的前期诊断和预后处理以及整体治疗方案的判定都有重要作用。
1 微流控芯片设计
微流控技术是一种能够在微米(μm)尺寸的流道内操纵流体进行实验的技术[18],其具有快速、高通量、低成本的特点,且使用简单、可多部分组合[19-20]。利用微流控技术可以实现对CTCs 的高回收率、高纯度的分选富集,也可以在更大程度上实现CTCs 检测的自动化,同时可以实现CTCs 的细胞培养和分子分析[21]。微流控芯片,又称芯片实验室(lab-on-a chip)或者生物芯片[22]。本研究使用微流控分选芯片和微流控检测芯片,分别实现了CTCs 分选和CTCs 检测功能。
1.1 微流控分选芯片
目前应用在CTCs 富集分选的方法主要有物理分选方法和生化分选方法。在本设备中采用的是物理分选方法,利用细胞之间的物理特性(尺寸大小)不同,通过外部力场(流体场)的作用达到分选富集CTCs 的目的。粒子在弯曲管道内会受到惯性升力[23]和Dean 曳力的共同影响,从而使不同直径大小的粒子在管道内的不同位置达到平衡。本研究使用Ansys fluent17.0 仿真软件模拟了在弯曲管道内不同直径大小粒子的分选情况,并根据仿真结果设计一款正反共12圈的双螺旋结构微流控分选芯片,如图1所示。芯片内部流道的宽度为340 μm,拥有一个样本入口,将经过预处理的人体血液样本输送到分选芯片上,再将通过螺旋流道的样本分两路输出,称之为CTCs 收集口和废液收集口。该芯片主要分为上层的PDMS材质层和下层的玻璃层,芯片内部的流道结构通过光刻胶技术实现,再采用等离子处理将PDMS层和玻璃层进行不可逆键合,保证芯片工作过程中不会漏液。
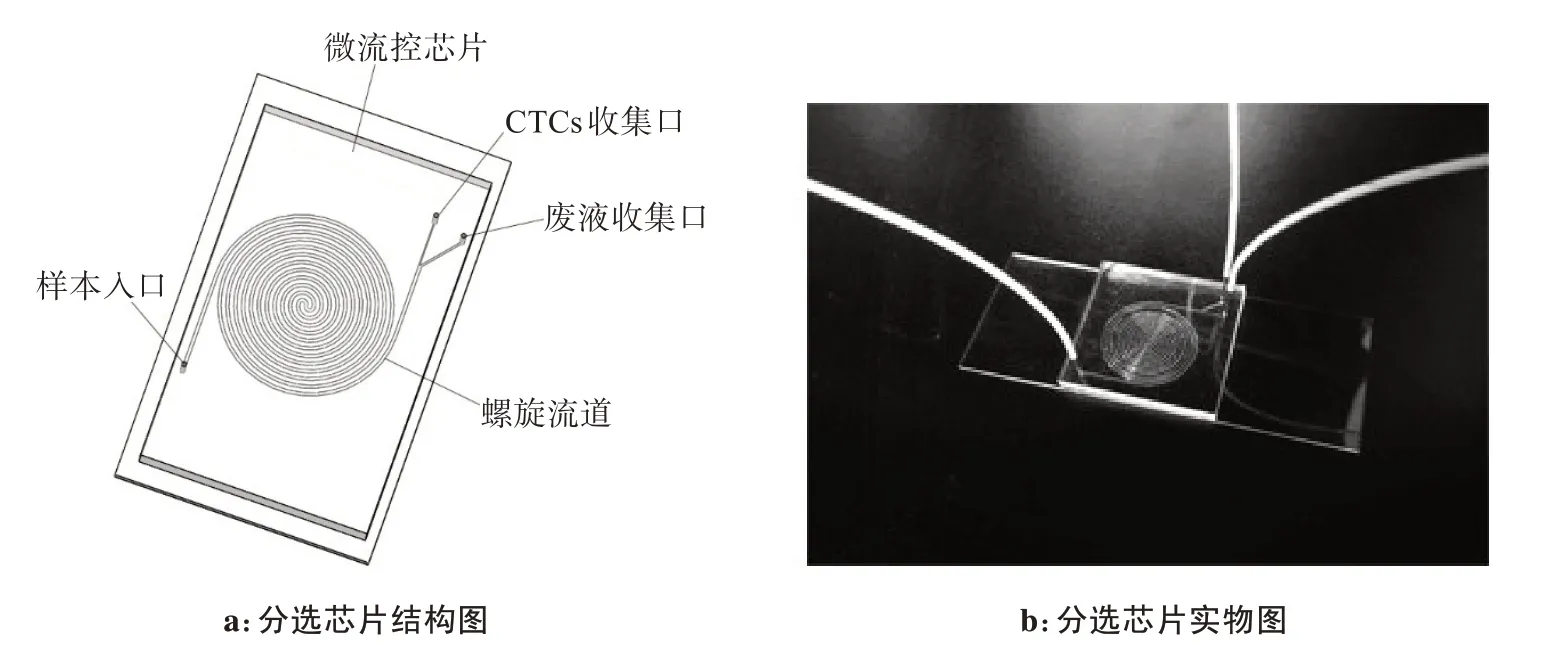
图1 微流控分选芯片Figure 1 Microfluidic sorting chip
1.2 微流控检测芯片
本研究设计一款直型微通道检测芯片,用于肿瘤细胞的计数与分析。芯片分为上层的PDMS 材质层和下层的玻璃层,拥有一个接收分选富集后的CTCs 收集液的样本入口和一个通过流道后的CTCs样本出口,如图2所示。为了减少样本通过流道时与内壁发生粘连因而产生不必要的损耗,直行流道芯片通道的宽度为500 μm,高度为35 μm,当分选富集好的CTCs在通过检测流道时,利用CCD相机拍摄并计数通过的CTCs数量。
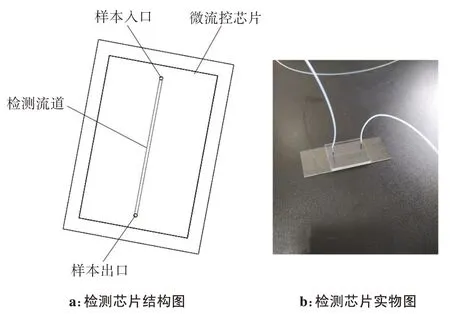
图2 微流控检测芯片Figure 2 Microfluidic detection chip
2 机械结构设计
本研究研发的基于微流控技术的CTCs 检测仪的主要结构包括外壳、控制箱、微量注射泵、芯片位置微调装置、控制面板、荧光检测装置等,其内部结构图与实物图如图3所示。①外壳:整体结构设计使用金属外壳,内部空间设计合理,实现了体积小而精度高的设计要求。②控制模块:仪器的核心控制部分,集成了包括进样驱动电路、气压源、比例电磁阀、数据采集卡等电路。③微量进样泵:仪器的进样装置,通过步进电机与滚珠丝杆之间的配合将旋转运动转化为直线运动,从而实现仪器的精密进样。④芯片位置微调装置:仪器的调焦装置,用于调整微流控检测芯片与光学检测装置之间的距离,以便CCD相机能聚焦流道并完整记录通过流道的CTCs 数量。⑤控制面板:仪器的操作面板,利用可触摸电容屏设定进样装置的流量和流速,同时设置了通道选择,可选择单通道运行模式或双通道同时运行模式。⑥荧光检测装置:由光路结构以及CCD 相机组成,经过预处理后的样本在通过该装置时,其光路结构中的LED 光源会激发带有荧光染料的CTCs 发光,使得实验过程中能区分出CTCs和其他细胞。
在设计过程中,两个微量注射泵被放置在仪器两侧,外留一根tygon 软管与芯片位置调整装置上的接口相连,实现样本进样;芯片位置微调装置包括离心管、tygon软管、微流控芯片和固定在两侧的上下微调旋钮和左右微调旋钮;旋钮的作用在于微调微流控检测芯片的位置,使得CCD 相机能聚焦流道;荧光检测装置被放置在芯片位置调整装置上方,便于拍摄CTCs 细胞通过流道的图像;直线导轨安装在芯片位置微调装置的下方,实现芯片位置微调装置的前后移动;工作时电磁铁通电将芯片位置调整装置固定,以保证工作过程中不受到人为的意外干扰,工作结束后,可通过断电按钮使电磁铁断电失去磁性;控制面板镶嵌在控制箱箱体上,可以通过设置参数控制微量进样泵的工作状态。
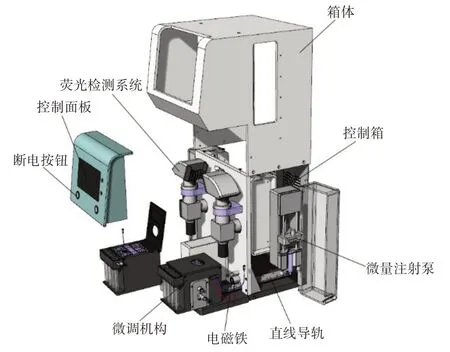
图3 双通道循环肿瘤细胞检测仪结构图Figure 3 Structural diagram of dual-channel apparatus for detection of circulating tumor cells
3 控制系统设计
本仪器的控制系统包括样品分选模块控制电路和CTCs 检测控制电路。分选控制电路的功能是把经过预处理的样本液在由上位机软件控制的压力泵的推动下以稳定的流量送入微流控分选芯片中进行CTCs 分选。检测控制电路的功能是将通过CTCs 分选芯片得到的CTCs 富集液在由上位机软件控制的微量进样泵的推动下以稳定低流量的状态送入直通道检测芯片中进行光学检测并计数。
3.1 分选控制电路设计
分选控制电路包括上位机、硬件控制模块、正压气源、气压调控装置、分选微流控芯片、流量传感器及数据传输设备等部分,分选控制电路结构框图如图4 所示。上位机通过串口通信向主控板发送通道选择及流量控制信号等控制指令到硬件控制模块,控制模块根据接收到的信号进行相应的气压调控,将离心管内的样本液以稳定的流量输送至分选芯片中,同时通过压力传感器和流量传感器检测出离心管内的气压及分选芯片中样本的进样流量,再通过数据采集模块实时地将采集到的压力和流量数据传输到上位机并进行实时动态信息显示,上位机通过PID 算法进行控制数据的反馈,实现闭环控制,提高分选控制电路的精度和稳定性,提高CTCs 的分选富集效果。
3.2 检测控制电路设计
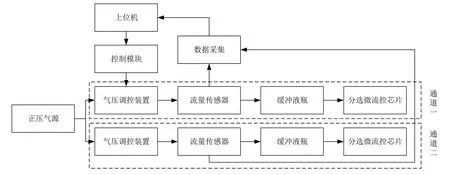
图4 分选控制电路结构框图Figure 4 Block diagram of sorting control circuit
检测控制电路采用两种控制方式,既可以通过上位机向PLC 控制模块发送指令控制微量进样泵的运行,也可以通过可触摸控制面板向控制模块发送指令进行控制,两种控制方式并行可以保证控制系统运行时的稳定性和使用时的灵活性,其中控制面板可以显示两个微量进样泵的实时状态信息,检测控制电路结构框图如图5 所示。上位机通过串口通信将来自PLC 控制模块或控制面板的控制指令发送到主控板并控制注射泵以稳定的流速输送至检测芯片进行CTCs 检测计数,控制指令包括进样速度和进样流量等,同时还可以选择单通道运行或双通道运行模式,当选择单通道运行时,可根据接收的指令运行注射泵1或注射泵2;当选择双通道运行时,注射泵1 和注射泵2 同时运行,可节省一半的检测时间。光学检测通道记录所有通过流道的CTCs 并进行图像捕捉,将其传送至上位机软件,再利用自行开发的程序完成计数并反馈于检测报告中。
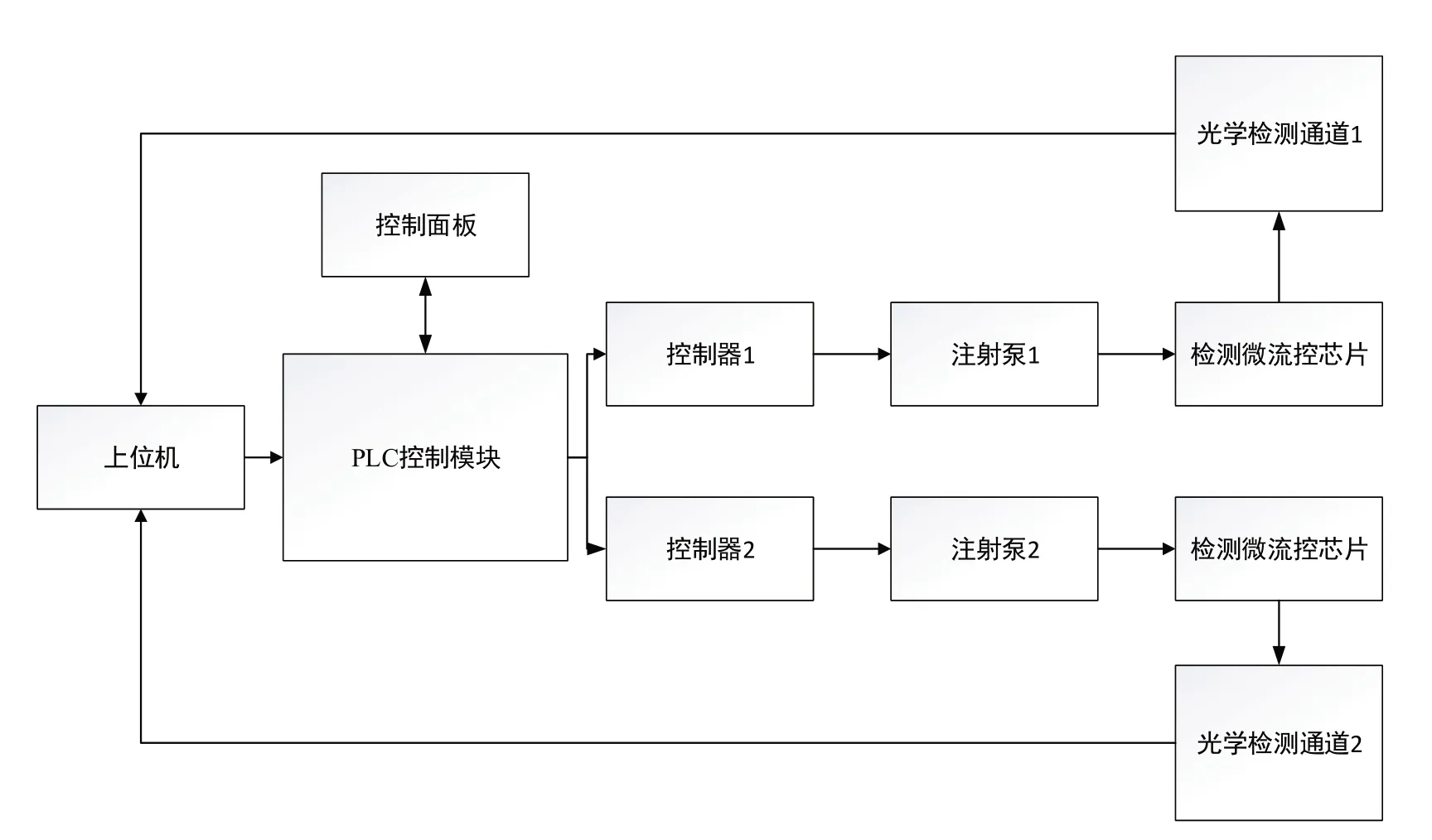
图5 检测控制电路结构框图Figure 5 Block diagram of detection control circuit
4 软件系统设计
在软件系统设计过程中,不仅需要考虑系统操作者的便利性,还需保证病人信息数据的及时更新,因此本研究与数据库进行实时连接,可随时增、删、查、补病人的各项数据,其具体设计流程如图6所示。
整个软件系统可分为病人信息管理、CTCs分选、CTCs 检测、检测报告等。界面整体设计使用Duilib库,有5 个子界面,各个界面设计如图7 所示。其中病人信息管理模块主要存储和管理病人信息;CTCs分选模块主要实时监测在CTCs 分选过程中的工作状态;CTCs 检测模块主要监测在CTCs 检测过程中的运行控制和状态,检测结果模块主要生成和打印选定病人的CTCs检测报告。
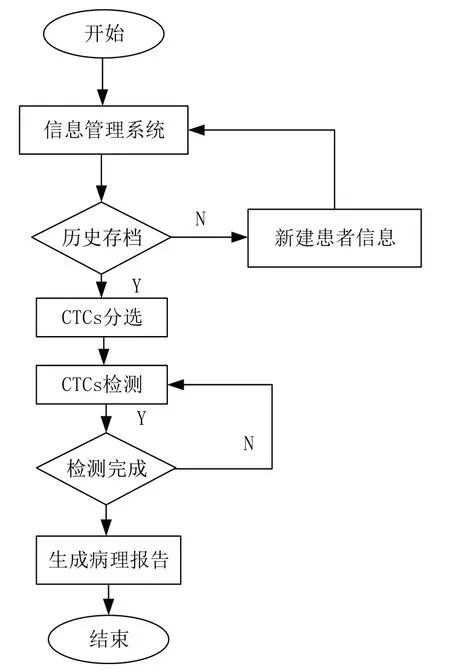
图6 软件系统设计流程图Figure 6 Software system design flowchart
5 整体功能实现
仪器的整体功能实现如图8 所示,首先将经过预处理的人体血液样本放入定制的离心管中,通过上位机发送对应指令至控制模块,从而控制压力泵以一定的流量将样本液输送至分选微流控芯片并分两路输出,后将分选得到的CTCs 富集液通过上位机发送对应指令至控制模块,从而控制注射泵以一定的流速输送至检测微流控芯片输出,便于后续对于CTCs 的分析,同时通过光学检测系统对荧光标记后的CTCs 进行图像捕捉和计数,最后将检测结果传送到上位机形成检测报告。
6 实验与分析
实验中采用的实验样本是由上海津复生物科技有限公司提供的MDA-MB-453 系细胞,由于红细胞有可能遮挡经由荧光标记的CTCs 细胞,从而造成漏检,在实验前将红细胞进行裂解,如图9 所示。为了确保实验过程中各个模块不会出现漏液的情况,在用制备好的实验样品进行实验前,先用PBS 缓冲液送入检测仪进行预检。将实验样本肿瘤细胞稀释到1 000 个/mL,每次取1 mL 进行实验,CTCs 分选进样速度设置为30 mL/h,CTCs 检测进样速度分别设置为0.1、0.2、0.3、0.4 mL/h。在不同的时间段进行两组实验,时间间隔为3 d,每组实验重复6 次。表1 显示了各组的实验结果和统计学分析,其中第1组是首次实验的结果,第2 组是3 d 后实验的结果。CCD 相机拍摄通过流道的细胞并通过上位机软件对CTCs 计数,将检测数与实际数进行比值运算得到检出率。在实验结束后,需用PBS 缓冲液再次进行冲洗,防止有细胞或者荧光染料残留。
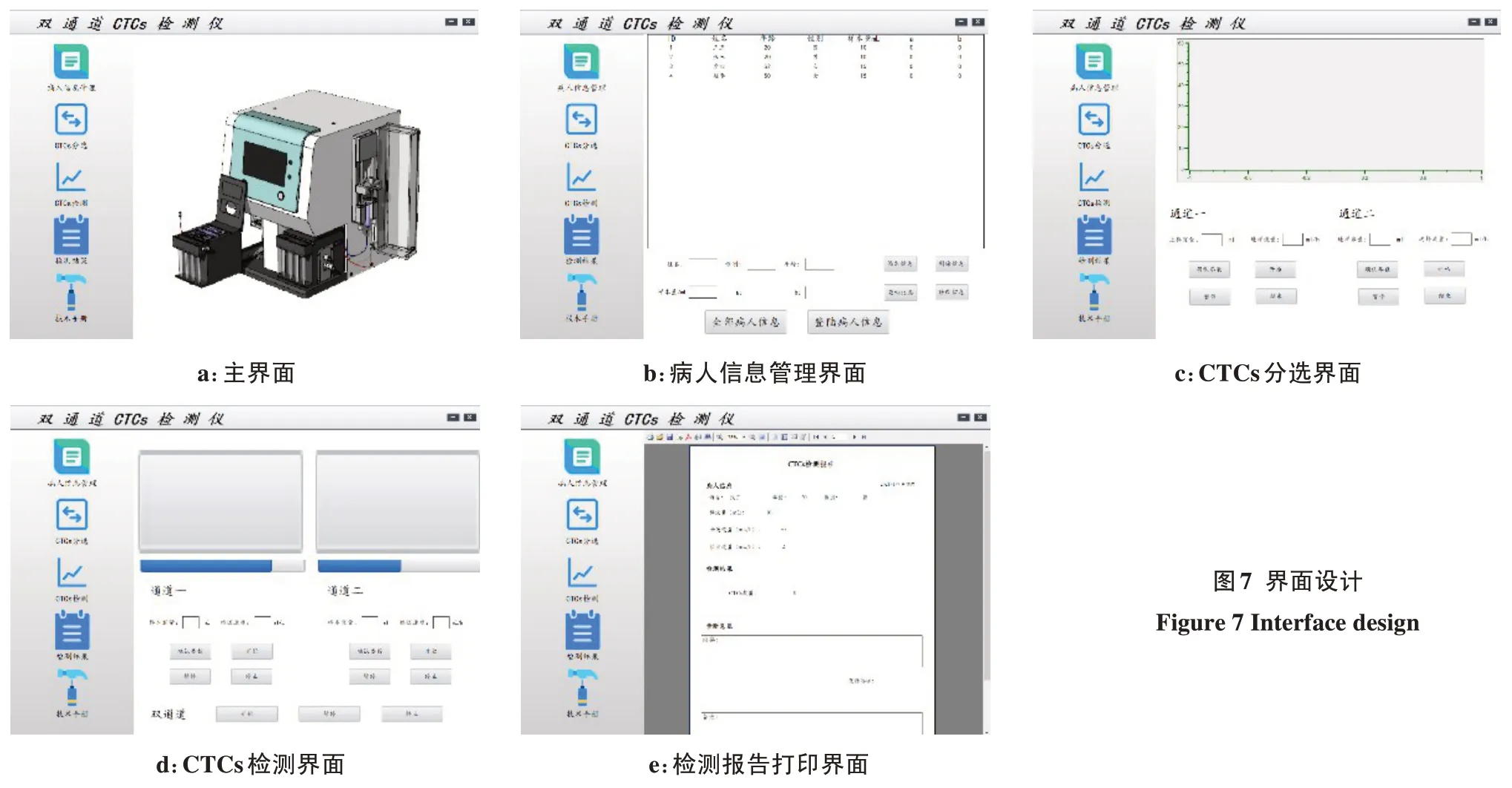
图7 界面设计Figure 7 Interface design
由表1 可知,CTCs 检测进样速度对于检出率的影响较大,当速度过高时可能会造成CTCs 的漏检,速度过低时可能会导致CTCs 的重复检测。其中检测进样速度为0.2 mL/h 时检出率最高达到77.1%。当CTCs 检测进样速度为0.2 mL/h 时,两组实验的检出率最高,平均检出率分别为76.1%和75.9%;使用SPSS 19 软件对实验数据进行可靠性分析,求出各组的组内相关系数,进样系统在4 种不同流速下的ICC值分别是0.88、0.84、0.83 和0.84,均大于0.8,说明本研究开发的CTCs检测仪具有良好的可靠性。

图8 仪器功能实现框图Figure 8 Block diagram of apparatus function realization

图9 实验样本Figure 9 Experimental samples
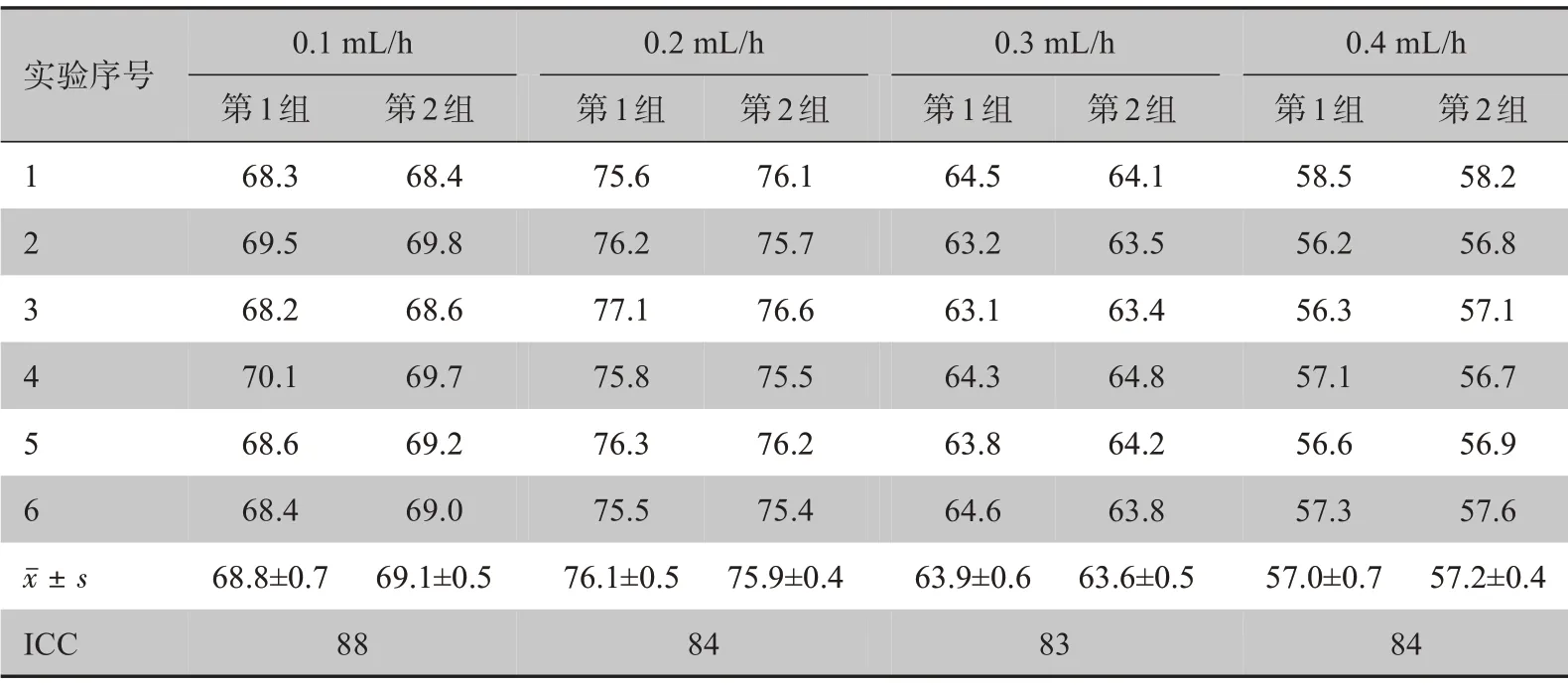
表1 循环肿瘤细胞检测仪的检出率和统计学分析(%)Table 1 Detection rate and statistical analysis of the apparatus for detection of circulating tumor cells (%)
7 讨论
本研究开发了一种基于微流控技术的双通道CTCs 检测仪,主要功能为对模拟血液样本内CTCs的分选富集与检测计数。整台仪器分为CTCs 分选与CTCs 检测两个工作模块,经过实验验证,该检测仪性能稳定、可靠,当流速为0.2 mL/h时捕获率最高,对模拟血液中的CTCs 平均检出率能够达到76%。仪器目前尚存在以下几点不足之处:(1)实验中使用的血液样本是模拟血液样本,而不是真实患者的血液样本,尚需进一步实验验证;(2)使用微量注射泵进样时,存在样品在注射器中少量残留,样液检测不完全,从而导致检测结果有误差。上述问题均有待于进一步研究。
