大果沙枣不同部位总黄酮含量比较研究
2022-05-30凯迪日耶·玉苏普美合热阿依·木台力甫周茜
凯迪日耶·玉苏普 美合热阿依·木台力甫 周茜
【摘 要】目的:研究比较大果沙枣枝叶、种子、果肉和果皮不同部位总黄酮含量之间的差异。方法:采集新疆大果沙枣树叶和果实,采取超声波辅助乙醇提取法提取总黄酮,以NaNO2- Al(NO3)3-NaOH作为显色体系,紫外-可见分光光度法测定枝叶、种子、果肉和果皮不同部位总黄酮含量。结果:大果沙枣树叶、种子、果肉、果皮总黄酮含量分别为(8.27±0.04),(20.56±0.17),(5.91±0.05)和(2.52±0.07)mg/g(n=3)。沙枣种子中黄酮含量最高,果皮中总黄酮含量最低,大果沙枣不同部位总黄酮含量从高到底依次为种子,沙枣叶,果肉,果皮。结论:沙枣的种子、枣叶和果肉中总黄酮含量丰富,为沙枣黄酮类物质的进一步开发提供了一定的参考依据。
【关键词】 大果沙枣;种子;超声波;总黄酮含量
【中图分类号】R284.1 【文献标志码】 A 【文章编号】1007-8517(2022)01-0031-05
Comparative Study on Total Flavonoids Content in Different Parts of Elaeagnus Angustifolia L.
KAIDIRIYE Yusupu MEIHEREAYI Mutailifu ZHOU Qian
1. College of Life and Geographic Sciences,Kashi University,Kashi 844006,China;
2. Key Laboratory of Biological Resources and Ecology of Pamirs Plateau in Xinjiang Uygur
Autonomous Region,Kashi 844006,China
Abstract:Objective The study compares the total flavonoids content in different parts of the leaves, seeds, pulp and peel of Elaeagnus angustifolia L. Methods The leaves and fruits of the Xinjiang Elaeagnus angustifolia L. were collected, and the total flavonoids were extracted by ultrasonic ethanol extraction,and the content was determined by the ultraviolet-visible spectrophotometry with NaNO2-Al(NO3)3-NaOH as the color system.Results The content of total flavonoids in leaves, seeds, pulp, and peel of Elaeagnus angustifolia L. are (8.27±0.04), (20.56±0.17), (5.91±0.05) and (2.52±0.07) mg/g(n=3)respectively.The content of flavonoids in the seeds of Elaeagnus angustifolia is the highest, and the content of total flavonoids in the peel is the lowest. The order of total flavonoids content in different parts of Elaeagnus angustifolia L. is seeds> leaves> pulp> peel.Conclusion The seeds, leaves and pulp of Elaeagnus angustifolia L. ware rich in total flavonoids,it provides a reference for the further development of the flavonoids.
Key words:
Elaeagnus Angustifolia L.;Seeds;Ultrasound;Total Flavonoid Content
黃酮类化合物(flavonoids) 是一植物次生代谢产物之一,其具有多种结构类型和广泛的生物活性,由于毒副作用比较小、具有广谱的药理活性,近几年广泛引起科学家和研究者的关注。黄酮类化合物主要由在不同位置带有酚或多酚基团的苯并吡喃酮环组成,具有螯合金属、减少脂质过氧化、清除自由基和抗氧化等作用。黄酮类化合物在自然界中存在非常广泛,药用植物、蔬菜、水果、坚果、草本植物、谷物、种子中均可发现黄酮类化合物,到目前为止,已分离鉴定出黄酮类化合物早已超过10000多种。作为天然化合物,黄酮类化合物已用于染料、化妆品和护肤品等领域中。黄酮类化合物具有光谱的药理活性,已经广泛用于抗肿瘤、抗菌、抗病毒、神经保护、抗氧化、防止恶性细胞扩散等,因此对黄酮类化合物的研究已成为国内外医药界研究的热点话题,是一类天然药物。
沙枣(Elaeagnus angustifolia L.)是胡颓子科胡颓子属植物,适应性强,在半干旱、干旱、半荒漠、荒漠等多种环境中够成长生存,被称为沙漠里的“宝树”。沙枣在我国新疆、青海、甘肃、内蒙古西部和宁夏等西北省份生长面积较大,产量高,河北、河南和东北的部分省份也有分布。
沙枣新鲜或者干燥的果实富含多种维生素和矿物质,比如生育酚、维生素E、C、B1和α-胡萝卜素等,矿物质包括钾,钠,和磷等,沙枣果实中钾,钠和磷含量依次为8504 mg/kg, 1731 mg/kg 和635 mg/kg。沙枣在传统民间医学上具有止痛、解热和利尿等功效,传统民间医学上沙枣的果实和花用于治疗恶心、咳嗽、哮喘、发热、黄疸、腹泻等多种常见病,而沙枣种子则用于提取多酚以及其他抗氧化分子。以往研究发现,沙枣果实提取物可有效减轻类风湿关节炎患者的疼痛症状,同时能够降低受伤人员的伤口愈合时间。沙枣花期在五至六月,芳香,呈黄白色,沙枣花可以作为蜜蜂的花蜜来源。沙枣的水或者有机溶剂提取物中可以检测到黄酮、维生素、矿物质、糖类、固醇和生物碱等化合物,这可以证明它们可作为食品或药物制剂中的成分使用。
沙枣提取物含有黄酮、多糖、生物碱、不飽和脂肪酸、甾醇、萜类、皂苷类、胡萝卜素、单宁类等活性物质,具有抗菌、抗炎、心脏保护、降血脂、抗肿瘤、抗氧化等作用,因此在食品、药品、化妆品等方面有较大应用价值。在国外也有研究阐述沙枣作为药物材料的作用和成分。
目前,国内外学者对沙枣黄酮类研究大多集中在果实部分,沙枣叶黄酮研究较少,沙枣种子黄酮研究至今未见报道。鉴于此,本研究采用超声波法提取沙枣叶、种子、果肉、果皮不同部位总黄酮,紫外可见分光光度法测定其含量,对比分析了沙枣不同部位总黄酮含量以及之间的差异,为进一步开发沙枣黄酮类物质提供了一定的实验参考依据。
1 材料与仪器
1.1 材料 选取大果沙枣不同部位作为供试材料,大果沙枣及叶片采集与新疆维吾尔自治区喀什市。分别取沙枣干燥的全果,果皮,果实,种子以及叶片,自然风干,用粉碎机研碎,过0.45 mm筛,于室温下保存备用。
1.2 仪器与试剂 LE403E电子天平(瑞士,梅特勒);T6新世纪紫外-可见分光光度计(北京普析通风仪器有限责任公司);DGG-9146A电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);SCIENTZ-ⅡD超声波细胞破碎机(宁波新芝生物科技股份有限公司);TDZ4K离心机(湖南湘仪实验仪器开发有限公司)。
芸香苷(芦丁)标准品、无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠均购自绿叶生物科技有限公司,以上试剂均分析纯(AR)。
2 方法
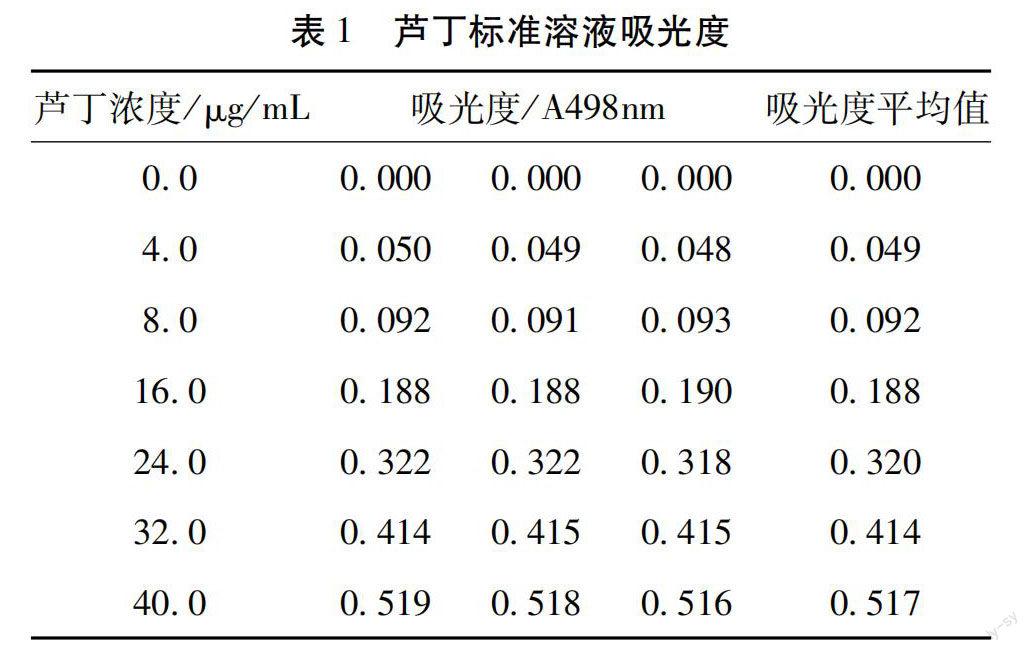
2.1 标准曲线的制作 105 ℃烘干恒重的芸香甙标准品适量,取一支干净的250 mL棕色容量瓶,准确称量50.00 mg芸香甙,加入适量的无水乙醇搅拌至完全溶解后,定容至2 mL,配制成浓度为 0.20 mg/mL的芸香甙标准溶液。取10 mL干净的棕色容量瓶,精确吸取 0.20 mg/mL芸香甙对照品溶液 4.00 mL,分别加入5 mg/mL亚硝酸钠溶液0.30 mL,充分摇匀,放置 6 min 加入 10 mg/mL硝酸铝溶液0.30 mL,充分摇匀,放置6 min ,加入4 mg/mL氢氧化钠溶液 4.00 mL,用蒸馏水定容至相应的刻度,充分摇匀,室温放置15 min,于400~600 nm波长处扫描,结果在498 nm处有最大吸收。
准确称取50.00 mg芸香甙,用无水乙醇溶解后,定容至100 mL棕色容量瓶中,配制成浓度为 0.20 mg/mL的标准溶液。取7个25 mL棕色容量瓶中分别加入标准溶液 0.0 mL,0.5 mL,1.0 mL,2.0 mL,3.0 mL,4.0 mL,5.0 mL,之后在每个容量瓶中按顺序加入5 mg/mL的 NaNO2 溶液 300 μL,摇匀,静止6 min后加入 10 mg/mL的 Al- (NO3)3溶液300 μL,充分摇匀,静止6 min,再加入4 mg/mL的 NaOH 溶液 4.0 mL摇匀,最后用60%的乙醇定容摇匀,静止15 min后,设0号管为空白对照组,于498 nm波长处测定吸光度。3次测吸光度取平均值。用紫外可见分光光度计测定芸香甙标准溶液吸光度值。结果见表1。
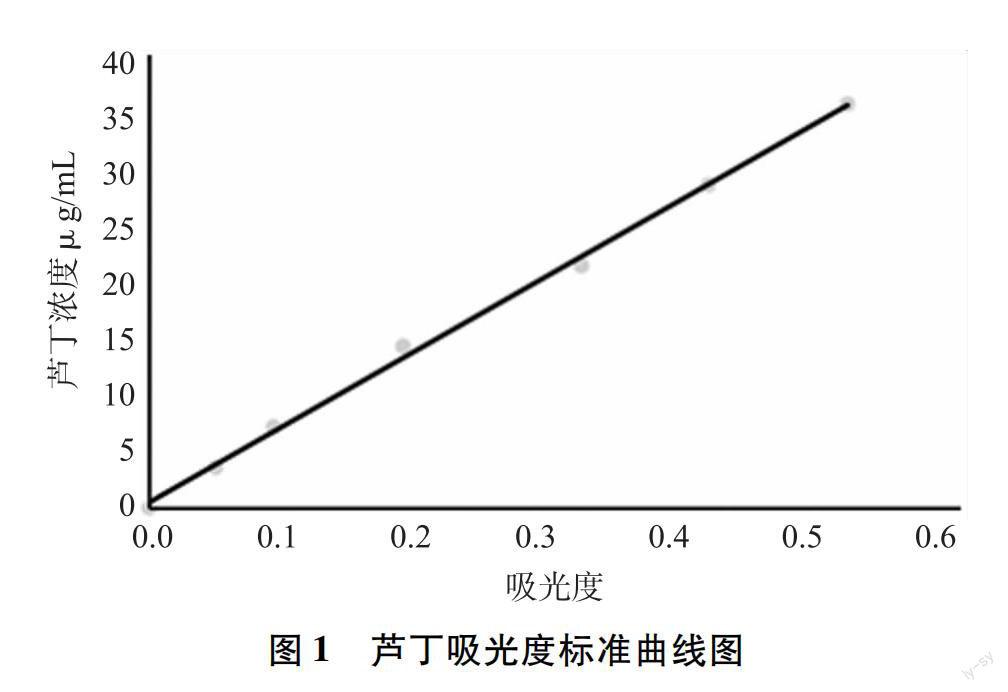
以498 nm吸光值为X轴,对应的芸香甙浓度值为Y轴制作芸香苷标准曲线,如图1所示。 对芦丁浓度和吸光度值数据进行回归分析后,获得的线性方程式为Y=76.125X+0.5318,R2=0.9980,在浓度为4.0~40.0 μg/mL范围内具有良好的线性关系,此方法可以作为沙枣总黄酮含量的测定方法。
2.2 供试品的准备 分别称取适量沙枣树叶、果肉、果皮和种子,按照料液比 1∶22 加入60%的乙醇溶液,在320 W功率下超声处理15 min,之后在4000 r/min离心10 min,将上清液收集在容量瓶中,用蒸馏水定容至25 mL,以备用。
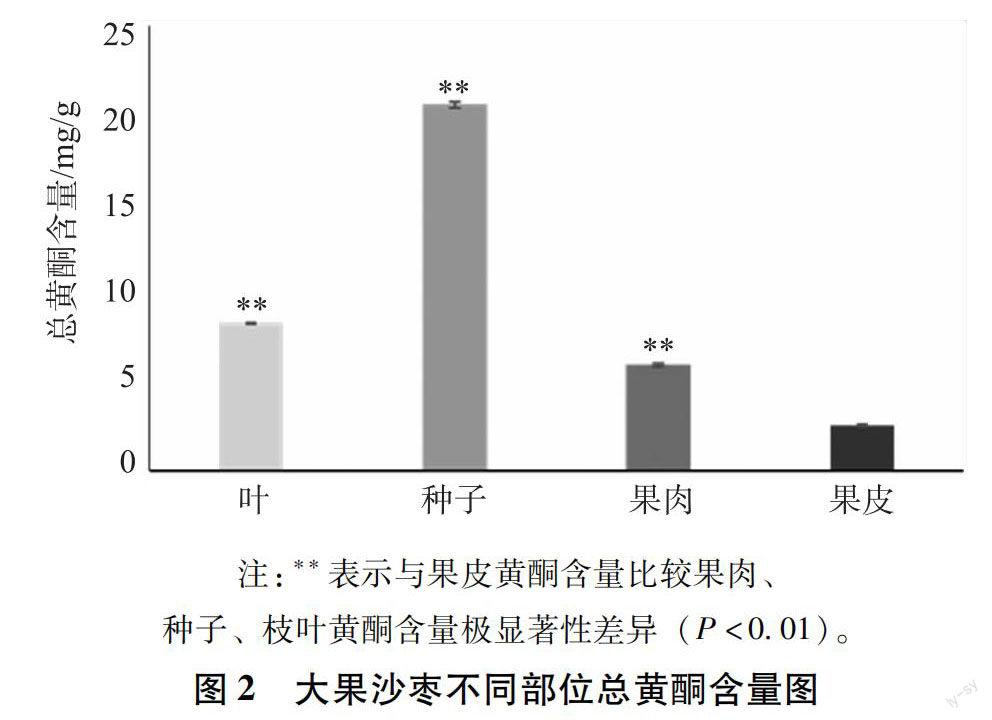
2.3 沙枣不同部位总黄酮含量 取2 mL样液至50 mL棕色容量瓶中,重复3次,按照2.1的方法在498 nm波长处测定吸光度,计算沙枣枝叶、种子、果肉和果皮不同部位总黄酮含量。以测定样品的吸光度值为基础,根据标准曲线的线性方程计算大果沙枣不同部位总黄酮含量,如图2所示。实验结果表明沙枣叶、种子、果肉、果皮中总黄酮含量分别为(8.27±0.04)、(20.56±0.17)、(5.91±0.05)和(2.52±0.07)mg/g(n=3)。试验结果表明,沙枣种子中黄酮含量最高,果皮中总黄酮含量最低,大果沙枣不同部位总黄酮含量次序为种子>叶>果肉>果皮。图2中可以得出,与果皮相比,枣叶、种子、果肉总黄酮含量有极显著差异(P<0.01)。
黄酮含量(mg/g)=(黄酮浓度×稀释倍数×提取液体积) /样品重量
2.4 精密度实验 精密吸取对照品溶液和供试品溶液各3份,2 mL置50 mL容量瓶中,按照2.1的方法在498 nm波长处测定吸光度。结果表明枝叶、种子、果肉和果皮样品吸收度RSD分别为0.45%,0.75%,1.19%,2.22%(n=3) 对照品吸收度RSD=2.23%(n=3),说明精密度较好。结果见表2。
2. 5 重复性实验 精密称定同一批沙枣叶、果肉、果皮和种子5份,按照2.2方法制得供试品溶液,按照2.1的方法在498 nm波长处测定吸光度。在498 nm波长处测定吸光度。结果表明枝叶、种子、果肉和果皮样品吸收度RSD分别为0.45%,0.396%,1.19%,1.33% (n=3),说明重复性较好。结果见表3。
2. 6 稳定性实验 精密吸取对照品溶液和供试品溶液各2 mL置50 mL容量瓶中容量瓶,按照2.1的方法分别在 5,10,20,30,40,60 min 测定498 nm波长处测定吸光度。结果表明,结果表明枝叶、种子、果肉和果皮样品吸收度RSD分别为0.46%,0.28%,0.865%,1.13%(n=3),样品吸收度 RSD=0.46%(n=3),说明稳定性较好。结果见表4。
2.7 加样回收實验 取已知总黄酮含量沙枣种子粉末1 g,按照2.2方法制备供试品,同时分别加入已知浓度的芦丁标准液1 mL,2 mL,3 mL依照上述样品测定的方法测定,求出回收率结果。结果表明,3次测定的平均回收率为 100.19 % ,(RSD=0.314%, n=3)。说明该测定方法测得的结果准确。结果见表 5。
3 结论
总黄酮是植物生长过程中产生的次生代谢产物,植物体内次生代谢产物的产生和积累与植物的生长发育程度及外界环境因素密切相关。从实验结果可知,大果沙枣种子总黄酮含量最高,其次为沙枣枝叶和果肉,沙枣果皮中最低。本研究采用超声波提取法提取大果沙枣不同部位总黄酮以及比较所含总黄酮含量差异。由于超声波能够导致植物细胞壁的破坏,从而溶剂渗透细胞的速度进一步加快,有效成分迅速溶解到有机溶剂里,从而提高了有效成分的提取效果,减少提取时间,降低了高温对提取成分的影响。超声波提取不仅提取时间相对短,节约所用的有机溶剂,同时能提高提取速率,提取工艺相对不复杂,可以作为提取黄酮、多糖等活性物的首选的提取方法。实验结果表明,在乙醇体积分数为 60%,320W功率下超声提取15 min,料液比为 1∶22提取工艺条件下,大果沙枣种子的总黄酮含量可达(20.56±0.17)mg/g(n=3)。沙枣目前作为中药的常用材料,其活性成分的提取,研究抗氧化、抗菌活性等是非常有必要的。综上,沙枣的种子、枝叶和果肉中总黄酮含量丰富,可为今后大果沙枣资源的开发,医药成分的研究等提供了一定的实验参考依据。
参考文献
[1]ULLAH A,MUNIR S,BADSHAH S L, et al.Important Flavonoids and Their Role as a Therapeutic Agent[J]. Molecules(Basel, Switzerland),2020,25(22):5243.
[2]MALIK N,DHIMAN P,SOBARZO-SANCHEZ E,et al. Flavanoids and Anthranquinones as Xanthine oxidase and Monoamine oxidase inhibitors: A new approach towards Inflammation and oxidative stress[J]. Current topics in medicinal chemistry,2018,18(25):2154-2164.
[3]OKMEN G,TURKCAN O. A study on antimicrobial, antioxidant and antimutagenic activities of Elaeagnus angustifolia L. leaves[J].African journal of traditional, complementary, and alternative medicines : AJTCAM,2014,11(1):116-120.
[4]KOZOWSKA A,SZOSTAK-WEGIEREK D. Flavonoids--food sources and health benefits[J]. Roczniki Panstwowego Zakladu Higieny,2014,65(2):79-85.
[5]ALEXANDRE V,MONIQUE S.A. V,HENDRA M. et al. Photo-stability of a flavonoid dye in presence of aluminium ions[J]. Dyes and Pigments,2018(162):222-231.
[6]P. CHUARIENTHONG,N. LOURITH,P. Leelapornpisid. Clinical efficacy comparison of anti-wrinkle cosmetics containing herbal flavonoids[J]. International Journal of Cosmetic Science,2010,32(2):99-106.
[7]ZHAO L L, YUAN X Y, WANG J B, et al. A review on flavones targeting serine/threonine protein kinases for potential anticancer drugs[J]. Bioorganic & Medicinal Chemistry,2019,27(5):677-685.
[8]ZHAO K, YUAN Y, LIN B Y,et al. LW-215, a newly synthesized flavonoid, exhibits potent anti-angiogenic activity in vitro and in vivo[J]. Gene,2018(642):533-541.
[9]黄浩,赵鑫,姜标.胡颓子科植物化学成分研究概况[J].中草药,2006(2):307-309.
[10]章衡,池建伟,王文生.沙枣果实开发利用的研究[J].山西农业大学学报,1991,11(4):304-30.
[11]张娜,艾明艳,刘丽,等.沙枣种子油的理化性质及其清除自由基能力研究[J].中国油脂,2013,38(2):88-91.
[12]ZAHRA H,HAMID H. Evaluation of physicochemical characteristics and antioxidant properties of Elaeagnus angustifolia L[J]. Scientia Horticulturae,2018(238):83-90.
[13]BOUDRAA S, HAMBABA L, ZIDANI S, et al. Mineral and vitamin composition of fruits of fifive underexploited species in Algeria: Celtis australis L., Crataegus azarolus L., Crataegus monogyna Jacq., Elaeagnus angustifolia L. and Zizyphus lotus L[J]. Fruits,2010(65):75-84.
[14]RAFIE H,SOHEILA H,MOHSEN H,et al. Russian olive (Elaeagnus angustifolia L.): From a variety of traditional medicinal applications to its novel roles as active antioxidant, anti-inflammatory, anti-mutagenic and analgesic agent[J]. Journal of Traditional and Complementary Medicine,2017,7(1):24-29.
[15]FONIA A,WHITE I R,WHITE J M L. Allergic contact dermatitis to Elaeagnus plant (Oleaster)[J]. Contact dermatitis,2009,60(3):178-179.
[16]TEHRANIZHDEH A,BARATIAN A, HOSSEINZADEH H Russian olive (Elaeagnus angustifolia) as a herbal healer[J]. BioImpacts : BI,2016,6(3):156-157.
[17]FAIK A A,ERIC B. Sugar and Phenolic Acid Composition of Stored Commercial Oleaster Fruits[J]. Journal of Food Composition and Analysis,2001,14(5):505-511.
[18]MOHADDESE M. Elaeagnus angustifolia and its therapeutic applications in osteoarthritis[J]. Industrial Crops & Products,2018(121):36-45.
[19]权洪峰,杨婷,彭晓东.翅果油树种子CO2超临界萃取物抗炎及神经保护活性初步研究[J].宁夏医学杂志,2017,39(11):980-982,960.
[20]冯涛,阎婷婷,阎国荣,等.沙枣提取物清除自由基能力的研究(英文)[J].Medicinal Plant,2010,1(2):24-26.
[21]WEI Q ,WEI Y ,WU H W ,et al. Chemical Composition, Anti-oxidant, and Antimicrobial Activities of Four Salinea Tolerant Plant Seed Oils Extracted by SFC[J]. Journal of the American Oil Chemists' Society,2016,93(9):1173-1182.
[22]冯海燕,刘闪,张云霄,等.三白草总黄酮的超声波提取工艺研究[J].安徽农业科学,2010,38(15):7863-7865.
[23]韩伟,叶亚婧,雷祖海,等.超聲波在活性成分提取中的应用进展[J].机电信息,2011(20):33-38.
[24]廉宜君,李炳奇,刘红,等.复合酶辅助超声波提取沙枣多糖的工艺研究[J].中国中医药信息杂志,2009,16(6):47-48,59.
[25]SABOONCHIAN F,JAMEI R,HOSSEINI S S. Phenolic and flavonoid content of Elaeagnus angustifolia L. (leaf and flower)[J]. Avicenna journal of phytomedicine,2014,4(4):231-238.
[26]CARRADORI S,CAIRONE F,GARZOLI S,et al. Phytocomplex Characterization and Biological Evaluation of Powdered Fruits and Leaves from Elaeagnus angustifolia[J]. Molecules (Basel, Switzerland),2020,25(9):2021.
(收稿日期:2021-05-06 编辑:陶希睿)
