设计小专题 突破重难点
2022-05-30洪涛
洪涛


如何上好复习课?有些教师可能会存在困惑,要么上成知识的回顾课,要么上成试题的练习课。由于难以实施分层教学,学优生可能会觉得简单乏味,学困生可能会觉得难懂无趣,学生学习积极性不高,课堂氛围沉闷。其实我们能在一节课内给学生讲透、弄懂、教会一两个知识点,就已经很不容易了,不能一味贪多,追求面面俱到。为此,笔者以“质量守恒定律的应用”小专题复习课设计为例,通过典例分析-方法引导-变式迁移的复习模式,来与同行分享复习课如何高效教学。
一、典例分析
在典型例题分析环节,笔者首先会呈现试题,然后设计问题串让学生先独立思考再进行小组讨论,达到回顾知识的目的,最后明确例题涉及的知识点。
(一)例题呈现
例题:把M、N、P、Q四种物质投入一密闭容器中,测得各物质的质量如表1。
下列说法不正确的是( )
A.x等于45 B.P一定是催化剂
C.N可能是单质
D.参加反应的M与Q的质量比为7∶8
(二)围绕问题串,回顾知识点
1.化学反应前后,物质的总质量关系如何?
2.密闭容器内各物质在反应中充当的“角色”是什么?是反应物?是生成物?还是反应条件(催化剂)?或是与反应无关的物质?你判断的依据是什么?
3.能否写出反应的表达式?
4.能否确定反应物、生成物中各物质的质量关系?
(三)明确题目涉及的知识点
1.化学反应前后物质的总质量不变。
2.化学反应生成其他物质的同时,反应物被消耗,所以质量减少的是反應物,减少的质量就是参加反应的物质质量;质量增加的是生成物,增加的质量就是反应生成的物质质量;质量不变的物质可能是反应的催化剂,也可能是与反应无关的物质。据此就可以写出反应的表达式。
3.反应中,各物质的质量比是固定的,质量比=化学计量数与相对分子质量的乘积之比。
经过对知识的回顾,我们不难发现,在例题给出的反应中物质的总质量=20 g+20 g+5 g+16 g=61 g,x=61 g-6 g-5 g=50 g,反应表达式为M+Q→N(注意:没有化学计量数,不是化学方程式,中间只能写“→”,不能写“=”),属于化合反应。化合反应的生成物一定属于化合物,所以N是化合物;P的质量不变,可能是反应的催化剂;反应中M、Q、N的质量比=14 g∶16 g∶30 g=7∶8∶15。符合题意的选项为D。
二、方法引导
通过对例题的分析,教师可以引导学生总结并提炼思路和方法。教师可以设置问题:解决在密闭容器内反应前后质量关系类问题的基本思路是什么?经过讨论,学生可以得出:根据质量变化关系→确定反应物和生成物→写出反应的表达式→判断反应的基本类型→求出各物质之间的质量关系(等量关系或比例关系)。其中,解题的关键是找到反应前后物质的质量变化关系,试题常以多种形式呈现,如表格、柱状图、饼图、坐标图、刻度图等。我们可以把其他形式的信息转化为表格信息,如将上述例题表格信息完善如表2所示。
当获取以上表格信息后,我们便可以引导学生利用质量守恒定律轻松地解决相关问题。
三、变式迁移
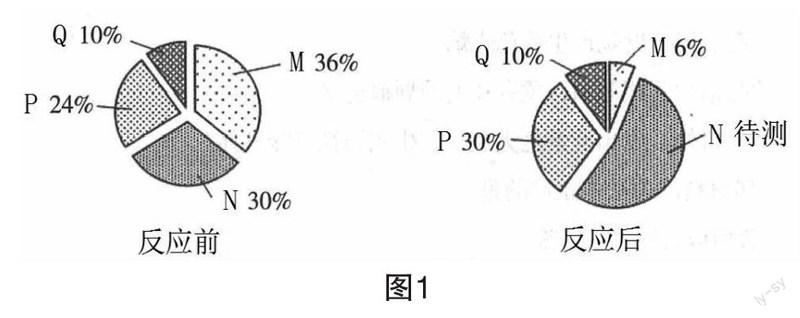
【迁移1】把M、N、P、Q四种物质投入一密闭容器中,在一定的条件下反应。各物质的质量分数如图1,有关说法中不正确的是( )
A.N待测=54%
B.参加反应的M的质量一定等于反应生成的N和P的质量总和
C.该反应为分解反应
D.生成的N和P的质量之比是9∶5
【解析】将题目信息以表格的形式呈现,如表3。
反应的表达式为M→N+P,属于分解反应,根据质量守恒定律,参加反应的M的质量一定等于反应生成的N和P的质量总和;反应生成的N和P的质量比为24%∶6%=4∶1。
【答案】D
【迁移2】把M、N、P、Q四种物质投入一密闭容器中,反应前各物质的质量关系如图2刻度纸所示(例如:Q的质量为2 g)。在一定条件下发生反应,反应结束后,再次测得各物质的质量变化,并通过刻度的移动来表示,且记录在同一张刻度纸上:刻度线Ⅰ向右移动9格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。下列说法正确的是( )
A.M、Q的相对分子质量之比一定为9∶8
B.M、N变化的质量比一定为9∶17
C.该反应可能为置换反应
D.反应结束后P的质量为14 g
【解析】本题反应前后物质质量变化关系的呈现方式比较新颖,学生会感觉比较陌生,可能导致读不懂题,无从下手。我们可以结合题目信息让学生在刻度纸上画出反应结束后的情况,如图3所示。
接着,我们再把反应前后物质的质量关系以表格的形式呈现出来,如表4。
由此得到反应的表达式为N→M+Q,属于分解反应,反应中N、M、Q的质量比=17 g∶9 g∶8 g=17∶9∶8。因为反应中M和Q的化学计量数之比未知,M和Q的化学式也未知,所以无法求出M和Q的相对分子质量之比。
【答案】B
【迁移3】把N、P、Q三种物质投入一密闭容器内,一定条件下发生反应,图4为容器中N、P、Q的质量随M的质量变化情况。回答下列问题:
图4
(1)a的值为_________________;
(2)该反应属于___________________(填基本类型);
(3)当Q为5 g时,容器中N的质量为______________________;
(4)当M为2 g时,容器中P与Q的质量之比为____________________。
【解析】将题目信息以表格的形式呈现出来,如表5。
由此得到反应的表达式为Q→M+N,属于分解反应;反应中,Q、M、N的质量比为10∶8∶2。当Q为5 g时,参加反应的Q的质量为5 g,根据质量比可知生成的N的质量为1 g,所以容器内N的质量为10 g+1 g=11 g;当M为2 g时,生成的M的质量为2 g,根据质量比可知参加反应的Q的质量为2.5 g,容器内剩余的Q的质量为10 g-2.5 g=7.5 g,所以,此时容器中,P、Q的质量之比为6 g∶7.5 g=4∶5。
【答案】(1)12 (2)分解反应 (3)11 g (4)4∶5
当然,以上的迁移应用不胜枚举,要想让学生跳出题海,背后就一定需要教师跳入题海,分类研究、去粗存精。
一般情况下,初中化学在九年级开课,不到一年的时间既要完成1-12单元的新课教学,又要进行复习备考,时间紧、任务重、压力大,而且初中学业水平考试化学学科内容涉及五大专题共116个考点,点多面广。在复习备考阶段,我们可以根据考点内容精心设计小专题,如化学用语、物质的分类、化学基本反应类型、气体制备、物质推断、物质鉴别、除杂质、溶解度曲线、金属活动性顺序的应用、水的相关知识、化学计算等;也可以根据试题类型设计小专题,如实验探究题、坐标图像题、工业流程题等。总之,我们通过小专题复习,夯实基础知识和基本技能,引导学生发展思维,掌握方法,提高能力,让不同层次的学生都能在原有基础上得到发展。
责任编辑 邱 艳
