中华乌塘鳢(Bostrychus sinensis)GPx7 和GPx8基因的克隆、表达与酶活性分析*
2022-05-30夏立萍张建设
丁 浪 夏立萍 沈 斌 张建设
(浙江海洋大学 国家海洋设施养殖工程技术研究中心 浙江舟山 316022)
重金属污染是指通过各种途径进入到环境中的镉(Cd)、铅(pb)、铬(Cr)、砷(As)等重金属或其化合物对环境造成的污染。进入水环境中的重金属被鱼体吸收、富集或者生物放大(刘长发等, 1999), 再通过食物链传递, 危害人体健康。镉(Cd)是一种毒性极大的重金属, 在水环境中主要以离子形式(Cd2+)存在, 具有高毒性、易蓄积性、强组织亲和性等特点(Silvestreet al, 2006), 在生物体内积累后会对中枢神经系统、肝脏、肾脏等产生毒害作用(Stohset al, 1995)。Cd2+的生物毒性主要表现为与金属硫蛋白(metallothionein,MT)结合成有机络合物, 或通过离子键与生物体内的核苷酸、蛋白质等形成配位化合物(Hyllandet al,1994), 导致蛋白质构象发生改变, 酶活性丧失, 从而干扰细胞的正常生理代谢。此外, Cd2+还在生物体内发生氧化还原反应, 产生自由基导致细胞氧化受损(李海蓉等, 2003)。
关于重金属污染物对鱼类抗氧化系统影响的研究发现, 抗氧化防御系统最重要的一项特征就是其活性成分或含量可因污染胁迫而发生改变, 可间接反映污染物对水生生物的影响(鲁双庆等, 2002;Monteiroet al, 2010; 赵汉取等, 2014)。谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)家族作为抗氧化防御系统的重要成员(Aktaret al, 2019; Chenet al,2019; Wuet al, 2019), 因其在抗氧化方面的重要作用,已有研究将其作为环境监控生物标志物(Cunhaet al,2007)。GPx 不仅可以调节细胞内的信号转导, 还可以保护机体生物膜免受氧化损伤(Wuet al, 2010)。GPx7为近年来新发现的GPx 家族非含硒成员, 其活性中心Sec 被Cys 代替, 具有缓解多不饱和脂肪酸介导细胞凋亡的功能(Utomoet al, 2004), 也能缓解si RNA靶向干扰目标 mRNA 脱靶产生的应激(Weiet al,2012)。GPx8 是GPx 家族最后被确认的成员, 作为活性氧自由基清除剂, 能够有效阻止内质网氧化物蛋白Ero1 产生的过氧化氢外溢(Ramminget al, 2014),还通过调节内质网Ca2+浓度和通量参与调控细胞信号转导(Yoboueet al, 2017)。
中华乌塘鳢是一种广盐广温、低氧耐受性很强的鱼类, 通常栖息于温水性浅海咸淡水区域, 因其具有加速伤口愈合的功效, 被认为是药用价值非常高的食用鱼之一, 成为东南沿海重要养殖对象。目前已有研究应用鱼类、贝类和藻类的特定基因作为生物标志物进行环境污染物监测(蔡中华等, 2012), 因此研究中华乌塘鳢谷胱甘肽过氧化物酶基因对于养殖业发展和海洋生态研究都具有重要意义。
1 材料与方法
1.1 组织样品获取
本研究所用中华乌塘鳢[体重为(50.48±0.37) g,体长为(14.08±0.22) cm], 购自浙江台州某养殖场, 暂养于长60 cm×宽40 cm×60 cm的充气玻璃缸中, 盐度15, 水温25 °C, 每天换水1 次, 投喂新鲜虾仁沫1 次,暂养适应7 d。取暂养适应后的健康中华乌塘鳢3 尾,快速解剖采集血液、脑、心脏、头肾、鳃、肝脏、脾脏、皮肤、肌肉和肠组织, 迅速投入液氮中保存, 用于研究BsGPx7 和BsGPx8 基因在组织中的表达分布。
将暂养适应后的中华乌塘鳢随机分为四组, 即对照组和实验组1、2 和3, 每组35 尾鱼。根据实验室前期研究所得中华乌塘鳢在Cd2+胁迫下96 h 半致死浓度(LC50)为61.44 mg/L (取LC50为60 mg/L), 配制Cd2+浓度为50 mg/L 的母液, 将实验组Cd2+浓度梯度设置为1/8 LC50(7.5 mg/L, 实验组1)、1/4 LC50(15 mg/L, 实验组2)和1/2 LC50(30 mg/L, 实验组3),试验期间不换水。对照组视为0 h, 至少取3 尾鱼, 实验组分别在处理后的3、6、12、24、48、72、96 h取样, 每组每个时间点至少取3 尾鱼, 快速解剖采集肝脏、鳃、头肾、脾脏和皮肤组织, 迅速投入液氮中保存。
1.2 总RNA 提取和cDNA 合成
参考魏可(2020)的方法, 用 Trizol Reagent(Invitrogen, USA)提取上述组织的总 RNA, 使用SuperScriptTMIII Reverse Transcriptase kit 逆转录试剂盒(Invitrogen, USA), 根据说明书的方法步骤将总RNA 逆转录成cDNA。
1.3 BsGPx7 和BsGPx8 序列扩增及测序
利用Primer 5.0 设计引物, 对BsGPx7 和BsGPx8基因的CDS 序列进行PCR 扩增, 引物序列见表1。使用TaKaRa TaqTMHS Perfect Mix 试剂(TaKaRa, 中国), 以中华乌塘鳢肝脏cDNA 为模板, 按照说明书进行常规PCR 扩增, 扩增条件为: 94 °C 变性30 s,62 °C 复性30 s, 72 °C 延伸16 s, 34 个循环, 最后72 °C延伸10 min。PCR 产物使用1.5%琼脂糖进行凝胶电泳, 在紫外灯下切割预期条带, 使用琼脂糖凝胶回收试剂盒(北京全式金生物公司)进行PCR 产物回收。将上述回收产物连接到 pGEM-T easy Vector 载体(Promega, USA), 转化到DH5α 感受态细胞(TaKaRa,中国), 经蓝白斑实验筛选出阳性克隆, 通过测序获得BsGPx7 和BsGPx8 的CDS 序列。
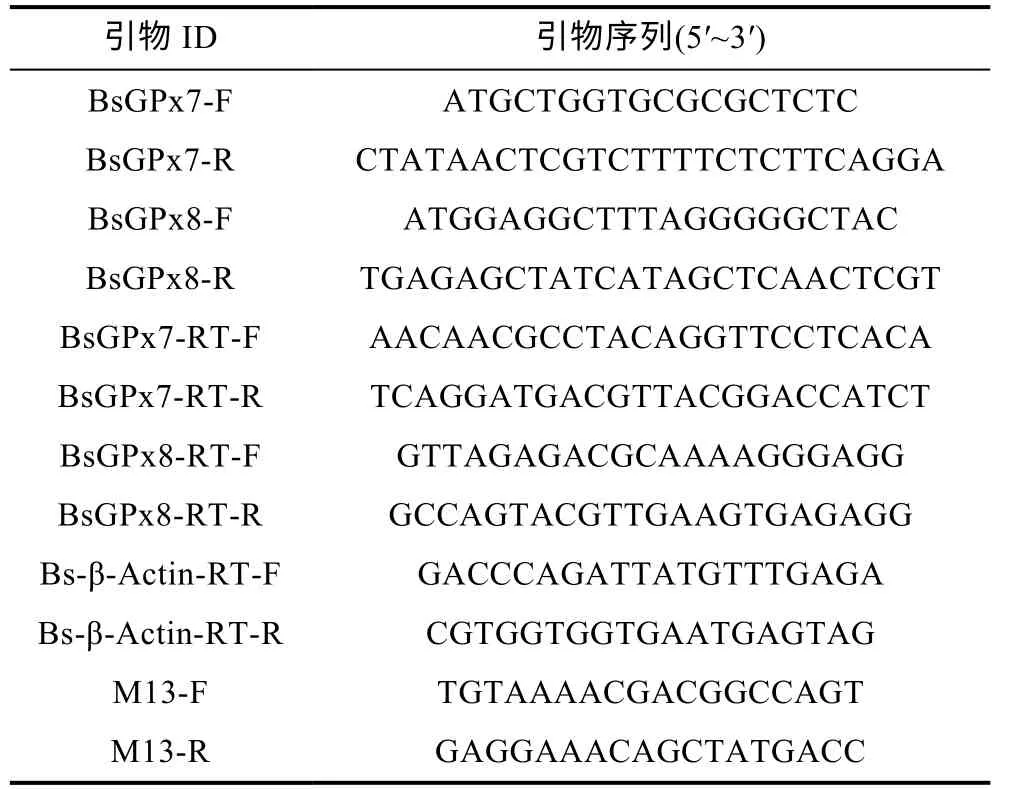
表1 引物序列Tab.1 The primer sequences
1.4 BsGPx7 和BsGPx8 基因序列的生物信息学分析
利用在线工具Color Align Properties (Color Align Properties (bioinformatics.org) 和 EMBOSS Needle(EMBOSS Needle<Pairwise Sequence Alignment<EMBL-EBI)对测序所得的CDS 序列进行多序列比对和同源性分析。利用ExPASY (https://www.expasy.org/)网站预测分子量和理论等电点; 利用SignalP-5.0 Serve (http://www.cBs.dtu.dk/services/SignalP/)预测蛋白质信号肽。利用在线网络工具SMART (http://smart.embl-heidelberg.de/)对蛋白质的结构域进行预测; 利用 SWISS-MODEL (https://swissmodel.expasy.org/interactive)对蛋白质的3D 结构进行预测并用PyMol 2.7 软件查看展示结果。基于物种的氨基酸序列进行Cluster x 多重序列比对, 并利用 MEGA X 中的Neighbor-Joining 方法构建序列系统发育进化树。
1.5 BsGPx7 和BsGPx8 的组织分布及Cd2+胁迫后的表达变化
以测序所得BsGPx7 和BsGPx8 的CDS 序列设计Real-time PCR 引物, 选取中华乌塘鳢 β-肌动蛋白(Bs-β-actin)为内参基因, 引物序列见表 1。使用TaKaRa TB Green®Premix Ex TaqTMII (Tli RNaseH Plus)试剂(TaKaRa, 中国), 在ABI7500 Fast Real-time PCR 系统检测不同组织(脑、心脏、头肾、鳃、肝脏、脾脏、皮肤、肌肉、肠、血液)中BsGPx7 和BsGPx8基因的分布表达以及不同浓度Cd2+胁迫下, 主要免疫器官(肝脏、头肾、脾脏)和直接暴露器官(鳃、皮肤)中BsGPx7 和BsGPx8 基因的表达变化。
BsGPx7 和BsGPx8 基因相对表达量使用 2-ΔΔCt法(Weiet al, 2020)进行计算, 数据用平均值±标准差表示。利用SPSS 22.0 进行单因素方差分析和独立样本T检验,P<0.05 为差异显著,P<0.01 为差异极显著。
1.6 BsGPx7 蛋白表达载体的构建和表达纯化
序列经大肠杆菌常用密码子优化后, 人工合成一条长度为 567 bp 的 BsGPx7 DNA 片段, 包含BsGPx7 开放阅读框序列、NdeI/EcoRI 限制性内切酶位点、6×His tag 序列和凝血酶切割位点序列。参照Wei 等(2020)的方法进行 pET-28b(+)表达载体(Novangen, 中国)的连接转化以及BsGPx7 重组蛋白的表达纯化。诱导条件为终浓度1 mmol/L 的IPTG,37 °C 诱导4 h, 所得菌液在离心后用PBS 洗涤, 10%Glycerol 裂解液重悬, 在冰上进行超声波破碎。用考马斯亮蓝R-250 染色的SDS-PAGE 检测上清液和裂解液碎片中重组蛋白的表达水平。选择上清液, 用Ni-NTA His·Bind®Resins (Novangen, 中 国) 进 行rBsGPx7 蛋白纯化。
1.7 温度和pH 对rBsGPx7 蛋白酶活性的影响
参照张秋霞(2013)的实验方法, 测定温度和pH对rBsGPx7 蛋白酶活性的影响。将rBsGPx7 蛋白样品(pH 7.5)在25~65 °C (间隔为10 °C)的水浴中孵育10 min。测定最适pH 时, rBsGPx7 蛋白样品在pH 范围5.0~9.0 (间隔1.0)的0.2 mol/L 缓冲液中处理5 min,然后立即转移至冰上终止反应。使用谷胱甘肽过氧化物酶检测试剂盒(南京建成)开展酶活性测定。
2 结果与分析
2.1 BsGPx7 和BsGPx8 序列分析
通过分子克隆得到中华乌塘鳢GPx 基因两个亚型GPx7 和GPx8 的CDS 序列, GenBank 注册号分别为: OK754601 和OK754602。BsGPx7 基因的开放阅读框包含561 bp 核苷酸共编码186 个氨基酸(图1a),预测蛋白理论分子量为21.05 kDa, 等电点为9.44。经预测, 第 1~19 位氨基酸为信号肽序列, 表明BsGPx7 为分泌蛋白。第24~132 位残基为GPx 家族蛋白结构域, 包含2 个保守的半胱氨酸残基(Cys56和Cys85)催化位点。三维结构预测结果显示GPx7 包含6个α-螺旋和6 个β-折叠(图1b)。BsGPx8 基因的开放阅读框包含633 bp 核苷酸, 编码210 个氨基酸(图1c),蛋白理论分子量为23.88 kDa, 等电点为9.52。经预测, BsGPx8 蛋白不存在信号肽序列, 说明其可能不是分泌蛋白。第 21~40 位残基为跨膜螺旋区, 第48~156 位残基为GPx 家族蛋白结构域, 包含 1 个半胱氨酸残基(Cys109)催化位点, 三级结构包括6 个α-螺旋和6 个β-折叠(图1d)。

图1 BsGPx7、BsGPx8 核苷酸序列和预测氨基酸序列Fig.1 The nucleotide and deduced amino acid sequences of BsGPx7/BsGPx8
2.2 BsGPx7 和BsGPx8 基因氨基酸多序列比对和同源性分析
多序列比对和同源性分析发现, BsGPx7 和BsGPx8与其他物种的GPx7 和GPx8 均具有较高同源性, GPx家族蛋白结构域高度保守, 并且具有保守的半胱氨酸催化位点(图2, 图3)。BsGPx7 与鲈形目鱼类同源性最高, 其中与虾虎鱼科的大鳍弹涂鱼(Periophthalmus magnuspinnatus)的同源性高达92.0% (表2)。BsGPx8同样与鲈形目鱼类的GPx8 同源性最高, 与大鳍弹涂鱼同源性高达95.7% (表3)。

图2 BsGPx7 氨基酸序列与其他同源物种的比对Fig.2 Alignment of amino acid sequence of BsGPx7 with other homologues

图3 BsGPx8 氨基酸序列与其他同源物种的比对Fig.3 Alignment of amino acid sequence of BsGPx8 with other homologues
2.3 系统进化分析
采用Neighbor-joining 方法进行系统进化树构建,分别对已知的11 个物种的GPx7 和GPx8 基因序列进行比对建树(物种登录号见表2, 表3), 研究中华乌塘鳢GPx7、GPx8 基因与其他物种间的进化关系。结果表明GPx7 与GPx8 分别与其他物种的该基因聚为一支, 在硬骨鱼类、鸟类、哺乳动物中明显分支。在鱼类进化分支中, 中华乌塘鳢GPx7 和GPx8 均先与鲈形目虾虎鱼科的鱼类聚在一起(图4)。

图4 基于BsGPx7 和BsGPx8 的编码区氨基酸序列建立的NJ 进化树Fig.4 Neighbor-joining tree based on amino acid sequences of BsGPx7 and BsGPx8 coding region

表2 BsGPx7 多序列比对和构建系统进化树的物种登录号Tab.2 The sequences GenBank accession number of BsGPx7 for pairwise alignment and neighbor-joining tree
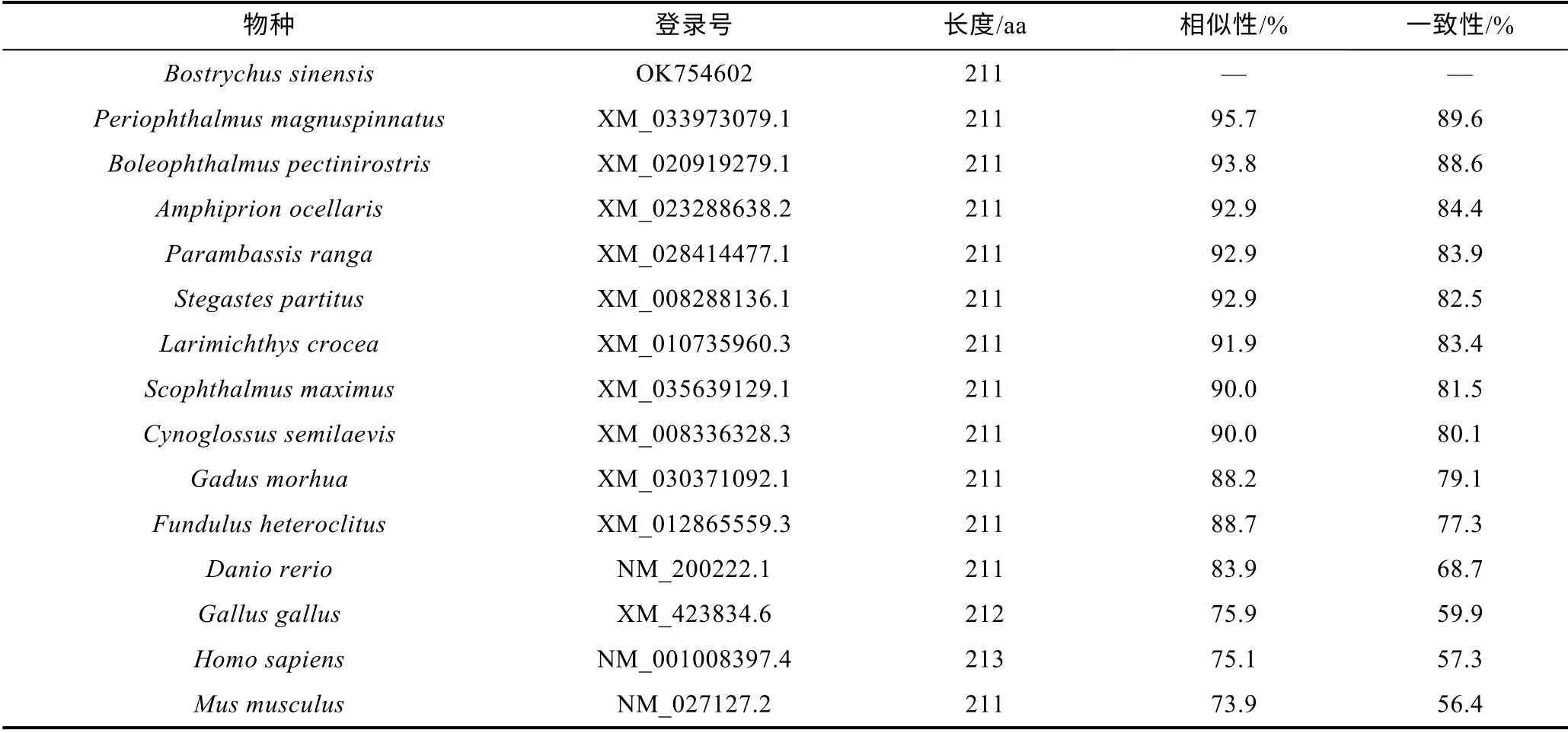
表3 BsGPx8 多序列比对和构建系统进化树的物种登录号Tab.3 The sequences GenBank accession number of BsGPx8 for pairwise alignment and neighbor-joining tree
2.4 BsGPx7 和BsGPx8 在组织中的分布表达
对健康中华乌塘鳢的组织(肝脏、脾脏、头肾、脑、心脏、鳃、皮肤、肌肉、肠、血液) 进行RT-PCR检测, 相对表达量以目的基因在肠中的表达量进行归一校准。结果显示BsGPx7 在组织中呈泛在性表达(图5a), 在肝脏中表达量最高(9 倍), 其次在鳃(7 倍)和皮肤(5 倍)表达丰富。BsGPx8 在组织中同样呈泛在性表达(图6a), 在肝脏中的表达量(7 倍)显著高于其他组织。
2.5 BsGPx7 和BsGPx8 在Cd2+刺激后的基因表达分析
研究结果表明, 不同浓度的Cd2+胁迫后, BsGPx7基因表达量发生了不同程度的变化(图 5)。肝脏中BsGPx7 基因的表达量在1/8 LC50Cd2+胁迫3 h 后显著下调, 6 h 恢复至初始水平后再次下调, 直至96 h 恢复初始水平; 1/4 LC50组在24 h 出现下调, 48 h 上调至峰值后再次下调; 1/2 LC50组在3 h 后显著下调并一直维持在初始水平以下(图5b)。鳃中BsGPx7 基因表达量在1/8 LC50、1/4 LC50的Cd2+胁迫3 h 后显著下调, 均在96 h 快速上调至峰值; 1/2 LC50组在6 h 发生快速上调, 12 h 达到峰值, 24 h 后恢复至初始水平(图5c)。头肾中BsGPx7 基因表达量在1/8 LC50的Cd2+胁迫3 h后显著下调后逐渐回调但始终低于初始水平; 1/4 LC50组在3 h 显著下调, 24 h 快速上调并达到峰值,96 h 恢复至初始水平; 1/2 LC50组在6 h 显著下调后逐渐并回调, 并在48 h 上调至峰值(图5d)。脾脏中BsGPx7 基因表达量在1/8 LC50的Cd2+胁迫3 h 后显著下调, 12 h 快速上调后再下调, 72 h 再次快速上调至峰值; 1/4 LC50组在6 h 出现显著下调后逐渐恢复至初始水平; 1/2 LC50组在3 h 后显著下调, 24 h 恢复至初始水平后下调并趋于稳定水平(图 5e)。皮肤中BsGPx7 的表达量在1/8 LC50的Cd2+胁迫24 h 后出现上调, 之后逐渐恢复至初始水平; 1/4 LC50组在96 h后快速上调至峰值; 1/2 LC50组在6 h 快速上调至峰值,24 h 后逐渐趋于稳定水平(图5f)。

图5 BsGPx7 基因的表达分析Fig.5 The expression analyses of BsGPx7
不同浓度的Cd2+胁迫后, BsGPx8 基因表达水平都发生了显著变化(图6)。肝脏BsGPx8 基因表达量在1/8 LC50的Cd2+胁迫6 h 后快速上调, 96 h 达到峰值; 1/4 LC50、1/2 LC50组均在3 h 快速上调, 分别在12 h 和48 h 达到峰值(图6b)。鳃中BsGPx8 基因表达量在1/8 LC50的Cd2+胁迫96 h 后快速上调至峰值; 1/4 LC50组在72 h 快速上调, 96 h 达到峰值; 1/2 LC50组则在3 h 后快速上调, 6 h 达到表达量峰值(图6c)。头肾BsGPx8 基因表达量在1/8 LC50的Cd2+胁迫12 h 后显著下调, 72 h 快速上调至峰值; 而1/4 LC50、1/2 LC50组在3 h 后显著下调并一直处于初始水平以下(图6d)。脾脏BsGPx8 基因表达量在1/8 LC50的Cd2+胁迫12 h 后快速上调并达到峰值, 之后逐渐下调至初始水平以下; 1/4 LC50组在3 h 上调至峰值, 12 h 后恢复初始水平至96 h 后再次上调; 1/2 LC50组在12 h 出现快速上调, 48 h 后稳定在高表达水平(图6e)。皮肤中BsGPx8 基因表达量在1/8 LC50的Cd2+胁迫3 h 后快速上调, 之后逐渐恢复并稳定在初始水平; 1/4 LC50、1/2 LC50组均在96 h 快速上调并达到峰值(图6f)。
2.6 rBsGPx7 蛋白表达纯化
经1 mmol/L 的IPTG 诱导后, rBsGPx 在E. coliBL21 细胞中大量表达。用SDS-PAGE 和考马斯亮蓝R-250 染色对细胞裂解产物的可溶性部分进行检测,检测到融合BsGPx7 的预期条带(图7a)。用Ni-NTA柱纯化裂解液上清液中的可溶性蛋白并进行 SDSPAGE 分析, 观察到纯化后BsGPx7 的单个条带(图7b), 符合预期大小(21.33 kDa)。共获得蛋白2.88 mg(0.32 mg/mL)。
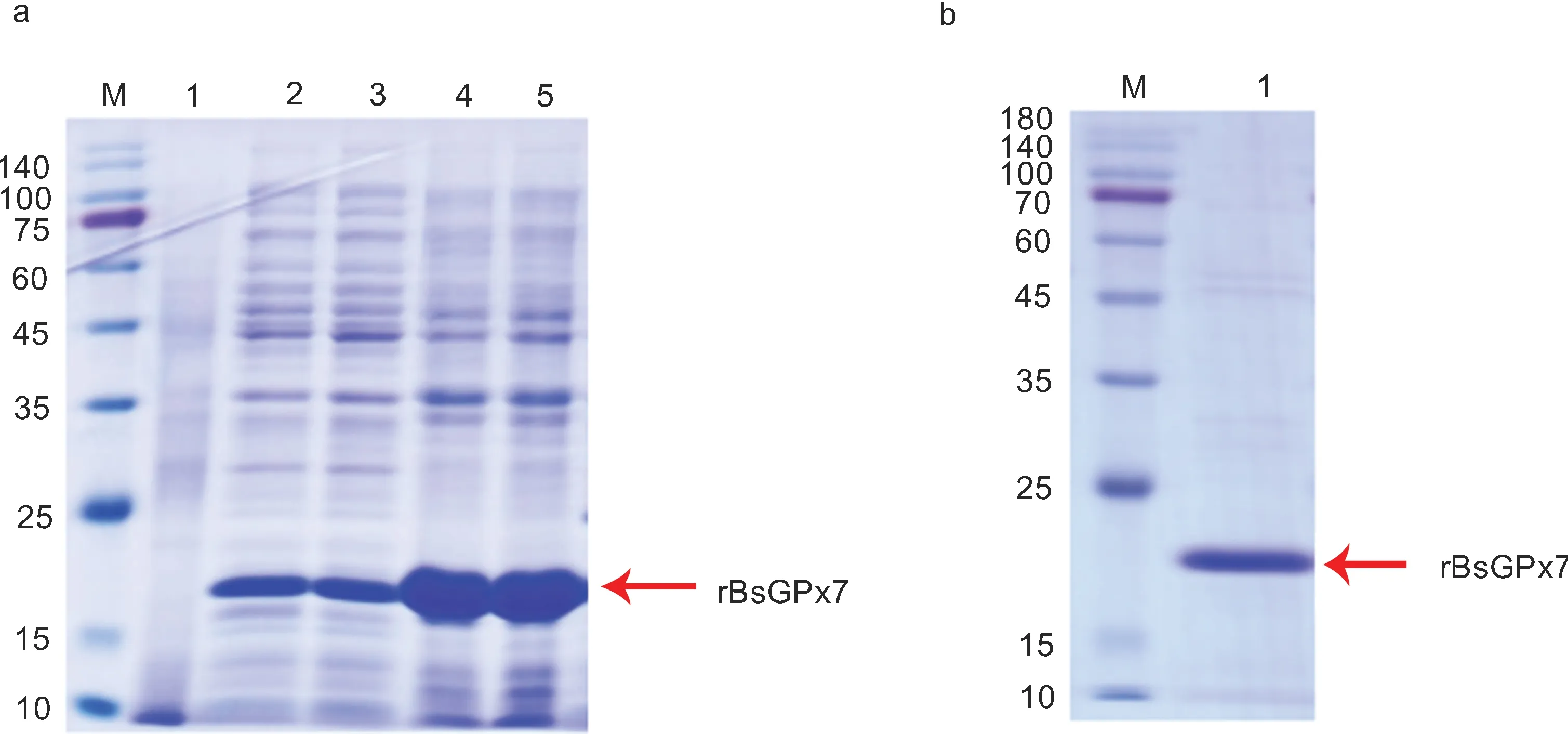
图7 rBsGPx7 蛋白的表达和纯化Fig.7 Expression and purification of recombinant BsGPx7 protein
2.7 温度和pH 对rBsGPx7 酶活性的影响
以还原型谷胱甘肽(GSH)和过氧化氢为反应底物,分别在25~65 °C, pH 5.0~9.0 范围内反应后测定GSH剩余量, 用酶促反应的速度来表示谷胱甘肽过氧化物酶活性, 结果见图8。由图8 可知, 在25~65 °C 范围内, rBsGPx7 酶活性先随温度升高而升高, 35 °C 时达到最大值, 之后随温度升高而降低; 在pH 5.0~9.0范围内, 随着pH 升高, rBsGPx7 的酶活性先逐渐升高,在pH 为8.0 时达到最大值, 之后pH 升高至9.0, 酶活性骤降。
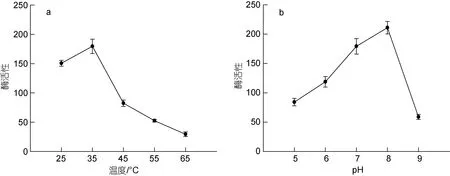
图8 rBsGPx7 酶活性测定Fig.8 Assays of rBsGPx7 enzymatic activity
3 讨论
GPx 抗氧化的作用机理是催化谷胱甘肽(GSH)为氧化型谷胱甘肽(GSSG), 使有毒的过氧化氢及脂质过氧化物转变为无毒的羟基化合物, 从而保护细胞膜结构及功能不受过氧化物的损伤(Huanget al,2019)。本研究成功克隆了中华乌塘鳢GPx7 和GPx8基因的CDS 序列, 通过序列分析证实了中华乌塘鳢GPx7 和GPx8 隶属于GPx 家族, 都编码一个典型的GPx 家族结构域, 可以催化过氧化物转化为水从而保护机体不被过度氧化损伤。多序列比对发现BsGPx7、BsGPx8 与鲈形目的大鳍弹涂鱼一致性高达90%以上,不同物种GPx 序列在进化上高度保守, 说明其在生物体内起重要作用。
目前研究已证明重金属会诱导氧化胁迫(Ercalet al, 2001), 当活性氧平衡被破坏, 鱼体需要经过一定的氧化胁迫时间才能逐渐恢复平衡, 有些个体不能回到最初平衡点, 可经过调节产生新平衡点(Lushchak,2011)。本研究发现不同浓度Cd2+刺激下, BsGPx7 基因在鳃和皮肤中均出现高表达, BsGPx8 在肝脏、鳃和皮肤中同样高表达, 说明肝脏、鳃、皮肤在防御Cd2+诱导的氧化应激中起一定作用。1/2 LC50组的鳃BsGPx7 基因表达量在24 h 恢复至初始水平后趋于稳定, 1/8 LC50组皮肤BsGPx7 和BsGPx8 基因表达量也均在48 h 恢复初始水平并逐渐趋于稳定。这可能是因为Cd2+诱导的氧化胁迫激活了机体的抗氧化途径,活性氧自由基被清除后, 机体再次回到了最初的活性氧平衡点。本研究发现BsGPx8 基因在鳃中的表达量峰值随Cd2+浓度的升高而减小, 与刘伟等(2018)对斑节对虾GPx3a 基因的研究结果一致, 原因可能是直接暴露在高浓度的Cd2+环境中, 鳃细胞受到一定程度的破坏, 致使表达量有所下降。孟晓林等(2012)研究已证实水中Cd2+浓度越高, 鳃中Cd2+生物沉积浓度也越高, 本研究中BsGPx7 和BsGPx8 基因在鳃中的表达量变化趋势为Cd2+浓度越高, 出现快速上调和达到峰值的时间越短, 原因可能是镉离子浓度升高, 鳃中Cd2+生物沉积浓度也随之升高, 所以激活抗氧化防御途径所需的时间也越短。
BsGPx8 的21~40 位氨基酸与人类GPx8 中编码跨膜区的序列高度相似(Mihaliket al, 2020), 存在跨膜螺旋区, 原核表达纯化难度较大, 因此本研究仅选取BsGPx7 开展原核表达及蛋白纯化。本研究成功构建了BsGPx7 基因的原核表达载体PET28b-BsGPx7,并通过原核表达和蛋白纯化获得了高纯度的rBsGPx7 蛋白, 为制备BsGPx7 单克隆抗体奠定了基础。通过热和酸碱刺激发现rBsGPx7 蛋白热稳定差,耐酸碱范围较窄, 在35 °C, pH 值为8 的条件下保持较高活性, 为中华乌塘鳢GPx7 的使用和保存条件提供了一定依据。
4 结论
本研究成功克隆了中华乌塘鳢GPx7 与GPx8 基因的 CDS 序列, 通过序列分析证明了两者隶属于GPx 家族, 均为不含硒的谷胱甘肽过氧化物酶基因。在不同浓度Cd2+胁迫下, BsGPx7 在鳃和皮肤中的表达量均发生显著变化, BsGPx8 在肝脏、鳃和皮肤中的表达量同样发生显著变化, 表明BsGPx7 与BsGPx8参与了机体对抗镉离子诱导的氧化应激的过程, 可能在抗氧化防御中起一定作用。成功构建BsGPx7 基因的原核表达载体PET28b-BsGPx7, 通过原核表达和蛋白纯化获得了高纯度的BsGPx7 重组蛋白, 通过酶活测定得到BsGPx7 重组蛋白的最适温度为35 °C,最适pH 为8。
