超声造影肝脏影像报告与数据系统指导低年资医师诊断肝细胞癌的应用价值
2022-05-30郑丽丽詹维伟夏蜀珺任新平
郑丽丽 詹维伟 夏蜀珺 任新平
原发性肝癌是我国目前第4大常见恶性肿瘤和第2 位肿瘤致死病因,主要包括肝细胞癌(HCC)、肝内胆管细胞癌(ICC)和肝细胞-胆管细胞混合型肝癌(CHC)等病理学类型,其中85%~90%为HCC[1]。HCC高危患者可根据无创性影像学检查确诊,但目前各地区肝癌指南的增强CT/MRI 诊断标准并未统一,《美国肝病研究协会指南》提出若肝局灶性结节(FLL)≥1 cm且呈“快进快退”强化模式可诊断为HCC[2];而《亚太肝病协会指南》建议无论结节大小如何只要显示“快进快退”强化模式即可诊断为HCC[3];且其认为超声造影(CEUS)相比增强CT/MRI 在诊断HCC 方面具有相似甚至更高的合并敏感性和阳性预测值,若将CEUS 作为一线诊断工具将具有更高的成本效益比。为了规范CEUS 操作、统一术语和诊断标准、促进影像报告标准化、减少图像解读误差,美国放射学会(ACR)2016年在CT/MRI 肝脏影像报告和数据系统(LI-RADS)的基础上提出了一套综合性的CEUS LI-RADS,并于2017年进行了更新[4]。本研究旨在探讨ACR CEUS LI-RADS 2017 版(v2017)分类标准在指导低年资医师预测肝癌高危人群FLL中HCC的应用价值。
资料与方法
一、临床资料
选取2018年1月至2021年1月在瑞金医院及其无锡分院行CEUS检查的HCC高危患者188例,男137例,女 51 例,年龄 21~83 岁,平均(56.93±11.84)岁;单发157 例,多发 31 例,共 225 个病灶,中位直径 2.40(2.00)cm。其中173 个病灶经穿刺或术后组织病理学证实,52 个病灶经增强CT/MRI 检查及随访(≥2 年)证实;其中 HCC 132 个;非 HCC 93 个,包括良性病变65 个,分别为肝硬化相关增生结节32个、血管瘤13个、局灶性结节性增生(FNH)10个、炎性病灶4个、胆管细胞轻至中度不典型增生2 个、其他良性病变4 个,非HCC 恶性肿瘤 28 个,分别为 ICC 和转移癌各 10 个、CHC 和原发性神经内分泌肿瘤各3 个、肉瘤样癌和胆管腺鳞癌各1个。纳入标准:①患者有肝硬化、慢性病毒性肝炎、HCC 病史、肝移植术后、HCC 家族史等HCC高危风险;②二维超声显示有明确的FLL;③影像资料完整,有注射造影剂后60 s内的连续、完整视频资料及60 s 后间歇性的静态图像;④经组织病理学或经增强CT/MRI 检查且随访(≥2 年)确诊(良性病灶截至入组时间为2019 年1 月)。排除标准:①无HCC 高危因素;②年龄<18 岁的先天性或血管性因素所致肝硬化者;③肝内弥漫性再生结节;④接受过系统性治疗或病灶接受过局部治疗者。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.CEUS 检查:使用迈瑞 Re 7、Re 7S、Re 8 及百胜MyLab Twice 彩色多普勒超声诊断仪,SC5-1U 和L9-3U 探头,频率 1~5 MHz 和 3~9 MHz;CA541 探头,频率1~8 MHz。造影剂使用SonoVue(意大利Bracco 公司),每瓶含六氟化硫气体冻干粉59 mg。患者取左侧卧位或平卧位,常规超声观察肝内病灶数目、位置、大小等基本特征后选取病灶最大切面,进入CEUS 模式;经肘部浅静脉团注SonoVue 1.5~2.0 ml 后快速推注5.0 ml生理盐水,造影剂注射完毕开始计时,存储动态图像,实时连续动态观察造影过程6~8 min。每次注射仅观察一个病灶,多个病灶者间隔15 min 后可重复注射观察。CEUS 观察指标包括增强开始及廓清时间、增强程度、增强时相、增强形态、增强类型等。
2.传统诊断方法:本研究参照国内外CEUS 指南[5-6]推荐的FLL 诊断方法定义为传统方法,具体:①HCC,动脉相呈高增强,门脉相和(或)延迟相呈轻/中度低增强;②ICC,动脉相环状高增强,门脉相早期出现廓清;③转移癌,延迟相明显低增强,呈“黑洞征”;④炎性病变,动脉相环状增强或不均匀增强,门脉相和(或)延迟相低增强;⑤其他常见肝脏良性病变,门脉相和延迟相无明显造影剂廓清,其中血管瘤动脉相周边结节样高增强、部分或完全向心性充填;FNH 动脉相快速离心性高增强、部分可见轮辐状血管,肝硬化相关增生结节动脉相等或低增强。
3.CEUS LI-RADS 分类标准[4]:①LR-1 类(100%确定为良性),表现为三期无增强的结节,或动脉相周边不连续结节样增强缓慢向内部分或完全填充,或三期均呈等增强的胆囊窝周围/肝6 段门静脉右支前方无立体感的片状高或低回声区;②LR-2 类(良性可能),表现为肝内<10 mm的等增强实性结节,或任意大小等增强的非结节样病灶,或原LR-3类结节随访2年及以上大小稳定不变;③LR-3 类(HCC 中度可疑),结节最大径≥20 mm但无动脉相高增强和廓清,或<20 mm但无动脉相高增强伴或不伴延迟/轻度廓清,或<10 mm有动脉相高增强但无廓清;④LR-4 类(HCC 可能大),结节最大径≥20 mm 无动脉相高增强但有延迟/轻度廓清,或≥10 mm 有动脉相高增强但无廓清,或<10 mm 有动脉相高增强和延迟/轻度廓清;⑤LR-5 类(100%确定为HCC),诊断标准为结节最大径≥10 mm 有动脉相高增强和延迟/轻度廓清;⑥LR-M 类(可疑或确定为恶性,但非特指HCC),表现为任意大小结节有早期/显著廓清,或有边缘环形高增强和廓清。其中,动脉相高增强指整体或局部高增强而非环状或周边不连续结节样增强;早期廓清为发生时间<60 s,延迟廓清为发生时间≥60 s;显著廓清为≤120 s 内呈“黑洞”样表现,轻度廓清为病灶增强低于肝实质但未呈“黑洞”样表现或>120 s呈“黑洞”样表现。
4.分组:由 2 名 1~2 年 CEUS 工作经验的低年资医师(医师A 组,根据欧洲超声医学与生物学联合会[7]超声培训的最低要求常规超声操作水平已达2级),以及2名10年以上CEUS工作经验的高年资医师(医师B组,常规超声操作水平已达3 级且具备10 年以上腹部CEUS 工作经验),在仅知患者为HCC 高危人群的前提下两组分别独立观察每个病灶的CEUS 资料并根据传统方法做出HCC 与非HCC(包括良性病变及非HCC恶性肿瘤)诊断;对医师A 组进行CEUS LI-RADS 规范化培训后再次对每个病灶进行分类。组内需讨论达到意见一致,组间不可讨论。
三、统计学处理
应用SPSS 23.0统计软件,计数资料以频数或百分比表示,以组织病理学结果和增强CT/MRI 检查及随访结果为金标准,计算医师A 组和医师B 组诊断HCC的准确率、敏感性、特异性、阳性预测值、阴性预测值,组间比较行χ2检验。P<0.05为差异有统计学意义。
结 果
一、医师A 组和医师B 组采用传统方法鉴别HCC情况
医师 A 组准确诊断 107 个 HCC,42 个非 HCC 被误判为HCC,包括非HCC 恶性肿瘤21 个(转移癌7 个、ICC 6 个、CHC 和原发性神经内分泌肿瘤各3 个、肉瘤样癌和胆管腺鳞癌各1 个)和良性病变21 个(肝硬化相关增生结节8 个、FNH 5 个、血管瘤和炎性病灶各3 个、胆管细胞不典型增生2 个),其诊断HCC 的准确率、敏感性、特异性、阳性预测值、阴性预测值分别为70.22%、81.06%、54.84%、71.81%、67.11%;医师B 组准确诊断 127 个 HCC,19 个非 HCC 被误判为 HCC,包括转移癌2 个和良性病变17 个(肝硬化相关增生结节6 个、FNH 5 个、血管瘤、炎性病灶和胆管细胞不典型增生各2 个),其诊断HCC 的准确率、敏感性、特异性、阳性预测值、阴性预测值分别为89.33%、96.21%、79.57%、86.99%、93.67%。医师B 组采用传统方法诊断HCC 的效能均较医师A 组好,差异均有统计学意义(χ2=25.47、15.04、12.90、10.35、17.51,均P<0.05)。见表1,2。
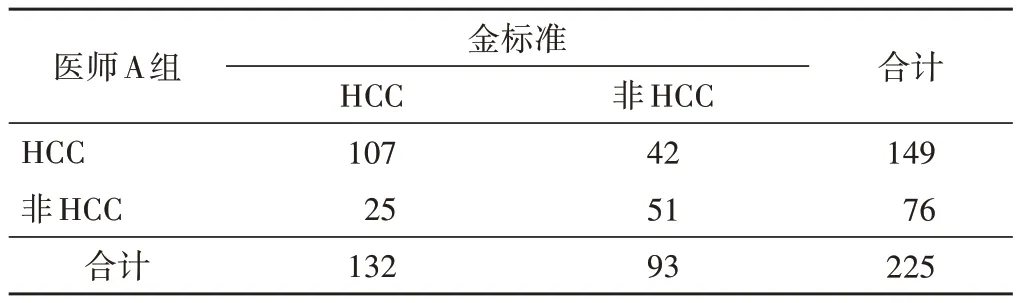
表1 医师A组采用传统方法鉴别HCC情况 个
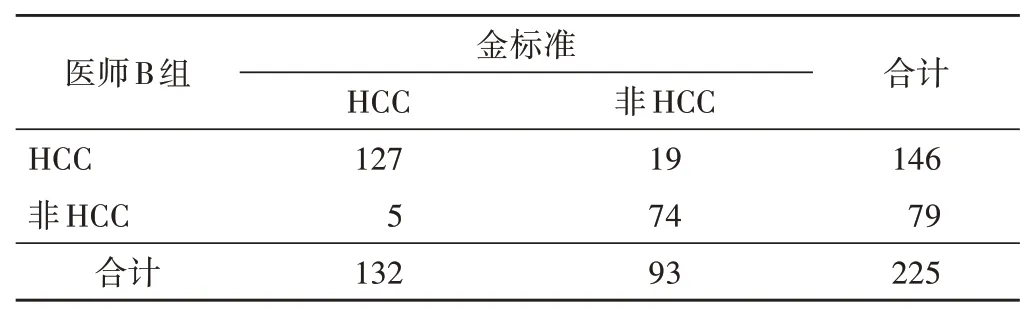
表2 医师B组采用传统方法鉴别HCC情况 个
二、医师A 组采用CEUS LI-RADS 分类标准分类及诊断情况
1.医师A 组采用CEUS LI-RADS 分类标准分类:LR-1 类病灶 14 个、LR-2 类病灶 10 个,均为良性;LR-3 类病灶36 个,包括肝硬化相关增生结节18 个、HCC 12个、血管瘤3个、FNH 2个、炎性病变1个;LR-4类病灶32 个,包括HCC 21 个、肝硬化相关增生结节6个、FNH 4 个、胆管腺鳞癌 1 个;LR-5 类病灶 104 个,包括HCC 95 个、转移癌、炎性病变和胆管细胞不典型增生各2个、ICC、FNH和肝硬化相关增生结节各1个;LR-M类病灶29 个,包括ICC 9 个、转移癌8个、HCC 4个、CHC和原发性神经内分泌肿瘤各3 个、肉瘤样癌和炎性病变各1个。见图1,2。

图1 HCC超声造影图像
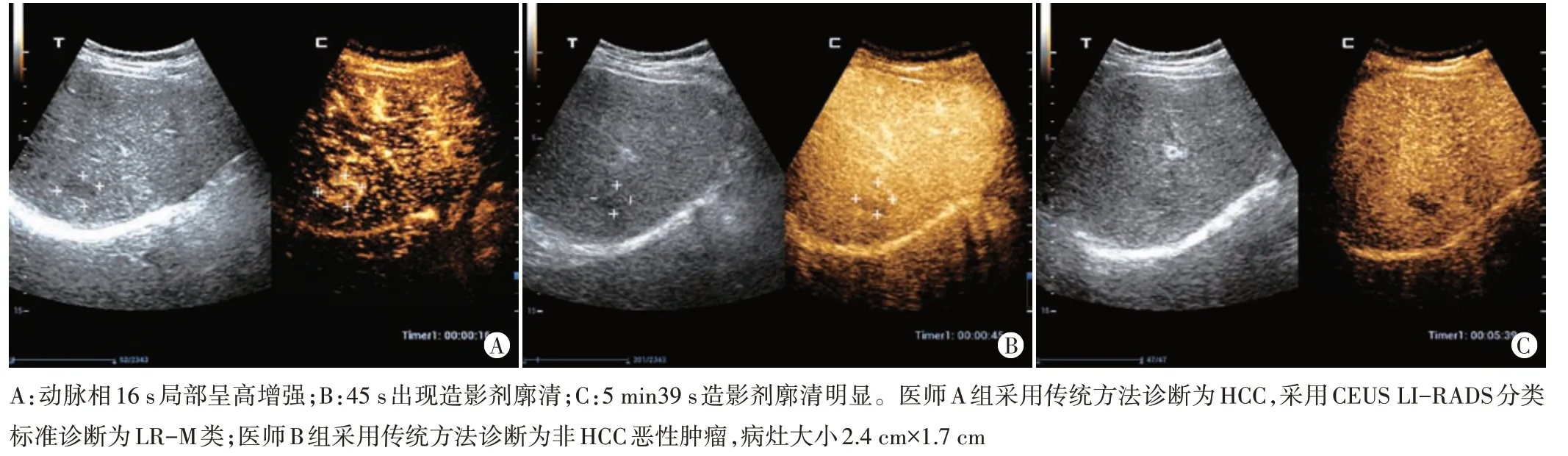
图2 炎性肉芽肿超声造影图像
2.医师A 组采用CEUS LI-RADS 分类标准诊断HCC 效能及比较:医师A组以LR-3、4、5类为标准鉴别HCC与非HCC的准确率、敏感性、特异性、阳性预测值、阴性预测值分别为78.67%、96.97%、52.69%、74.42%、92.45%,其中准确率、敏感性和阴性预测值均较传统方法显著提高(χ2=4.22、17.08、11.51,均P<0.05),敏感性和阴性预测值与医师B 组相似(χ2=0.00 和0.01,均P>0.05);若以LR-4、5类为标准鉴别HCC 与非HCC 的准确率、敏感性、特异性、阳性预测值、阴性预测值分别为84.00%、87.88%、78.49%、85.29%、82.02%,其中准确率、特异性、阳性预测值、阴性预测值均较传统方法显著提高(χ2=12.100、11.710、7.592、4.885,均P<0.05),准确率与医师B 组相似(χ2=2.769,P>0.05);若以LR-5 类为标准鉴别HCC 与非HCC 的准确率、敏感性、特异性、阳性预测值、阴性预测值分别为79.56%、71.97%、90.32%、91.35%、69.42%,其中准确率、特异性、阳性预测值均较传统方法显著提高(χ2=5.21、29.42、14.52,均P<0.05),特异性显著高于医师 B 组(χ2=4.20,P<0.05),阳性预测值略高于医师 B 组,差异无统计学意义(χ2=1.16,P>0.05)。见表3~5。
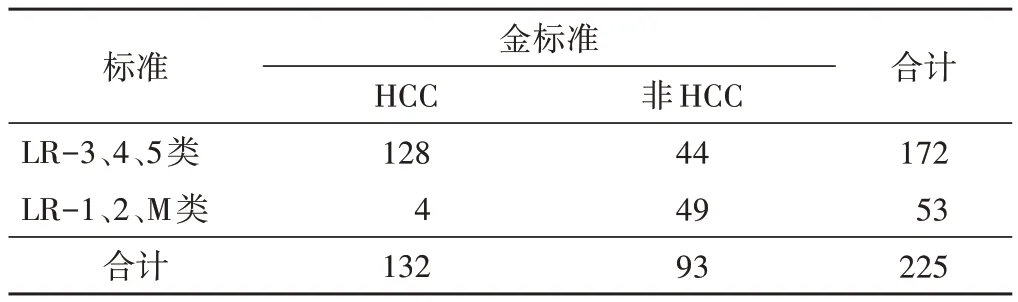
表3 医师A组以LR-3、4、5类为标准鉴别HCC情况 个
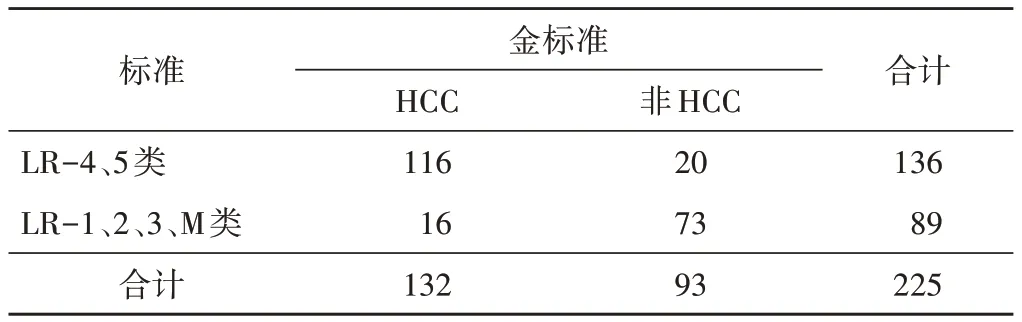
表4 医师A组以LR-4、5类为标准鉴别HCC情况 个
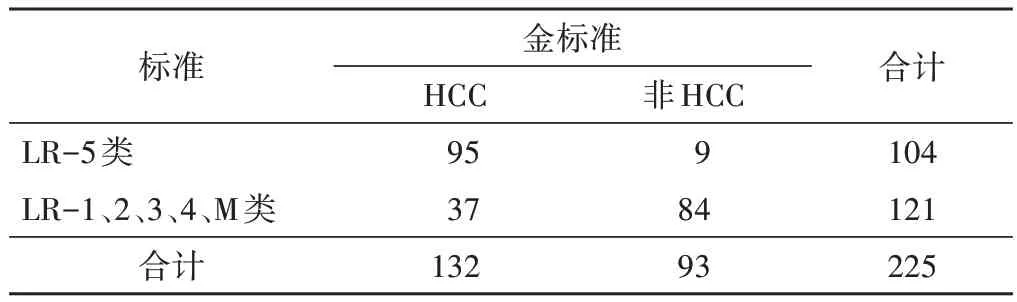
表5 医师A组以LR-5类为标准鉴别HCC情况 个
讨 论
CEUS在FLL的检出、诊断和鉴别诊断中均具有良好的临床应用价值,但低年资医师采用传统方法时可能在诊断思路、FLL非典型CEUS表现的识别及图像解读等方面不及高年资医师,导致其对HCC 等的诊断效能往往较低。传统方法适用于所有FLL 患者,并根据有无肝硬化背景对FLL进行定性诊断及具体病理学类型鉴别,但FLL 病理学类型繁多且部分良恶性FLL 的CEUS 表现存在交叉重叠现象,给诊断增加了难度。ACR CEUS LI-RADS v2017 的发布为超声医师在诊断HCC 方面提供了新的参考依据,其对HCC 高危人群进行肝脏全谱病变的描述,注重对FLL 的HCC 危险程度分类,而非关注FLL 的具体病理学类型;且由于HCC的危险程度与其大小存在密切相关:FLL<10 mm 时恶性的几率很小,>20 mm 时恶性风险高达 80%[2-3,5],因此 CEUS LI-RADS v2017 将 CEUS 表现相同的 FLL 按大小进行分类,弥补了传统方法的不足。超声医师采用CEUS LI-RADS 时仅需根据CEUS 表现和大小将FLL 归到相应的类别即可,减轻了低年资医师在诊断思路及对FLL 非典型CEUS 表现识别方面的负担。此外,CEUS LI-RADS v2017对动脉相高增强和廓清特征做了具体的定义,较传统方法而言,在图像解读方面提供了更加明确的参考标准。本研究通过比较低年资医师采用CEUS LI-RADS v2017 分类标准与采用传统方法对HCC 的诊断效能,证实CEUS LI-RADS 对低年资医师的指导价值。
本研究结果显示,医师A 组采用传统方法诊断HCC 的准确率、敏感性、特异性、阳性预测值、阴性预测值分别为70.22%、81.06%、54.84%、71.81%、67.11%,均低于医师B 组(89.33%、96.21%、79.57%、86.99%、93.67%,均P<0.05)。与Zhou 等[8]比较6 名不同CEUS工作经验(1~9年)的超声医师诊断HCC效能的研究结果相似。本研究医师A 组采用传统方法准确诊断的107 个HCC,经CEUS LI-RADS v2017 分类标准显示归为LR-4类8个、LR-5类95个、LR-M类4个;若以LR-5类作为HCC 诊断标准,则特异性和阳性预测值分别为90.32%和91.35%,与一项大型Meta分析研究[9]结果相似;其中,特异性高于医师A、B 组采用传统方法所得诊断结果(均P<0.05),阳性预测值显著高于医师A 组(P<0.05)、略高于医师B 组(P>0.05)采用传统方法诊断结果。分析原因可能为:LR-5类的诊断标准包括同时存在动脉相高增强和延迟/轻度廓清,此为HCC 典型CEUS 表现,而将常见非HCC 恶性肿瘤及良性病变排除在外。
对于体积较小或分化较好的HCC,可呈动脉相高增强、延迟相等增强或动脉相等增强、延迟相轻度廓清的不典型CEUS 表现。本研究医师A 组采用传统诊断方法未能准确判断的25个表现不典型的HCC,归为LR-3类12个、LR-4类13个,这是由于CEUS LI-RADS v2017 分类标准中 LR-3、4 类几乎囊括了 HCC 的所有不典型 CEUS 表现。研究[10]发现,LR-3、4 类 HCC 预后并未必优于LR-5 类HCC,故有必要将LR-3、4、5 类联合用于HCC的诊断。本研究医师A组以LR-3、4、5类为标准诊断的假阴性病例较少,仅4个HCC 因早期/显著廓清而归为LR-M 类,敏感性达96.97%,显著高于医师A组采用传统方法诊断结果(P<0.05)。与韩浩等[11]研究结果相似。由此可见,联合LR-3、4、5 类诊断HCC 可能更符合东亚地区对于诊断HCC 高敏感性的临床实践需求[12]。
本研究的局限性:①为单中心回顾性研究;②仅2 名低年资医师和2 名高年资医师对图像进行解读,鉴于不同个体对CEUS 图像观察的差异性及对CEUS LI-RADS 的理解和掌握有所不同,可能无法全面反映LI-RADS 对低年资医师的指导作用,有待今后行多中心大样本的前瞻性研究验证。
综上所述,CEUS LI-RADS 分类标准对提高低年资医师预测肝癌高危人群中HCC 的效能有较好的指导作用。
