猪肠道微生物及其代谢产物与肠道屏障研究进展
2022-05-30张德明黄嘉訸李劲树郑红梅王少英杨公社史新娥
张德明,黄嘉訸,李劲树,郑红梅,王少英,杨公社,史新娥
(陕西省动物遗传育种与繁殖重点实验室 西北农林科技大学动物科技学院动物脂肪沉积与肌肉发育实验室,杨凌 712100)
猪肠道微生物随着猪生长发育而不断发生变化,当肠道发育趋于成熟时,肠道微生物的多样性和数量也更加稳定。稳定的肠道菌群不仅可以减少有害菌对肠道的破坏,还能参与调控动物机体健康,如促进营养物质消化吸收、维持肠道屏障完整等生理活动。当肠道微生物发生紊乱时,致病菌快速增殖,引发仔猪腹泻,严重威胁仔猪生命。此外,猪肠道微生物的代谢产物与猪肠道屏障有着密切联系,因此肠道微生物对猪的健康起着举足轻重的作用。本文就肠道微生物对肠道屏障的影响及其机制进行综述,以期为肠道微生物与肠道屏障间关系的研究提供一些思路。
1 肠道微生物在仔猪不同发育阶段的分布
1.1 肠道微生物在哺乳仔猪阶段的分布
在仔猪娩出时和出生后,由于仔猪与母体的产道、母乳、粪便以及环境接触,微生物开始迅速在仔猪胃肠道内定植,刚出生的仔猪肠道内含有氧气,因此最先定植的是需氧菌和兼性厌氧菌,随着胃肠道内的氧气耗尽,专性厌氧菌在肠道开始定植。在出生时仔猪肠道的优势菌门是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)。出生12 h后,哺乳仔猪肠道定植的微生物(门水平)主要为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门,其中厚壁菌门含量最多,拟杆菌门次之(表1)。在属水平上,类杆菌属、梭杆菌属、埃希氏菌属和志贺氏菌属是仔猪出生第3~7天粪便样本中的主要细菌属。相比之下,普雷沃氏菌属和考拉杆菌属在第14~35天的肠道中占优势。乳酸杆菌的相对丰度在第3天较低,但在第7天的相对丰度最高(表1)。哺乳仔猪小肠中的乳酸杆菌和链球菌等优势菌群可以充分地利用母乳中的营养成分。猪肠道早期微生物可能会对其以后的健康产生影响,因此可以通过优化母猪妊娠期和泌乳期的日粮改善猪肠道菌群组成和提高哺乳仔猪抗病能力。
1.2 肠道微生物在断奶仔猪阶段的分布
断奶不会影响肠道内门水平的微生物种类,断奶仔猪肠道定植的主要微生物仍为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、螺旋菌门(Spirochaetes)和柔膜菌门(Tenericutes),但其丰富度会发生变化,断奶仔猪肠道中的拟杆菌门最为丰富,而厚壁菌门次之(表1)。在科水平上,断奶仔猪肠道中乳杆菌科、瘤胃菌科、韦氏菌科和普雷沃氏菌科的相对丰度增加。在属水平上,瘤胃杆菌属和阿克曼氏菌属是断奶仔猪独有的,占优势的其他属包括埃希氏菌属、拟杆菌属、普氏菌属(表1)。在仔猪断奶阶段胃肠道并未发育成熟,微生物群落并不稳定,极易受环境因素的影响。断奶仔猪肠胃内的pH发生改变,从而使得大肠杆菌数量增多,大肠杆菌大量繁殖进而抑制了乳酸杆菌的生长,此时断奶仔猪肠道的吸收能力也较弱,对饲料利用较低,这些因素的改变极易引发断奶仔猪腹泻。以上研究结果提示,通过有效手段调节肠道pH可以促进有益菌的生长,抑制有害菌的繁殖,从而改善肠道菌群结构。目前,许多研究人员以日粮组成为切入点来改善仔猪肠道健康,提高断奶仔猪抗病能力。Shin等在断奶仔猪日粮中添加植物乳杆菌制剂,提高了其粪便中乳酸菌的数量,并增加了仔猪粪便微生物群落中厚壁菌门微生物的多样性和相对丰度,从而降低肠道炎症因子基因的表达,促进了肠道的发育。吕存等在日粮中补充合生元改变了断奶仔猪肠道微生物结构和代谢,提高了其生长性能。因此,通过优化断奶仔猪日粮,可以改善肠道pH和肠道菌群结构,增强肠道屏障能力。
1.3 肠道微生物在猪生长和育肥阶段的分布
断奶仔猪发育后期,肠道微生物的多样性和微生物数量趋于稳定,因此生长和育肥阶段猪肠道微生物的种类相似性较高,但菌群在数量上有差异。在门水平上,厚壁菌门、拟杆菌门在生长和育肥阶段仍占据主导地位,这两个门占总序列的70%,其中厚壁菌门最丰富。在属水平上,生长阶段的巨型球菌属、链球菌属和普氏菌属的丰富度均高于育肥阶段,其中普氏菌属在生长阶段数量最多;棒杆菌属、梭菌属和双歧杆菌属在育肥阶段丰富度最高(表1)。

表1 猪不同阶段肠道微生物在门和属水平上的分布
2 肠道微生物的代谢产物对肠道健康影响的机制研究
猪消化道微生物不仅可以分解消化道物质,还影响着消化道物质的运输、黏膜上皮细胞的更新和营养物质的吸收。在机体内,饲料中未被消化吸收的营养素经过一系列代谢进入靶器官进行代谢沉积。肠道微生物是营养素肠道代谢的重要参与者。肠道菌群可以为宿主提供许多有益原料,包括挥发性脂肪酸、维生素K等,肠道菌群还参与胆汁酸循环和色氨酸代谢。因此,肠道菌群可间接地为肠道稳态提供保障,保护机体健康。
2.1 短链脂肪酸对肠道屏障机制影响的研究
短链脂肪酸又称为挥发性脂肪酸(short chain fatty acids, SCFA),其中丁酸、丙酸和乙酸占结肠中SCFA的90%~95%,它们可以通过多种途径对宿主代谢产生影响。短链脂肪酸大部分是由肠道微生物发酵产生的,短链脂肪酸通过与其受体结合能够抑制肠道有害微生物生长、调节肠道pH、保护肠道屏障和维持肠道健康。短链脂肪酸受体GPR41(G protein-coupled receptor 41)、GPR43(G protein-coupled receptor 43)和GPR109A(G protein-coupled receptor 109A)属于G蛋白偶联受体(G protein-coupled receptors, GPCR)家族(表2)。
在机体内,乙酸可以通过肝代谢为周边组织提供能源。丙酸参与肝的糖异生,抑制脂肪肝的生成。丁酸通过氧化作用为肠道黏膜上皮细胞提供能量,改善肠道黏膜形态和肠道屏障功能,降低有害菌对肠道的侵袭,维持肠道健康。在断奶仔猪胃内灌注短链脂肪酸可改善肠道形态,维持肠道屏障功能,有利于仔猪肠道发育。短链脂肪酸促进肠道黏蛋白的分泌,进而影响肠道黏膜屏障。Chen等研究发现,SCFA调节猪肠道中组蛋白去乙酰化酶(histone deacetylase,HDAC)活性,从而抑制核转录因子κB(nuclear factor kappa B, NF-κB)的表达,减少白介素6(interleukin6, IL-6)、白介素18(interleukin18, IL-18)和肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的分泌(表2)。乙酸和丙酸可激活GPR43上调叉头框转录因子P3(forkhead box P3, FOXP3)表达从而使调节性T细胞增殖,促进抗炎细胞因子IL-10的表达。丁酸盐可通过激活GRP109A促进IL-10表达,减少炎症因子IL-6、IL-17的表达而增加巨噬细胞和树突状细胞抗炎能力。
短链脂肪酸的组成主要由微生物群的组成决定,如双歧杆菌、乳杆菌、普雷沃氏菌产生乙酸,厚壁菌门产生丁酸,拟杆菌属和厚壁菌属产生丙酸,而微生物的组成也受益生元膳食纤维的影响。通过改变日粮的组成也可以提高短链脂肪酸的含量,Chen等研究表明,可溶性纤维提高了猪结肠中变形菌、放线菌和梭形菌的相对丰度;不可溶性纤维提高了拟杆菌属、粪球菌属和普雷沃氏菌属的丰度。Zhang等在猪日粮中添加苜蓿、麦麸、纯纤维素,与对照组相比,苜蓿组增加了粪球菌、拟杆菌的相对丰度;麦麸组降低了干酪乳杆菌的丰度,增加了多雷氏菌的丰度;纯纤维素组降低了腐解真菌的相对丰度,增加了普雷沃氏菌的相对丰度。总之,SCFA在改善肠道屏障和维持肠道通透性中发挥重要作用,但SCFA在肠道和身体其他组织和器官中发挥作用的机制以及如何靶向调控肠道屏障需要进一步研究。
2.2 胆汁酸对肠道屏障机制影响的研究
胆汁酸(bile acid, BA)主要促进脂质及脂溶性维生素的溶解、消化和吸收,在肝内合成的胆酸(cholic acid, CA)和鹅去氧胆酸(chenodeoxycholic acid, CDCA)两种初级胆汁酸储存在胆囊中。动物消化食糜时,会刺激缩胆囊素的分泌,进一步刺激胆囊收缩并分泌胆汁酸到肠腔内,维持动物的正常生理机能。肠道内的部分胆汁酸在胆盐水解酶的作用下生成次级胆汁酸,即脱氧胆汁酸(deoxycholic acid, DCA)和石胆酸(lithocholic acid, LCA),这是肠道微生物改变胆汁酸的关键一步。参与胆汁酸代谢的主要细菌属有拟杆菌、梭状芽胞杆菌、双歧杆菌、乳酸菌和李斯特菌。在肠道伤口修复的过程中需要经历3个阶段,即屏障重建、伤口通道形成和隐窝再生。DCA可以抑制前列腺素E2(prostaglandin E2, PGE2)的产生,促进肠道修复过程中伤口通道形成和隐窝再生。在从屏障重建到伤口通道形成的转变过程中,PGE2水平降低才能形成伤口通道,DCA通过法尼醇X受体(farnesoid X receptor, FXR)抑制PGE2合成所需的胞浆型磷脂酶A2(cytosolic phospholipase A2, cPLA2),促进伤口通道形成。但次级胆汁酸升高会造成肠道形态受损,促使肠道发生炎症反应。
FXR是胆汁酸的核受体,主要调节胆汁酸稳态,在肠道、肝组织中高表达。胆汁酸可激活FXR预防化学诱导的肠道炎症,改善结肠炎症状,抑制上皮通透性,减少杯状细胞损失。此外,FXR激活可抑制结肠黏膜不同免疫细胞群产生促炎细胞因子(表2)。高水平的DCA和LCA可影响肠道紧密连接蛋白的表达,破坏仔猪肠道屏障和细胞的增殖;同时,可激活仔猪肠道FXR,进而诱导小异源二聚体伙伴(small heterodimer partner, SHP)抑制胆汁酸水平。
胆汁酸激活仔猪肠道G蛋白偶联胆汁酸受体(G protein-coupled bile acid receptor, GPBAR, 也称TGR5)的表达,进而促进胰高血糖素样肽-1(Glucagon-like peptide 1, GLP-1)和胰高血糖素样肽-2(Glucagon-like peptide 1, GLP-2)分泌,GLP-2可促进仔猪肠道黏膜的生长(表2)。研究发现,添加CDCA可激活TGR5促进GLP-1和GLP-2的分泌,CDCA还能够增加仔猪小肠重量并改善肠道形态。LCA和DCA通过激活TGR5抑制NF-κB信号通路,减少促炎因子表达。
胆汁酸对肠道微生物的组成也存在一定的影响,它能够直接抑制细菌生长繁殖,但是它抑制菌群生长的机制尚不明确,有待进一步研究。过多的胆汁酸会造成肠道损伤,而肠道菌群可参与胆汁酸代谢,影响胆汁酸的含量,因此,可以通过肠道菌群维持胆汁酸稳态来缓解仔猪断奶应激。
2.3 维生素对肠道屏障机制影响的研究
维生素是生物体维持正常生命活动不可或缺的营养成分,它可以维持机体正常的发育、繁殖、抵抗疾病和新陈代谢。肠道菌群可以合成多种维生素,如维生素B、维生素B、维生素K等。
临床试验证明,维生素具有调节肠道微生物的作用,Lee和Ko研究表明,维生素A可以改变肠道微生物,并且在维持上皮细胞完整性与免疫功能发挥着重要作用。维生素D在肝和肾中通过两步羟基化作用转化为活性代谢物1,25-二羟基维生素D(1,25(OH)D),生物活性由核激素受体超家族成员维生素D受体(vitamin D receptor, VDR)介导,VDR在肠道中大量表达,VDR在小肠中的经典作用是调节跨细胞钙转运(表2)。有研究发现,VDR 缺失时,小肠跨上皮电阻出现损失,肠道紧密连接受到破坏,肠道通透性增加,这表明VDR下调可能与肠道屏障受损有关(表2)。此外,维生素D通过VDR促进非受体型蛋白酪氨酸磷酸酶2(protein tyrosine phosphatase non-receptor type2, PTPN2)的表达,降低肠道通透性(表2)。维生素D不仅能诱导VDR表达,还能抑制TNF-α的产生,维生素D-VDR信号通过抑制炎症诱导的肠上皮细胞凋亡来维持黏膜屏障的完整性。有关维生素对肠道屏障调节以及维生素与菌群之间的相互关系研究较少,其中的作用机制有待进一步研究。
2.4 吲哚类对肠道屏障机制影响的研究
色氨酸(tryptophan, Trp)是猪生长过程中的必需氨基酸之一,少量的色氨酸可以通过肠道微生物将其代谢为吲哚和吲哚衍生物(吲哚丙烯酸、吲哚乳酸、吲哚-3-乙醛和吲哚-3-乙酸),进而被肠道上皮细胞吸收。肠道中乳酸杆菌、大肠杆菌、拟杆菌和梭状芽胞杆菌都可以对Trp进行代谢,如大肠杆菌和拟杆菌可以将Trp转化为吲哚和乳酸杆菌将Trp代谢为吲哚乳酸(表2)。在肠道中芳香烃受体(aryl hydrocarbon receptor, AHR)是免疫和炎症的关键调节因子,参与适应性免疫和肠道黏膜屏障功能。色氨酸可以激活AHR信号通路,释放IL-22抵御病原菌侵袭肠道,进而发挥降低肠道炎症和保护肠道健康的作用。Trp可以激活猪肠细胞中的雷帕霉素受体蛋白(mammalian target of Rapamycin, mTOR)信号通路,促进防御素表达(表2)。
2.5 多酚类物质对肠道屏障机制影响的研究
多酚进入动物机体后,少部分经过小肠吸收进入血液,大部分通过肠道菌群代谢降解成易被吸收的酚或酚酸类物质,随着体液循环为动物机体的健康发挥作用。多酚类物质通过增加乳酸杆菌和双歧杆菌或减少大肠杆菌和沙门菌的数量来调控肠道菌群生长,并抑制炎症信号通路,减少炎症因子释放和对肠道紧密连接的破坏,从而保护肠道屏障的完整性。日粮添加原儿茶酸可以提高断奶仔猪肠道紧密连接蛋白的表达和抑制NF-κB/促分裂素原活化蛋白激酶(mitogen-activated protein kinases, MAPK)通路,减少炎症因子的分泌,对肠道屏障起到保护作用(表2)。Wei等研究发现,日粮中添加香芹酚-百里香酚混合物可以抑制TNF-α释放和减少肠球菌属和大肠杆菌的数量,增加乳酸杆菌属数量,缓解断奶对肠道的应激反应。

表2 肠道微生物代谢产物对肠道屏障机制影响的研究
微生物代谢产物对肠道屏障起着重要的保护作用,但它们对肠道屏障调节途径不尽相同,多酚类物质随着体液循环发挥作用;吲哚类直接作用于肠道上皮细胞;短链脂肪酸通过其受体作用于炎症信号通路。尽管途径有所不同,但这些代谢产物最终都是抑制炎症信号通路和促进紧密连接蛋白以及黏蛋白表达,来保护肠道。
3 肠道微生物及其代谢产物与肠道屏障的关系研究
肠道屏障分为物理、化学、免疫、微生物屏障。肠道微生物及其代谢产物可以提高肠道屏障能力,抵御病原入侵,降低炎症发生,共同维持肠道内环境稳态,在保护肠道健康中发挥积极作用。
3.1 肠道微生物及其代谢产物与物理屏障
物理屏障是由完整的肠上皮细胞紧挨排列在一起以及连接相邻2个上皮细胞之间的紧密组分构成。物理屏障在肠道屏障中占据重要地位,能够保障营养物质在肠道中的吸收,抵御病原菌的侵袭,其中紧密连接蛋白在物理屏障中发挥着重要作用。
肠道物理屏障可以为肠道微生物的平衡提供保障。当物理屏障受到损伤,紧密连接蛋白遭到破坏,导致肠道黏膜通透性增高,进而造成细菌易位使肠道内菌群失调,引起肠道损伤以及炎症的发生。微生物的代谢产物可以保护肠道物理屏障,调节肠道有益菌数量。在断奶仔猪日粮中添加维生素E,可以改善肠道通透性,对紧密连接蛋白具有一定的保护作用(表3)。Trp可以增加仔猪肠道闭锁小带蛋白1(zonula occludens 1, ZO-1)、ZO-3闭合蛋白(Claudin)和咬合蛋白(Occludin)的丰度。Zhang等研究表明,丙酸灌注盲肠显著上调空肠黏膜中-4的mRNA水平以及-1和的表达。Yan和Ajuwon研究发现,丁酸盐可能通过上调-3的mRNA表达和蛋白丰度,增加紧密连接蛋白的合成,以及通过调节细胞的能量状态来保护上皮细胞,维持肠道屏障完整性。Wang等在断奶仔猪日粮中添加菊粉,提高了盲肠中乙酸和丁酸的浓度,从而促进紧密连接蛋白的表达,改善肠道形态。Liu等研究发现,低剂量的丁酸盐通过降低IL-6和NF-κB的表达和增加肠道紧密连接蛋白Claudin-7的表达,保护肠道上皮细胞,降低坏死性肠炎对肠道的损伤,保护肠道屏障。据报道,多形拟杆菌可诱导富含脯氨酸的小蛋白2A的表达,这是维持上皮绒毛桥粒所必需的。维持紧密连接的另一种机制是由微生物刺激Toll样受体(Toll-like receptors, TLR)介导的信号通路。蛋白激酶C(protein kinase, PKC)与肠腔细菌对肠上皮完整性的调节有关。肠上皮细胞包含多个潜在的PKC结合位点,这表明它在保持紧密连接完整性中发挥一定作用。植物乳酸杆菌可以激活TLR2/PKC通路,诱导ZO-1向紧密连接结构易位,增强肠道屏障的作用。
3.2 肠道微生物及其代谢产物与化学屏障
肠道化学屏障主要是由黏液层构成,是肠道的动态防御屏障,由胃肠道分泌的消化酶、溶菌酶,肠道潘氏细胞分泌的抗菌肽,肠道杯状细胞产生的黏蛋白(mucoprotein, MUC)共同形成。
潘氏细胞位于肠道隐窝基部,潘氏细胞通过产生抗菌物质和维持宿主共生菌的平衡,在维持体内平衡中发挥重要作用。潘氏细胞颗粒受到肠道菌群的刺激可分泌许多抗菌蛋白,如α-防御素、溶解菌、胞浆型磷脂酶A2。此外,Reg Ⅲ蛋白(regenerating Ⅲ protein, Reg Ⅲ)是抗菌C型凝集素,主要由潘氏细胞产生,在动物肠道的抗菌保护中发挥重要作用。Reg3的表达是通过两个途径来调控的,一是TLR/髓样分化因子88(myeloid differentiation factor88, MyD88)途径,另一个是通过3型先天淋巴细胞(3 innate lymphoid cells, ILC3 s)对IL-22的刺激,这两条途径均由肠道微生物群激活。微生物发酵产生的丁酸盐可以提高黏蛋白的表达量,黏液就是由杯状细胞分泌的多种黏蛋白组成,其中MUC2是一种大型糖蛋白,是结肠黏液的主要黏蛋白,可以建立一个黏液屏障,将细菌与结肠上皮分开,如果黏液分泌不足会导致肠道发生炎症;同时可以提供多糖作为有机体的营养来源,并在保护肠道屏障、调节微生物群落稳态方面发挥作用。吲哚丙烯酸可促进杯状细胞分泌黏液以增强屏障功能。丙酸可以恢复肠道杯状细胞数量,促进MUC2和MUC3的表达,黏蛋白分泌的黏液可以润滑肠道,减少内容物对肠道的破坏(表3)。杯状细胞也可以产生三叶因子和抵抗素样分子-β(resistin-like molecule beta)等因子,它们可以稳定黏蛋白聚合物,从而保持肠道屏障完整性。生物体多形拟杆菌能诱导潘氏细胞产生基质蛋白酶素,激活防御素参与宿主先天防御。日粮添加溶菌酶可改善肠道形态,并提高拟杆菌门、变形菌门和纤维杆菌的相对丰度。
3.3 肠道微生物及其代谢产物与免疫屏障
免疫屏障由肠道淋巴组织、免疫细胞和相关细胞因子(IL-6、IL-10、sIgA)等组成。在胃肠道免疫中发挥重要作用的是分泌型IgA(secretory IgA,sIgA),肠道微生物可以通过依赖T细胞和非依赖T细胞2种方式调控sIgA的产生。肠道中的sIgA主要作用为与病原微生物结合发挥抗炎作用,并且还可以阻止病原体在肠道中的黏附失去定植能力,进而维持肠道屏障功能,抵御病原微生物对机体的入侵。当肠道菌群组成发生变化时,可激活炎症信号通路,促进肿瘤坏死因子-α、IL-6等炎症因子的释放(表3)。肠道微生物群,特别是革兰阴性菌,如拟杆菌,被证明能激活肠道树突状细胞(Dendritic cells, DCs),这种细胞诱导肠道黏膜中的浆细胞释放sIgA。微生物群还刺激派尔集合淋巴结中的DCs分泌转化生长因子-β(transforming growth factor-β, TGF-β)和B细胞激活蛋白,从而产生IgA(表3)。嗜酸乳杆菌通过增加活化诱导的胞苷脱氨酶的表达,诱导派伊尔氏斑B细胞分化为IgAB细胞。短链脂肪酸通过刺激巨噬细胞和DCs促进IL-10的分泌。
3.4 肠道微生物及其代谢产物与微生物屏障
动物肠道内存在大量的有益微生物,微生物通过产生细菌素和短链脂肪酸提高肠道屏障能力,微生物也以与病原菌竞争性抑制方式减少有害菌对肠道的侵袭。有益微生物可以为宿主提供营养成分,增强机体黏膜免疫功能。专性厌氧菌在肠道中对肠道屏障起着关键作用,可以竞争性抑制肠道有害菌与肠上皮结合,抑制其定植与生长。Li等(表3)研究发现,乳酸杆菌促进了肠道环氧化酶2(Cyclooxygenase-2, COX2)和一氧化氮合酶(inducible nitric oxide synthase, iNOS)的蛋白表达,表明乳酸杆菌在仔猪的免疫调节作用中起着重要作用。邢帅兵等(表3)研究表明,日粮添加枯草芽孢杆菌可以提高双歧杆菌的数量和抑制致病菌的生长;枯草芽孢杆菌的数量增多消耗了肠道内游离氧,因此促进断奶仔猪肠道厌氧益生菌数量的增多。
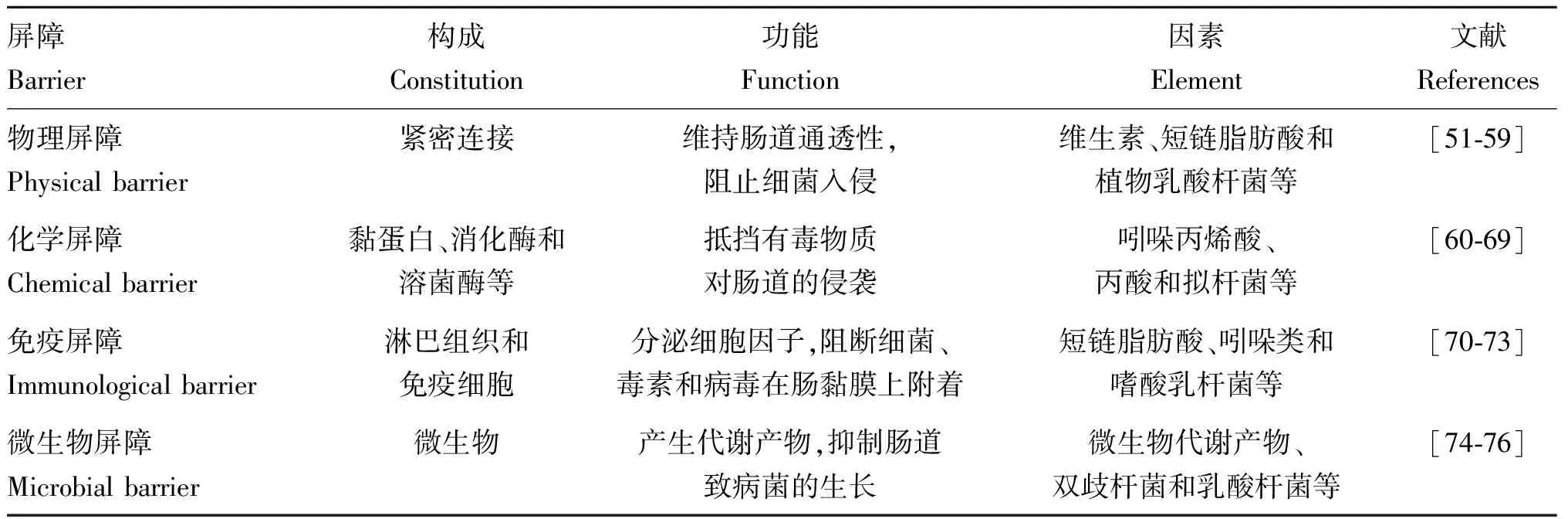
表3 肠道微生物及其代谢产物对肠道屏障的影响
4 结 语
肠道微生物直接影响肠道健康,一旦肠道菌群失调就会造成肠道屏障受损,紧接着就会引起猪一系列炎症的发生,因此,肠道微生物对于猪的健康至关重要。随着禁抗令的实施,猪的健康短期内会受到一定的挑战,尤其初生仔猪肠道形态和免疫系统发育不完善,仔猪容易发生腹泻,严重时威胁生命。所以越来越多的人接受养猪就是养肠道的观点,人们也开始通过调控猪肠道健康来提高猪的健康,西北农林科技大学肌肉生物学与猪遗传改良创新团队研究发现,发酵玉米-豆粕饲料可影响生长肥育猪血清免疫和肠道免疫相关基因的表达。此外,本团队研究发现,在日粮中添加蛹虫草可改善育肥猪肠道的免疫、化学、生物、物理屏障,并探讨了蛹虫草通过抑制TLR4/MyD88/NF-κB信号通路来调节免疫反应(数据未发表)。在日粮中添加枯草芽孢杆菌可提高育肥猪肠道屏障能力,调节肠道微生物(数据未发表)。接下来本团队将探究日粮添加蛹虫草对仔猪肠道健康的影响,以期在预防仔猪腹泻和提高仔猪免疫力方面提供基础。
近年来,通过调节肠道微生物来改善动物肠道健康成为了新的研究热点,其中粪菌移植被应用于畜牧领域,将健康供体粪便中的完整微生物结构植入动物机体内,可以改善动物肠道健康水平,但是粪菌移植技术存在质量和安全性难以控制的问题,这些问题还有待解决;另外,通过噬菌体干预动物肠道菌群结构,促进动物机体肠道形成健康的微生物群落也是肠道研究的热点。随着减抗禁抗政策的实施,研究者主要通过在日粮中添加中草药、益生菌、酶制剂来调控肠道健康以及肠道菌群,从而保护仔猪机体健康并提高生长性能。在未来的研究中可以通过已经明确的机制,靶向治疗肠道炎症或者促进某一种或者多种益生菌的生长,从而增强肠道健康,提高仔猪生长性能。
目前,人们对于肠道微生物的认识还不够全面,对于胎儿期的仔猪肠道是否存在微生物还需要更深层次的探究,肠道微生物调节肠道健康的机制尚不明确,只有更加全面、深入地了解肠道微生物在肠道中的作用机制,才可以通过有效的手段来改善猪的肠道健康,促进其生长。
