纳武利尤单抗二线治疗转移性肾透明细胞癌的成本-效果分析
2022-05-30曹潆丹石丰豪孟蕊陈平钰费正洋张雪珂马爱霞
曹潆丹 石丰豪 孟蕊 陈平钰 费正洋 张雪珂 马爱霞

中图分类号 R956 文献标志码 A 文章编号 1001-0408(2022)10-1233-07
DOI 10.6039/j.issn.1001-0408.2022.10.13
摘 要 目的 评价纳武利尤单抗对比依维莫司二线治疗转移性肾透明细胞癌的经济性。方法 从我国卫生体系角度出发,采用三状态分区生存模型对两种方案进行成本-效果分析,临床参数来自更新后的CheckMate 025研究,成本和健康效用来自相关网站和已发表的文献。模型循环周期为2周,研究时限为患者终生。采用敏感性分析验证研究结果的稳健性;并探讨两种方案在模型模拟时间为80个月和有慈善赠药方案两种情境下的经济性。结果 基础分析结果显示,与依维莫司方案相比,纳武利尤单抗方案的增量成本-效果比(ICER)值为586 982.60元/质量调整生命年(QALY),远高于3倍2020年我国人均国内生产总值(GDP)。单因素敏感性分析结果显示,对经济性评价结果影响较大的3个参数依次为纳武利尤单抗单价、纳武利尤单抗组患者疾病进展状态的效用值和依维莫司組患者疾病进展状态的效用值。概率敏感性分析结果验证了基础分析结果的稳健性。情境分析结果显示,当模型模拟时间为80个月时,纳武利尤单抗方案的ICER值为417 204.52元/QALY;当考虑针对低收入人群的纳武利尤单抗慈善赠药方案时,ICER值为124 988.58元/QALY。结论 在1~3倍2020年我国人均GDP的阈值下,相比于依维莫司方案,纳武利尤单抗方案用于二线治疗转移性肾透明细胞癌不具有经济性;当考虑针对低收入人群的慈善赠药方案时,纳武利尤单抗方案可能是经济的。
关键词 纳武利尤单抗;转移性肾透明细胞癌;依维莫司;分区生存模型;成本-效果分析
Cost-effectiveness analysis of nivolumab in the second-line treatment of metastatic clear cell renal cell carcinoma
CAO Yingdan1,2,SHI Fenghao1,2,MENG Rui1,2,CHEN Pingyu1,2,FEI Zhengyang1,2,ZHANG Xueke1,2,MA Aixia1,2(1. School of International Pharmaceutical Business, China Pharmaceutical University, Nanjing 211198, China; 2. Evaluation and Research Center of Pharmacoeconomics, China Pharmaceutical University, Nanjing 211198, China)
ABSTRACT OBJECTIVE To evaluate the economical efficiency of nivolumab versus everolimus in the second-line treatment of metastatic clear cell renal cell carcinoma. METHODS From the perspective of Chinas health system, cost-effectiveness analysis of the two therapies was carried out by developing a three-state partitioned survival model. The clinical parameters were from the updated CheckMate 025 study, and the cost and health utility were from relevant websites and published literatures. The model adopted a 2-week cycle and a lifetime research time. The robustness of the results was verified by sensitivity analysis. The economical efficiency of two therapy schemes were evaluated in the scenario of model simulation time of 80 months and charitable drug donation scheme. RESULTS The results of basic analysis showed that compared with everolimus, the incremental cost-effectiveness ratio (ICER) of nivolumab was 586 982.60 yuan/quality-adjusted life year (QALY), which was far higher than 3 times of Chinas per capita gross domestic product (GDP) in 2020. The results of single-factor sensitivity analysis showed that the 3 parameters that had the greatest impact on the economic evaluation results were the cost of nivolumab, the utility value of nivolumab group and everolimus group in progressive disease state. The results of probability sensitivity analysis verified the robustness of the basic analysis results. Results of scenario analysis showed that in the first scenario analysis, in which model simulation time lasted for 80 months, ICER of nivolumab was 417 204.52 yuan/QALY; in the second scenario analysis, in which nivolumab charitable drug donation program for low-income people was considered, ICER of nivolumab was 124 988.58 yuan/QALY. CONCLUSIONS Under the threshold of 1-3 times of Chinas per capita GDP in 2020, compared with everolimus, it is not economical to use nivolumab as the second-line treatment for metastatic clear cell renal cell carcinoma; nivolumab is economical when considering its charitable drug donation program for low-income people.
KEYWORDS nivolumab; metastatic clear cell renal cell carcinoma; everolimus; partitioned survival model; cost-effectiveness analysis
肾细胞癌(renal cell carcinoma,RCC)是泌尿系统常见的恶性肿瘤之一,占肾脏恶性肿瘤的80%以上[1],占成人恶性肿瘤的2%~3%[2]。多数肾癌患者在确诊时为局限性肾癌,有20%~30%的肾癌患者在确诊时为转移性肾癌(metastatic renal cell carcinoma,mRCC)[3],另有20%~40%的局限性肾癌患者会在术后进展为mRCC[4]。肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是較常见的一种肾癌病理类型,约占RCC的80%[5]。目前,转移性肾透明细胞癌(metastatic clear cell renal cell carcinoma,mccRCC)的治疗主要以靶向治疗为主,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)通路抑制剂和哺乳动物雷帕霉素靶蛋白抑制剂(mammalian target of rapamycin inhibitors,mTORi)[6]。靶向治疗药物的出现,显著延长了患者的无进展生存期(progression free survival,PFS)[7],但大部分患者会因无法耐受而中断治疗[8]。以程序性死亡蛋白1(programmed death-1,PD-1)抑制剂/程序性死亡蛋白配体1(programmed death ligand-1,PD-L1)抑制剂为代表的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的出现,为mccRCC患者提供了新的治疗选择。
纳武利尤单抗是首个被美国食品药品监督管理局(U.S. Food and Drug Administration,FDA)批准用于mRCC二线治疗的PD-1抑制剂,其可抑制T细胞表面的PD-1与肿瘤细胞表面的PD-L1结合,干扰PD-1介导的免疫抑制反应,从而重新激活T细胞对肿瘤细胞的免疫应答[9-10]。一项针对先前接受过1~2种抗血管生成疗法的晚期ccRCC患者的Ⅲ期临床随机对照试验(CheckMate 025研究)结果显示,在30个月的随访时间内,相较于依维莫司组,纳武利尤单抗组患者的中位总生存期(median overall survival,mOS)获益为5.4个月[25.0个月vs. 19.6个月,风险比(hazard ratio,HR)=0.73,95%置信区间(confidence interval,CI)(0.57,0.93),P=0.002],3级或4级不良事件(adverse effects,AEs)的发生率也更低(19% vs. 37%)[11]。2020年,CheckMate 025研究公布了患者随访至80个月的生存数据,结果显示,纳武利尤单抗组患者的mOS为25.8个月,而依维莫司组患者仅为19.7个月,差异有统计学意义(P<0.000 1)[12]。根据《中国临床肿瘤学会(CSCO)肾癌诊疗指南2020》,对于酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)治疗失败的mccRCC患者,二线治疗的Ⅰ级推荐药物为阿昔替尼、纳武利尤单抗、卡博替尼等[13]。纳武利尤单抗虽具有良好的疗效和安全性,但在我国的价格较高,因此其为mccRCC患者带来的生存获益与花费的成本是否具有经济性成为值得探讨的问题。基于此,本研究从我国卫生体系角度出发,基于更新后的CheckMate 025研究的生存数据和安全性数据[12]建立分区生存(partitioned survival,PartSA)模型,对纳武利尤单抗用于mccRCC的经济性进行评价,以期为我国医保准入和临床用药决策提供依据。
1 资料与方法
1.1 目标人群
本研究的目标人群与CheckMate 025研究[12]一致,即符合该研究的纳入、排除标准,且先前接受过1~2种抗血管生成疗法的mRCC成年患者(经组织学确诊大多数为mccRCC)。CheckMate 025研究共纳入821例患者,包括纳武利尤单抗组410例、依维莫司组411例。
1.2 干预措施
两组患者分别给予纳武利尤单抗和依维莫司单药治疗:纳武利尤单抗组患者给予纳武利尤单抗注射液3 mg/kg,每2周1次,静脉滴注;依维莫司组患者给予依维莫司片10 mg/次,每天1次,口服。两组患者均持续治疗直至疾病进展(progressive disease,PD)或发生了不可耐受的AEs。
根据CheckMate 025研究,纳武利尤单抗组有67.3%的患者在进展至PD或发生不可耐受的AEs后接受了后续治疗,治疗药物包括依维莫司(34.9%)、阿昔替尼(33.4%)、卡博替尼(14.1%)和培唑帕尼(12.2%);依维莫司组有72.0%的患者接受了后续治疗,治疗药物包括阿昔替尼(41.1%)、纳武利尤单抗(26.0%)、培唑帕尼(19.0%)、索拉非尼(10.9%)和舒尼替尼(11.2%)[12]。
1.3 模型构建
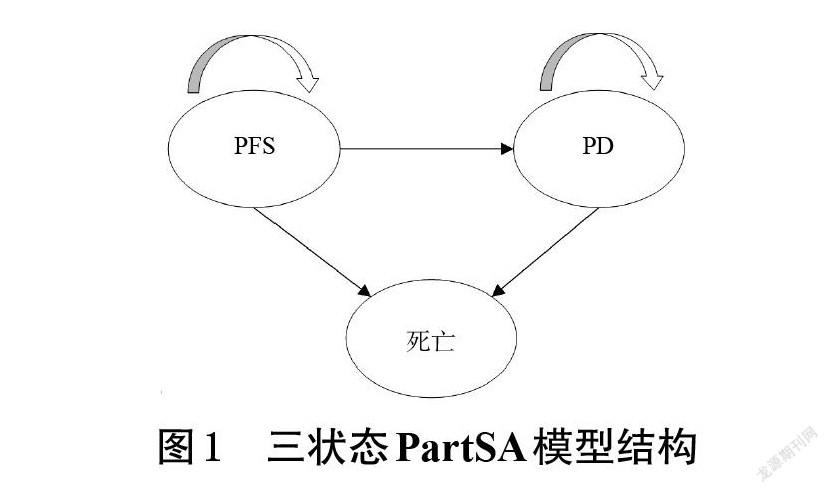
1.3.1 PartSA模型 本研究基于我国卫生体系角度,使用Excel 2016软件构建PartSA模型来模拟疾病治疗的成本和产出。疾病转归过程包括PFS、PD、死亡3个状态,模型结构详见图1。根据CheckMate 025研究的给药周期,本研究将模型的循环周期设定为2周,研究时限为患者终生[12]。根据《中国药物经济学评价指南(2020)》(以下简称“指南”),成本和效用均采用5%的贴现率[14]。
1.3.2 生存分析 使用GetData Graph Digitizer 2.24软件在CheckMate 025研究的生存曲线[又称Kaplan-Meier(KM)曲线]上取点,以获取试验期内每个循环周期节点的总体生存率及无进展生存率。对于三状态PartSA模型,可用PFS和OS曲线直接估算处于各种健康状态下的患者比例。PFS状态下的患者比例可以直接由PFS曲线得出,PD状态下的患者比例可通过计算每个时间点OS曲线与PFS曲线的生存率之差得到,死亡状态的患者比例为1减去OS曲线上相应时间点的生存率[15]。使用多重参数分布在临床试验观察期外进行外推,即假设患者生存时间服从某一特定的参数分布,包括Exponential分布、Gompertz分布、Weibull分布、Log-logistic分布、Log-normal分布和Gengamma分布,再通过赤池信息准则(Akaike information criterion,AIC)、贝叶斯信息准则(Bayesian information criterion,BIC)以及视觉检验法评估最优拟合分布,拟合结果见表1~表3。考虑到CheckMate 025研究中患者基线年龄的中位值为62岁[12],加之肾癌患者的发病年龄普遍较高[16],因此本研究在长期生存模拟中使用2020年中国人群的自然死亡率对OS曲线拟合外推进行了校正[17]。最终,纳武利尤单抗组PFS和OS曲线的拟合外推选取Log-normal分布,依维莫司组PFS和OS曲线拟合外推分别选取Log-normal分布和Log-logistic分布。拟合外推曲线如图2、图3所示。
1.3.3 成本 由于本研究采用的是我国卫生体系角度,根据指南,成本测算应纳入卫生体系内的所有直接医疗成本[14]。结合我国医疗情况,本研究目标人群在门诊、随访及住院过程中的成本项目应包括治疗方案成本、后续治疗成本、疾病管理成本、随访检测成本以及AEs管理成本。
纳武利尤单抗和依维莫司价格采用米内网(http://menet.com.cn)2020年跨库招标价格。纳武利尤单抗注射液(规格:100 mg/10 mL)的价格为每瓶9 250元,依维莫司片(规格:5 mg×30片/盒)的价格为每盒4 306.8元。中国人群人均体质量按照《中国居民营养与慢性病状况报告(2020年)》公布的中国男性和女性人均体质量经男女比例校正而得,为64.44 kg[18]。根据用药方案和平均体质量计算得,纳武利尤单抗每周期(2周)用药成本为18 500元,依维莫司每周期用药成本为4 306.8元。后续治疗药物阿昔替尼、培唑帕尼、索拉非尼、舒尼替尼的药品成本均来自米内网跨库招标价格。由于卡博替尼尚未在我国上市,其用药成本来自于已发表文献[19]。
疾病管理成本包括挂号诊断费、静脉输液费和患者住院治疗时所产生的相应护理费和床位费。参考相关文献[6],假设纳武利尤单抗组和依维莫司组患者PFS期每周期住院天数均为1 d,PD期每周期住院天数均为2 d。
根据CheckMate 025研究,随访检测成本包括计算机断层扫描(computed tomography,CT)、血生化、血常规和甲状腺激素检查等[12]。上述检查在患者PFS期第1年里每8周进行1次,之后每12周进行1次;PD期每12周进行1次。本研究的随访检测成本为北京、上海、吉林、江苏、浙江等12个省市医疗保障局或卫生健康委官方网站等公布的医疗服务价格的中位值。
本研究仅考虑CheckMate 025研究中3级及以上、且发生率为2%及以上的AEs,包括疲劳、贫血、高甘油三酯血症、口角炎、高血糖等[12]。各项AEs的管理成本均来自于已发表的文献[6,20]。
各项成本参数及取值范围详见表4。
1.3.4 健康效用 本研究所采用的健康效用值均来自于已发表的文献,纳武利尤单抗组患者PFS状态的效用值为0.848,PD状态的效用值为0.680;依维莫司组患者PFS状态的效用值为0.752,PD状态的效用值为0.680[21-22]。由于上述效用值已经包含了治疗相关的AEs,因此本研究在对效用值进行模拟时,未再考虑患者因AEs发生而导致的效用降低(即负效用值)。模型参数及其取值范围见表4。
1.4 敏感性分析
由于纳入模型的各项参数可能存在一定的波动,模拟出的结果有可能发生变化,甚至会出现相反的结论,因此有必要对模型进行不确定性分析,即敏感性分析。参考指南推荐方法,使用1~3倍我国人均国内生产总值(gross domestic product,GDP)作为判断经济性的意愿支付(willingness to pay,WTP)阈值,具体标准为:当增量成本-效果比(incremental cost-effectiveness ratio,ICER)低于1~3倍我国人均GDP时,表示方案具有经济性[14]。根据国家统计局网站数据,1~3倍2020年我国人均GDP为72 447~217 341元。
1.4.1 单因素敏感性分析 为确定不同因素对研究结果的影响程度,判定基础分析结果的稳定性和可承受的变量变化临界值,本研究分别对各治疗方案成本、后续治疗成本、随访检测成本和疾病管理成本中各个项目的单次成本、各AEs的发生率及处理成本、PFS和PD状态下的效用值、贴现率等进行了单因素敏感性分析,即每次只改变某一变量的取值而其他变量保持不变。在保持其他参数不变的情况下,模型中关键参数的变化范围如下:对于能够获取上下限的参数,如随访检测成本和疾病管理成本中各个项目的单次成本,上下限分别为12个省市医疗服务价格的最大值和最小值;對于不能获取上下限的参数,假设其围绕基线值变化±20%;考虑到国内PD-1抑制剂价格降幅比较大,假设纳武利尤单抗的价格变动范围为基线值的40%~100%,依维莫司的价格变动范围为基线值的80%~100%。根据指南,贴现率浮动范围为0~8%[14]。具体见表4。
1.4.2 概率敏感性分析 本研究假设AEs发生率、效用值等参数服从Beta分布,成本参数服从Gamma分布,采用二阶蒙特卡洛模拟进行概率敏感性分析,具体参数浮动范围及分布见表4。根据模拟结果使用Excel 2016软件绘制成本-效果可接受曲线(cost-effectiveness accep- tability curve,CEAC),分析在不同WTP下每种治疗方案具有经济性的概率。
1.5 情境分析
情境1如下:使用原始KM曲线,探讨在临床试验观察期内两种治疗方案的经济性。
情境2如下:由于纳武利尤单抗在国内获批的所有适应证(肺癌、胃癌、头颈鳞癌、胸膜间皮瘤)都有援助赠药政策,考虑到该药今后获批肾癌适应证的可能和药品成本将对经济性评价结果产生潜在影响,本研究又探讨了在纳武利尤单抗慈善赠药情况下两种治疗方案的经济性。目前,纳武利尤单抗针对低收入患者的赠药方案为年度“3+3,后续3+X”,即针对接受纳武利尤单抗“3 mg/kg,每2周1次”方案治疗的患者,可在1个申请年度内分两阶段接受援助:第1阶段自费治疗3次,获得免费药品援助3次;完成第1阶段的患者,若仍需接受纳武利尤单抗治疗,可在再次连续接受自费治疗3次后,获得该申请年度内剩余的药品援助,即患者在1个申请年度内最多自付6次。符合赠药标准的患者,可按申请年度重复发起援助申请,直至项目终止或进展至PD。在情境2的分析中,假设本研究所有患者均满足纳武利尤单抗的慈善赠药条件。
2 结果
2.1 基础分析结果
两种治疗方案的基础分析结果见表5。由表5可见,相比依维莫司,纳武利尤单抗能为患者多带来0.561 4质量调整生命年(quality-adjusted life years,QALYs),但同时成本也增加了329 555.11元,ICER值为586 982.60元/QALY,高于3倍2020年我国人均GDP,因此纳武利尤单抗方案不具有经济性。
2.2 敏感性分析结果
2.2.1 单因素敏感性分析结果 单因素敏感性分析结果见图4。由图4可见,当模型参数在一定范围内变化时,对模型结果影响最大的参数为纳武利尤单抗单价,且ICER值随着纳武利尤单抗单价的降低而降低。同时,经济性评价结果对于两组患者PD状态的效用值也较为敏感:ICER值与依维莫司组PD状态的效用值同向变动,与纳武利尤单抗组PD状态的效用值反向变动。除此之外,其他参数对于结果的影响较小。
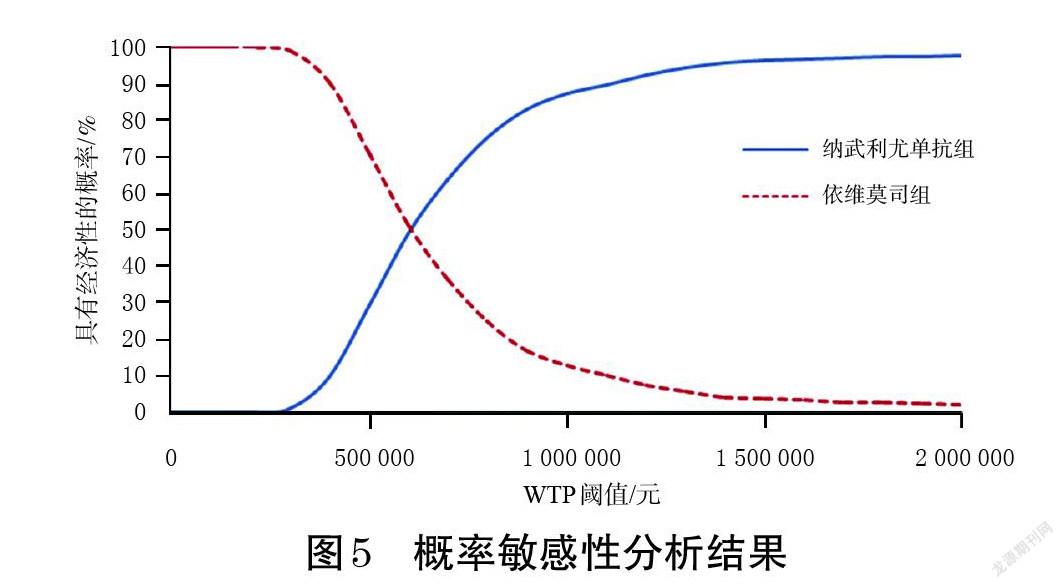
2.2.2 概率敏感性分析结果 概率敏感性分析结果详见图5。由图5可见,当WTP在1~3倍2020年我国人均GDP(72 447~217 341元/QALY)区间内时,纳武利尤单抗方案具有经济性的概率为0,依维莫司方案具有经济性的概率为100%;当WTP超过300 000元/QALY时,纳武利尤单抗才可能具有经济性(概率>0)。整体来看,纳武利尤单抗方案基本不具经济性,这也验证了上述基础分析结果的稳健性。
2.3 情境分析
2.3.1 情境1 当模型模拟时间为80个月且与原始临床试验KM曲线一致时,纳武利尤单抗方案较依维莫司方案能为患者多带来0.381 7 QALYs,但同时成本也增加了159 244.78元,ICER值为417 204.52元/QALY,仍高于1~3倍2020年我国人均GDP,说明纳武利尤单抗仍不具有经济性。情境1的成本-效果分析结果见表6。
2.3.2 情境2 当考虑针对低收入人群的纳武利尤单抗慈善赠药方案时,患者所花费的成本降低幅度较大,纳武利尤单抗方案的成本比依维莫司方案高70 173.50元,ICER值为124 988.58元/QALY,此时纳武利尤单抗方案在2倍2020年我国人均GDP的阈值下是经济的。情境2成本-效果分析结果见表7。
3 讨论
Wan等[6]基于CheckMate 025研究构建了PartSA模型,从美国医保支付方角度及中國卫生体系角度评价了纳武利尤单抗作为mRCC二线治疗方案的经济性。结果显示,当纳武利尤单抗在中国的价格为9.02 美元/mg和10.58 美元/mg时,纳武利尤单抗较依维莫司的ICER值分别为22 595 美元/QALY和48 556 美元/QALY,提示该药在22 785 美元/QALY和48 838美元/QALY的阈值下是经济的。但该研究的数据来源为随访时长仅为30个月的CheckMate 025研究,彼时该研究的患者安全性数据仍不够成熟。另外,该研究所有的生存外推拟合曲线均采用了Weibull分布,并非基于AIC、BIC值选择的最优拟合分布。而本研究经分析发现,所得4条生存外推曲线最优拟合分布均不是Weibull分布。由于分布方法的不同可能会使研究结果出现一定偏差,因此本研究基于更新后的随访时间为80个月的CheckMate 025研究,从我国卫生体系角度出发,重新构建三状态PartSA模型,评价了纳武利尤单抗二线治疗mccRCC患者的经济性。结果显示,虽然纳武利尤单抗方案在临床上具有一定疗效,健康产出高于依维莫司方案,但其成本也高,其较依维莫司方案的ICER值为586 982.60元/QALY,远超3倍2020年我国人均GDP,可见其经济性远不如依维莫司方案。单因素敏感性分析结果显示,纳武利尤单抗单价是对经济性评价结果影响最大的参数。通过情境分析可以发现,当考虑到纳武利尤单抗的慈善赠药方案时,药品成本大大降低,这时纳武利尤单抗方案在我国是经济的。
本研究有以下几项局限性:第一,由于缺乏我国mccRCC患者使用纳武利尤单抗和依维莫司的“头对头”临床研究证据,故本研究模型中使用的临床试验样本数据来自国外患者,而模型中的成本参数采用的是国内数据。由于关于我国mccRCC患者特定治疗方案的效用值仍未见公开报道,故本研究效用值数据也来自国外患者。单因素敏感性分析显示,两组患者PD状态的效用值是经济性评价结果的主要影响因素之一,故上述数据的选择将可能对模型结果产生一定影响。第二,由于CheckMate 025研究相关数据随访至80个月,而本研究通过参数分布拟合将临床试验数据外推到30年,以获得试验期以外的生存数据,外推过程可能增加了结果的不确定性,有待更长随访期的研究以及真实世界数据来验证。第三,单因素敏感性分析结果显示,后续治疗成本对结果有一定影响,本研究模型中后续治疗方案和患者比例亦来自CheckMate 025研究,可能与我国临床用药实际有所差异,这也增加了研究结果的不确定性。第四,本研究从卫生体系角度出发,仅考虑了患者的直接医疗成本,并未考虑患者因疾病状态或者死亡导致的劳动力损失。若从全社会角度考虑,纳武利尤单抗方案可延长患者生存期,提高其生存质量,将有助于减少劳动力损失及家属陪护的间接成本,其经济性可能将进一步提高。
综上所述,基于我国卫生体系角度,在1~3倍2020年我国人均GDP这一WTP阈值下,相比依维莫司方案,纳武利尤单抗方案用于二线治疗mccRCC不具有经济性;当考虑了针对低收入人群的纳武利尤单抗慈善赠药方案时,该方案可能是经济的。
参考文献
[ 1 ] CHOW W H,DONG L M,DEVESA S S. Epidemiology and risk factors for kidney cancer[J]. Nat Rev Urol,2010,7(5):245-257.
[ 2 ] ROSS K,JONES R J. Immune checkpoint inhibitors in renal cell carcinoma[J]. Clin Sci (Lond),2017,131(21):2627-2642.
[ 3 ] 李虹,曾浩,李响,等.靶向分子时代转移性肾癌治疗进展与治疗方案的合理化选择[J].现代泌尿外科杂志,2010,15(5):321-328.
[ 4 ] JANZEN N K,KIM H L,FIGLIN R A,et al. Surveillance after radical or partial nephrectomy for localized renal cell carcinoma and management of recurrent disease[J]. Urol Clin North Am,2003,30(4):843-852.
[ 5 ] DONG D,MU Z Y,WEI N,et al. Long non-coding RNA ZFAS1 promotes proliferation and metastasis of clear cell renal cell carcinoma via targeting miR-10a/SKA1 pathway[J]. Biomedecine Pharmacother,2019,111:917-925.
[ 6 ] WAN X M,PENG L B,MA J A,et al. Economic evaluation of nivolumab as a second-line treatment for advanced renal cell carcinoma from US and Chinese perspectives[J]. Cancer,2017,123(14):2634-2641.
[ 7 ] ZARRABI K,FANG C H,WU S H. New treatment options for metastatic renal cell carcinoma with prior anti-angiogenesis therapy[J]. J Hematol Oncol,2017,10(1):38.
[ 8 ] 熊斌,鲁伟.转移性肾癌治疗的现状和进展[J].中华泌尿外科杂志,2021,42(4):308-311.
[ 9 ] BRAHMER J R,DRAKE C G,WOLLNER I,et al. Phase Ⅰ study of single-agent anti-programmed death-1 (MDX- 1106) in refractory solid tumors:safety,clinical activity,pharmacodynamics,and immunologic correlates[J]. J Clin Oncol,2010,28(19):3167-3175.
[10] IWAI Y,ISHIDA M,TANAKA Y,et al. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade[J]. Proc Natl Acad Sci U S A,2002,99(19):12293-12297.
[11] MOTZER R J,ESCUDIER B,MCDERMOTT D F,et al. Nivolumab versus everolimus in advanced renal-cell carcinoma[J]. N Engl J Med,2015,373(19):1803-1813.
[12] MOTZER R J,ESCUDIER B,GEORGE S,et al. Ni- volumab versus everolimus in patients with advanced renal cell carcinoma:updated results with long-term follow-up of the randomized,open-label,phase 3 CheckMate 025 trial[J]. Cancer,2020,126(18):4156-4167.
[13] 中國临床肿瘤学会指南工作委员会.中国临床肿瘤学会(CSCO)肾癌诊疗指南2020[S].北京:人民卫生出版社,2020:60-64.
[14] 刘国恩.中国药物经济学评价指南:2020[S].北京:中国市场出版社,2020:4-5,19,27-28.
[15] 邵荣杰,唐文熙,马爱霞.分区生存模型在药物经济学评价中的应用[J].中国卫生经济,2019,38(9):60-63.
[16] CAPITANIO U,BENSALAH K,BEX A,et al. Epidemio- logy of renal cell carcinoma[J]. Eur Urol,2019,75(1):74-84.
[17] 国家统计局人口和就业统计司.中国人口和就业统计年鉴[M].北京:中国统计出版社,2021:12.
[18] 刘月姣. 《中国居民营养与慢性病状况报告(2020年)》发布[J].中国食物与营养,2020,26(12):2.
[19] LIAO W T,HUANG J X,HUTTON D,et al. Cost-effectiveness analysis of cabozantinib as second-line therapy in advanced hepatocellular carcinoma[J]. Liver Int,2019,39(12):2408-2416.
[20] 王藝茸,李瑜,李琳琳,等.依维莫司联合依西美坦用于晚期乳腺癌的药物经济学评价[J].中国新药杂志,2018,27(12):1437-1442.
[21] CELLA D,GR?NWALD V,NATHAN P,et al. Quality of life in patients with advanced renal cell carcinoma given nivolumab versus everolimus in CheckMate 025:a randomised,open-label,phase 3 trial[J]. Lancet Oncol,2016,17(7):994-1003.
[22] THOMPSON COON J,HOYLE M,GREEN C,et al. Be- vacizumab,sorafenib tosylate,sunitinib and temsirolimus for renal cell carcinoma:a systematic review and econo- mic evaluation[J]. Health Technol Assess,2010,14(2):1-184,Ⅲ-Ⅳ.
(收稿日期:2021-10-14 修回日期:2022-03-24)
(编辑:孙 冰)