‘摩尔多瓦’葡萄MYB4b基因克隆鉴定及表达分析
2022-05-29孙洋王超霞田淑芬刘丹罗盼王荣
孙洋,王超霞,田淑芬*,刘丹,罗盼,王荣
(1. 天津农学院园艺园林学院,天津 300384;2. 天津市尖峰天然产物研究开发有限公司,天津 300192)
花色苷是苯丙烷代谢途径的主要物质,是自然界广泛存在的类黄酮物质[1]。葡萄种植和酿酒加工过程中会产生大量枝条和果皮残渣,其中仍含有丰富的花色苷,可用于一些高附加值保健食品的开发,具有广泛的应用前景[2]。
MYB转录因子在葡萄花色苷的合成过程中起着决定性作用。根据葡萄基因组信息,预测有279个MYB转录因子[3],从PlantTFDB上查询到葡萄R2R3类MYB转录因子约有190个。根据蛋白质羧基端DNA结合区保守氨基酸的基序,这些R2R3类MYB转录因子可分为28个亚类,广泛参与植物初生及次生代谢、细胞分化、激素信号传导、生长发育调控、生物及非生物逆境响应等生命过程[4]。其中MYBAl和MYBA2这两个位于2号染色体上的基因位点对葡萄的颜色起决定性影响。它们形成一个高度交联的基因簇,长度约为200 kb,通过调控UFGT基因的表达来实现对花色苷合成的作用[5-7]。在各种葡萄品种中,MYBAl基因位点的基因型主要包括VvmybAla、VvmybAlb和VvmybAl等位基因。在葡萄发育过程中,将逆转录转座子Gretl(Retrotransposon 1)插入VvmybAl编码序列的上游启动子区域会导致花色苷相关基因的表达受到抑制,从而使葡萄皮无法合成花青素,所以会出现绿色葡萄果实[7-9]。VvmybAlb和VvmybAl具有通过调节UFGT的表达而促进花色苷合成的功能[10]。本课题组前期研究发现,花色苷合成相关基因的启动子序列上存在MYB4结合的顺式作用元件,据此推测,MYB4b作为MYB家族的成员之一,可能参与调控果实花色苷的合成。
‘摩尔多瓦’(Moldova)葡萄于1997年从罗马尼亚引入,原产地为摩尔多瓦共和国。该品种为欧美杂交种,果实着色力强,能有效抵抗霜霉病的侵染,对天气的包容度极高。天津地区的气候特点是季节气候变化明显,干旱多风,土壤盐渍化程度高,因此,‘摩尔多瓦’葡萄适合在天津种植。为了解‘摩尔多瓦’葡萄MYB4b转录因子的相关生物学功能,提高其利用效率,试验利用PCR技术克隆获得MYB4b转录因子的基因序列,并对其进行生物信息分析与预测,采用荧光定量PCR方法检测MYB4b基因在‘摩尔多瓦’不同组织部位和不同农艺技术处理下的转录表达水平,同时检测了相应的花色苷含量,为研究其在葡萄生理胁迫过程中所作出的调控应答奠定基础。
1 材料与方法
1.1 植物材料与处理
试验于2021年8月5日至2021年12月25日在天津市武清区金锅农业生态园进行。‘摩尔多瓦’葡萄为多年生自根苗,棚架栽培,定植株距1.0 m,行距3.0 m,棚架高4 m。每株葡萄结果主蔓1个,每果枝保留1穗果,整株保持40穗。
采集了花前7 d(7 dbf)、花期(0 daf)和花后7 d(7 daf)的花序、茎尖、幼茎、老茎、新叶、老叶、幼卷须、老卷须,以及不同发育时期的果实:幼果期(开花后14 d)、转色期(开花后56 d)及成熟期(开花后126 d)。采集‘摩尔多瓦’转色期的果实进行无菌水(CK)、0.3% NaCl、60 g·L-1PEG6000、40 mg·L-1碧护、500 mg·L-1壳聚糖共计5个浸泡处理,取处理0、3、6、12、24 h,2、4、6、8 d(10个时间点)的样品进行检测,3次重复。样品采集后存于液氮,用于RNA提取。
1.2 总DNA提取及目标基因克隆
用TaKaRa MiniBEST Plant Genomic DNA Extraction Kit试剂盒(9768,TaKaRa)提取葡萄叶片总DNA,具体提取方法参照试剂盒说明书。
在NCBI中获得MYB4b的全长序列,并采用Primer 5软件设计引物(表1)。PCR扩增目标基因,回收纯化特异性扩增产区与天根的pGM-T载体连接并转化大肠杆菌感受态细胞,蓝白斑筛选后将阳性菌液送生工生物工程股份有限公司进行测序。

表1 本文所采用的引物信息Table 1 Primer information used in this paper
1.3 生物信息学分析
采用ProtParam预测蛋白理化性质;SignalP 4.1 Server预测信号肽;ProtScale预测亲水性/疏水性;TMHMM-2.0 Server预测跨膜区;NCBI的CDD(Conserved Domain Database)预测功能结构域;SOPMA预测蛋白质二级结构及三级结构;Psort和Cell-PLoc 2.0进行亚细胞定位;MEGA 5.1进行氨基酸序列多重比对和系统进化树分析。
1.4 总RNA提取及实时荧光定量PCR
用HiPure Plant RNA mini Kit试剂盒(R4151-02,Magen)提取成熟叶、幼嫩叶、幼茎、老茎、幼卷须、老卷须、茎尖,以及各个阶段的花序和果实总RNA,反转录后得到cDNA。按照SuperReal PreMix Plus(SYBR Green)的操作指导,在Illumina-Eco荧光定量PCR仪(美国ABI)上测定基因的表达量。
以延伸因子EF-1α为内参基因进行荧光定量PCR,采用Primer5软件设计相关引物(表1)。10 μL反应体系:2×SuperReal PreMix Plus 5 μL、上下游引物(10 mmol)各0.3 μL、cDNA模板1 μL和RNase-free水3.4 μL。反应条件:98 ℃ 10 s,58 ℃ 30 s,72 ℃ 1 min,40个循环;最后进行溶解曲线测定。荧光定量结果通过相对定量法(2-△△t)进行分析,采用Excel软件绘图。
1.5 总花色苷含量测定
总花色苷含量用盐酸甲醇法测定,具体方法参照洪燕红的试验方法[11]。
2 结果与分析
2.1 MYB4b基因克隆与序列分析
用TaKaRa MiniBEST Plant Genomic DNA Extraction Kit试剂盒(9768,TaKaRa)提取葡萄叶片总DNA凝胶电泳结果显示提取的DNA条带清晰完整(图1左),Nanodrop 2000微量紫外分光光度计检测结果得到所提DNA的浓度为324.54 μg·μL-1,OD260/280的比值为1.84。结果表明所提的基因组DNA浓度和纯度满足后续试验的要求。
从电泳图(图1中)中可以看出,PCR扩增得到大小不同的多个片段。根据DNA marker的位置和预期目标产物的大小,将700~1000 bp大小的电泳条带均进行切胶回收。根据TA克隆载体的重组原理,蓝白斑筛选结果显示(图1右),蓝色菌落中不含目的片段,白色菌落可能含有目的片段。

图1 ‘摩尔多瓦’葡萄基因组DNA(左)和PCR产物(中)电泳图及蓝白斑筛选图(右)Figure 1 Electrophoresis of genomic DNA (left) and PCR products (middle) and blue and white spot screening map (right) of 'Moldova'
Sanger测序结果分析表明,PCR克隆得到的片段即为MYB4b基因序列,该基因含有2个外显子,1个内含子,转录的mRNA序列总长为729 bp,共编码242个氨基酸,单链分子量为27 311.04 (表2)。
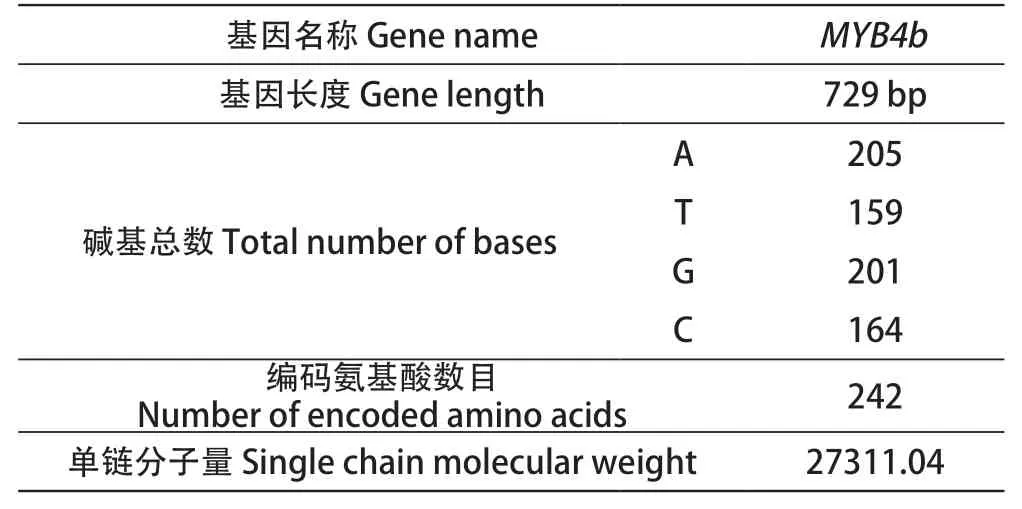
表2 MYB4b基因序列分析Table 2 Sequence analysis of MYB4b gene
2.2 生物信息学分析
利用ProtParam在线软件预测一级结构和理化性质,MYB4b蛋白分子式为C1178H1880N360O357S16,原子总数为3791,分子量为27311.04。理论等电点pI为8.47,为碱性蛋白。氨基酸组成Leu最多,占11.2%;Gln最少,占0.4%;未出现Pyl、Sec。带正电荷氨基酸残基总数(Asp+Glu)为33,带负电荷氨基酸残基总数(Arg+Lys)为37。脂溶系数为73.35,总平均疏水系数为-0.705,属于疏水性蛋白。半衰期为30 h,不稳定系数55.60,根据不稳定参数值在40以下才是稳定蛋白的标准,可推测MYB4b翻译出来的蛋白为不稳定蛋白。
使用NCBI的Conserved Domain Database数据库对所获得的‘摩尔多瓦’葡萄MYB4b蛋白的氨基酸序列进行保守结构域分析(图2)。结果表明,MYB4b蛋白在第1~131个氨基酸之间含有一个PLN03091功能结构域,该结构为转录阻遏型因子MYB5的保守结构域,E-value为6.1e-73,且PLN03091是超家族cl33633的唯一成员。

图2 MYB4b蛋白保守结构域预测分析Figure 2 Prediction and analysis of conserved domain ofMYB4bprotein
使用在线软件预测‘摩尔多瓦’葡萄MYB4b蛋白的二级和三级结构(图3)。MYB4b蛋白的二级结构中,主要是有123个氨基酸位点形成无规则卷曲,占比达到了50.83%;其次为80个氨基酸位点形成的α-螺旋占比达到33.06%,24个氨基酸位点形成的β-折叠占比达到9.92%,15个氨基酸位点的β-转角占比达到6.20%。MYB4b蛋白的三级结构与二级结构特点相吻合,为螺旋-折叠-无规则卷曲。

图3 MYB4b蛋白二级结构(左)和三级结构(右)预测Figure 3 Secondary (left) and three-level (right) structures prediction of MYB4b protein
2.3 MYB4b蛋白系统进化分析
采用在线软件ProtScale对‘摩尔多瓦’葡萄MYB4b蛋白氨基酸序列进行亲水性/疏水性预测。由图4可知,MYB4b蛋白在多肽链第162位氨基酸最低分值为-3.144,疏水性最强;而在蛋白多肽链第200位氨基酸亲水性分值最高,为1.856,疏水性最弱。总体而言,MYB4b蛋白氨基酸序列亲水氨基酸分布较均匀,且亲水氨基酸数量多与疏水氨基酸,总体平均疏水系数为-0.705。因此推测MYB4b蛋白为亲水蛋白。
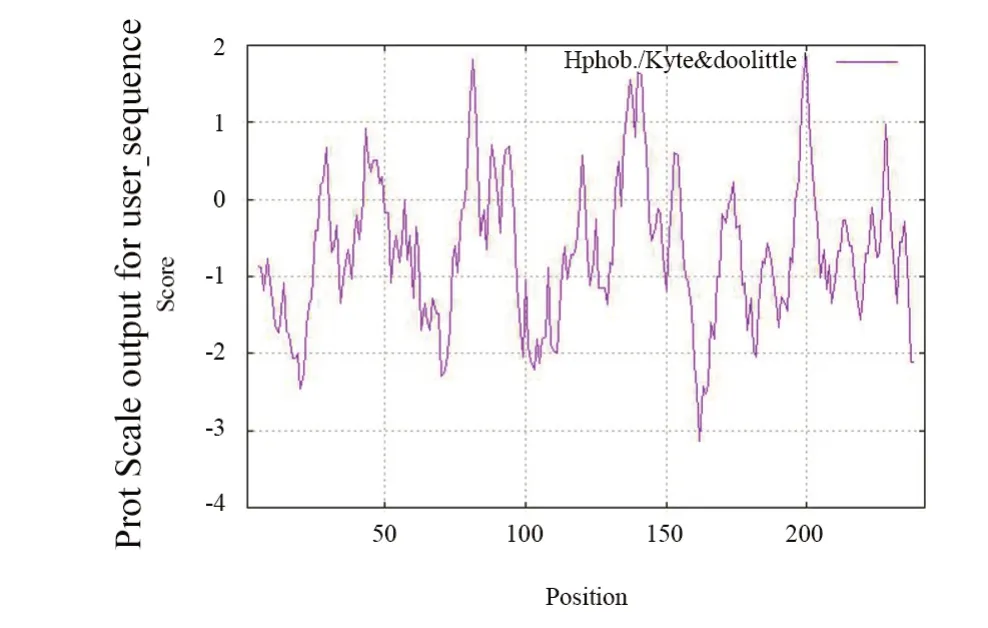
图4 MYB4b蛋白亲水性/疏水性预测Figure 4 Prediction of hydrophobicity/hydrophobicity of MYB4b protein
系统发育进化分析结果表明(图5),目的基因MYB4b与刺葡萄(Vitis davidii)的MYB相关蛋白308的编码基因和河岸葡萄(Vitis riparia)的MYB4a转录因子同源性最高,表明两者亲缘关系较近。与其他物种的MYB序列聚类分析发现,葡萄MYB4b与拟南芥的同源关系较近,反而与葡萄的其他转录因子,如MYB14、MYB15的亲缘进化关系相对较远。此外,对葡萄不同MYB转录因子进行聚类分析发现,相比对VvMYB24、VvMYB44、VvAPL来讲,MYB4b与MYB14、MYB15的同源性相对较高,但处在不同分支。由此推测在葡萄进化过程中,MYB4b、MYB14/15和VvMYB24/44,可能来自不同的进化途径,属于不同的R2R3-MYB亚型。

图5 MYB转录因子系统进化树Figure 5 Phylogenetic tree of MYB transcription factors
2.4 不同组织MYB4b基因的表达模式及花色苷分布
如图6所示,在‘摩尔多瓦’葡萄不同时期的花序、茎尖、幼茎、老茎、新叶、老叶、幼卷须、老卷须,以及不同时期的葡萄果实(幼果期、转色期及成熟期)中均检测到MYB4b基因的表达,但在各组织中的表达量不同。其中,在茎尖和花序(7 dbf)中的表达量较高,其次是花序(0 daf)中,而在幼果期果实中的表达量较低(图6)。比较MYB4b基因在老叶和新叶中的表达发现,MYB4b在老叶中的表达量高于新叶。

图6 不同组织部位的MYB4b基因的组织表达模式(左)及花色苷含量(右)Figure 6 Relative expression of MYB4b (left) and anthocyanin contents (right) in different tissue parts
如图6所示,‘摩尔多瓦’葡萄不同组织部位中均含有花色苷。其中,花色苷在葡萄果实成熟期含量显著高于其他组织部位,是花序(7 dbf)中花色苷含量的3.6倍,是花序(7 daf)中花色苷含量的50倍。比较花色苷在老叶和新叶的含量发现,老叶(0.756 mg·g-1)中的花色苷含量略高于新叶(0.737 mg·g-1);比较花色苷在老卷须和幼卷须的含量发现,老卷须(0.149 mg·g-1)中的花色苷含量低于新卷须(0.444 mg·g-1)。
2.5 离体处理对MYB4b的基因表达和花色苷的影响
由图7可知,盐胁迫下,果实中MYB4b基因的表达呈先升高后下降趋势,以处理6 h的MYB4b的表达量最高,之后逐渐回落。PEG诱导的干旱处理中,处理3 h的表达量较处理前显著上升,24 h明显回落,但处理6 d的表达量再次显著上升。葡萄果实在碧护处理中,MYB4b基因的表达量在处理的各个时间点均显著低于0 h,但6、12、24 h时均显著高于同时期的清水处理,而处理2、4、8 d,MYB4b基因的表达量明显下调,显著低于处理前。葡萄果实在壳聚糖处理12 h前MYB4b基因的表达逐渐增加,在12 h达到最高值,随后MYB4b基因的表达开始降低,自2 d开始各处理时间点MYB4b基因的表达量均低于处理前。上述结果表明,0.3%盐、PEG6000、碧护和壳聚糖处理下调MYB4b基因的表达,其中0.3%盐和壳聚糖的下调表达更强烈。

图7 离体处理下MYB4b基因的表达变化Figure 7 Expression changes of MYB4b gene under in vitro treatment
由图8可知,盐胁迫下(图8A),果实中花色苷的含量变化先增加后减少,以处理6 h花色苷的含量最高,处理6 h后,花色苷的含量逐渐回落,在处理4 d时达到次高值。PEG诱导的干旱处理(图8B),果实中花色苷的含量变化先增加后减少,以处理4 d时花色苷的含量最高,显著高于其他组织部位,是处理0 h的5.8倍。碧护处理中(图8C),花色苷含量在处理6 h时达到最高值,6 h后逐渐降低,在处理6 d时有所回升,却仍低于处理6 h的花色苷含量,是处理6 h的0.65倍。壳聚糖处理中(图8D),果实中花色苷的含量变化先减少后增加,以处理4 d时花色苷的含量最高,显著高于其他组织部位,处理0 h的花色苷含量为次高值。上述结果表明,0.3%盐、PEG6000、碧护和壳聚糖处理均可促进花色苷的合成,但花色苷含量最高的出现时间不同,其中0.3%盐和碧护处理均在处理6 h时花色苷含量最高,PEG6000和壳聚糖处理均在处理4 d时花色苷含量最高。

图8 花色苷在0.3%盐溶液(A)、PEG6000 (B)、碧护(C)和壳聚糖(D)处理中的含量Figure 8 Anthocyanin contents in in vitro treatment of 0.3% salt (A)、PEG6000 (B)、Bihu (C) and chitosan (D)
3 讨论
MYB转录因子家族成员均含有MYB保守结构域[12]。在物种的进化过程中,基因的保守氨基酸序列变化很小,决定着基因的功能和类型。根据NCBI的CDD数据库分析得到MYB4b蛋白在第1~131位碱基之间含有一个PLN功能结构域[13-14]。前人研究发现,PLN保守结构可能是一个含有多个结构域的模型,是转录阻遏型因子MYB5的保守结构域,说明MYB4b转录因子属于典型的MYB家族基因,可能具有转录抑制作用,其具体的功能有待进一步的试验验证。
由于转录调控因子需要与基因组DNA下游靶基因的顺式作用元件相结合,从而发挥其对下游基因的激活或者抑制等调控作用。当转录调控蛋白在细胞质中完成翻译修饰后,需要特定的核定位信号引导其从细胞质转运到细胞核中,因此转录因子的亚细胞定位大多是在细胞核中,如PbMYB3R、VdMYB14转录因子的检测与鉴定[15-16]。亚细胞定位预测结果表明,MYB4b转录因子定位于细胞核中,说明其含有的核定位信号,可将其翻译修饰后的蛋白质从细胞质转运到细胞核中,有助于其PLN保守结构域结合到基因组DNA上,从而发挥转录激活或抑制等调控功能。
在植物中,MYB基因家族具有悠久的进化历史。早期的系统进化分析推测,在十亿年前就出现了MYB结构域[17-18]。与动物相比,植物MYB基因家族系统性分化程度较低,数目众多,加大了对其进化研究的困难[19-21]。本文MYB4b转录因子与其他物种以及葡萄其他MYB转录因子构建系统进化树的结果表明,MYB4b与刺葡萄(Vitis davidii)的MYB相关蛋白的编码基因以及河岸葡萄(Vitis riparia)的MYB4a转录因子同源性最高,表明两者亲缘关系较近。
MYB转录因子是植物中非常重要的一类转录因子,是花青素生物合成中MBW复合物的主要调控因子[22]。Zahra[23]等研究也发现,MYB影响植物中花青素、黄酮类化合物的合成。本研究通过组织表达谱分析发现,MYB4b在‘摩尔多瓦’葡萄果实幼果期的表达量最低,在果实转色期及成熟期低表达,推测其可能负调控葡萄果实花色苷的合成。此外,MYB4b与MYB14、MYB15的同源性相对较高,李慎昌[24]的试验结果表明,VdMYB14能够有效抑制花色苷的合成,推测MYB4b抑制花色苷的合成。
碧护是一种植物生长调节剂,其作用机理是让植物获得抗性物质,提高自我修复功能,它能激活植物体各种酶的活性,促使植物叶片把光合效能转化为化学能[25]。壳聚糖在许多园艺作物中的应用潜力多有研究,包括诱导防御反应、改善农艺性状、果蔬采后管理、促进植物生长和增强生理活性等[26]。本研究发现,0.3%盐、干旱、碧护和壳聚糖处理均下调MYB4b基因的表达,推测对花色苷的合成起促进作用。MYB4b基因是否对葡萄果实花色苷的合成有影响待进一步的验证分析。
4 结论
本试验通过PCR技术和TA克隆得到‘摩尔多瓦’葡萄MYB4b基因序列,该基因编码的蛋白质属于亲水性的非分泌碱性蛋白,系统进化树显示MYB4b基因与拟南芥的MYB4同源性较高,与VvMYB14/15的同源性相对较低,可能属于不同的亚型。
MYB4b基因在不同组织部位均有表达,茎尖和花序(7 dbf)中的表达量较高,在幼果期的果实中表达量较低;同时受到0.3%盐、PEG6000、碧护和壳聚糖处理的诱导表达,其中0.3%盐和壳聚糖对MYB4b基因的下调表达更强烈。
