适合免疫治疗的大鼠抗肾小球基底膜肾炎模型的建立
2022-05-28彭灿灿王惠明
彭灿灿, 王惠明
武汉大学人民医院,武汉430060
抗肾小球基底膜(glomerular basement membrane,GBM)病也称为Goodpasture综合征,是一种经典的自身免疫性疾病,其特征是循环中存在抗肾小球和/或肺泡基底膜的自身抗体,常导致急进性肾小球肾炎,同时伴有肺出血的风险[1]。Ⅳ型胶原a3 链的非胶原结构域1[a3(Ⅳ)NC1]是抗GBM 抗体的主要靶抗原[2-3],相关研究证实该区域的一个线性表位肽P14(a3127-148)同时包含B 细胞和T 细胞识别的表位[4-8]。目前,治疗时常使用皮质类固醇、免疫抑制剂及血液透析排除循环中的抗体[9-11]。多数患者病情进展迅速,预后不良。
虽然抗GBM 病的流行病学和临床研究已较成熟,但其潜在的疾病发展机制尚未完全阐明,不同的动物模型可以帮助研究抗GBM 病的各个具体方面和开发新的特异性疗法。实验性自身免疫性肾小球肾炎(experimental autoimmune glomerulonphritis,EAG)是Goodpasture 综合征的一种动物模型,可在大鼠和小鼠敏感品系中通过可溶性GBM 或重组a3(Ⅳ)NC1 诱导免疫[12]。EAG 与人类疾病有许多共同的特点,如肾和肺病理非常相似[13],抗GBM 抗体对主要靶抗原a3(Ⅳ)NC1具有相同的特异性。
通过制备含有B 细胞和T 细胞共同表位P14肽,观察在WKY 大鼠中诱导典型的EAG 模型的能力,本研究建立了一种较为稳定的动物模型,希望辅助了解抗GBM 病的发病机制和病因,并为开发更为特异的免疫疗法提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级健康雌性、4~6 周龄WKY大鼠20只,体质量65~80 g,购自维通利华实验动物技术有限公司,动物生产许可证号为SCXK(京)2016-0006。大鼠饲养于武汉大学人民医院动物实验中心,动物饲养许可证号为SYXK(鄂)2015-0027。
1.1.2 多肽制备 P14(a3127-148)线性多肽序列为TDIPPCPHGWISLWKGFSFIMF(Uniprot accession:Q01955 CO4A3_HUMAN1615-1636),由南京金斯瑞生物科技有限公司合成,纯度95%。
1.2 方法
1.2.1 动物分组及免疫 4~6周龄健康WKY大鼠
20只,SPF级适应性饲养1周后随机分为2组,即对照组和抗GBM病模型组(肾炎模型组),每组10只。将P14 肽与完全弗氏佐剂(CFA,购自Sigma-Aldrich公司)充分乳化,通过大鼠后脚垫三点注射对肾炎模型组进行单次免疫,剂量为200 μg·kg−1,而对照组仅用CFA 免疫。免疫前及免疫后每周使用代谢笼收集24 h 的尿液样本,通过尾静脉穿刺采集血样。所有大鼠在免疫后7 w 处死,收集血液和肾组织进行进一步实验。本研究所有动物实验均经过武汉大学人民医院实验动物伦理委员会审核批准。
1.2.2 生化指标检测 免疫前后每周收集24 h尿样和血样,在武汉大学人民医院临床实验室通过全自动生化分析仪检测大鼠尿蛋白和尿肌酐,并计算出尿蛋白肌酐比值(albumin/urine creatinine ratio,ACR)的变化;通过肌氨酸氧化酶法和脲酶法分别检测血清肌酐(serum creatinine,Cre)及血清尿素氮(blood urea nitrogen,BUN)的变化。
1.2.3 病理学检查 光镜和直接免疫荧光检查肾组织,在光学显微镜下,将肾组织用4%的多聚甲醛固定,脱水并包埋在石蜡中,肾脏切片(3 μm)用高碘酸-希夫(perioclic acicl schiff,PAS)染色,观察肾脏的病理损害。对于直接免疫荧光,冰冻切片(5 μm)用丙酮固定,并与FITC结合的山羊抗大鼠IgG(Abclonal,1∶50)室温孵育,以检测IgG在GBM上的沉积情况。每个组织中至少评估50个肾小球。
1.2.4 肾组织浸润情况检测 通过染色石蜡切片(MPO 和CD68)分别检测中性粒细胞和巨噬细胞在肾小球中的浸润情况。上述所有切片分别使用MPO抗体及CD68抗体于4 ℃孵育过夜,随后与辣根过氧化物酶结合的山羊抗小鼠IgG(Abclonal,1∶50)室温孵育,并用二氨基联苯胺(diaminobenzidine,DAB)进行30 s 染色。通过Image J 分析软件评估,每个组织中至少评估20个肾小球。
1.2.5 电镜检测 在电子显微镜下,将肾组织固定在3%戊二醛和1%四氧化锇中,然后在分级乙醇中脱水并在丙酮中洗涤,最后包埋在Epon812中。用醋酸铀酰和柠檬酸铅染色,并用透射电子显微镜检查。
1.2.6 循环中抗GBM抗体的水平检测 采用间接
ELISA分别检测免疫前后每周血清中抗GBM抗体的水平变化。将多肽P14(a3127-148)以10 μg·mL−1包被到96 孔板上过夜,1%BSA 封闭,1∶100 稀释的血清样品37 ℃下在平板中孵育1 h 后,添加1∶2 000 稀释的辣根过氧化物酶结合的山羊-大鼠IgG(Abclonal),使用四甲基联苯胺作为底物,避光孵育并在450 nm处用分光光度法测量显色。
1.2.7 统计学处理 采用SPSS 26.0 统计软件进行数据分析。计量资料以平均数±标准差表示,采用双因素方差分析作为统计学检验方法,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 生化指标
如图1所示,肾炎模型组大鼠自免疫后第4周起,ACR 及24 h 尿蛋白含量开始升高。ACR 在第5 周达到峰值,达863.62±114.45 mg·mmol−1,与对照组(80.53±50.73 mg·mmol−1)相比具有统计学差异(P<0.001)。24 h尿蛋白含量在第6周达到峰值(76.93±9.03 mg·24 h−1),与对照组(5.37±0.87 mg·24 h−1)相比具有统计学差异(P<0.001)。血肌酐及血尿素氮含量在免疫后第5周开始升高,此后随肾炎进展持续升高,且不同时间点肾炎模型组均显著高于对照组(P<0.05,图1)。

图1 肾炎模型组与对照组大鼠尿蛋白肌酐比值、24 h尿蛋白含量、血肌酐和血尿素氮随时间的变化情况Fig.1 Quantitative comparison of ACR,24 h urinary protein,serum creatinine and serum urea nitrogen between nephritis model group and control group with time
以上结果表明,肾炎模型组大鼠在P14(a3127-148)免疫后第4~7 周,均能形成大鼠抗GBM肾小球肾炎,免疫后第4 周,病变相对较轻,免疫第5~7周,肾炎基本稳定。
2.2 病理学检查
2.2.1 光镜观察 与对照组相比,肾炎模型组大体观表现为肾脏体积明显增大、缺血(图2)。肾炎模型组大鼠免疫后第7 周时肾小球体积增大,球内有核细胞数增多,PAS 染色可见肾小球中富于细胞型新月体伴节段性纤维素样坏死,累及75%以上肾小球,对照组大鼠在完全弗氏佐剂免疫后未出现肾损伤(图3)。肾组织免疫组化染色也观察到肾脏间质炎症改变,肾炎模型组大鼠的肾小球簇和新月体中存在中性粒细胞和巨噬细胞浸润,而对照组基本无炎性细胞浸润(图4)。在所有大鼠中均未观察到肺部病变(图4)。
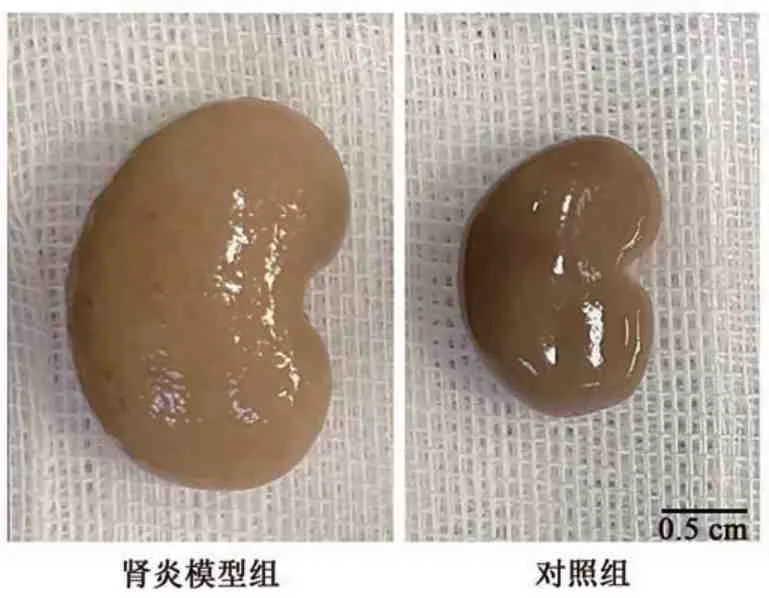
图2 肾炎模型组与对照组大鼠肾脏大体观表现Fig.2 Appearance of kidney in nephritis model group and control group
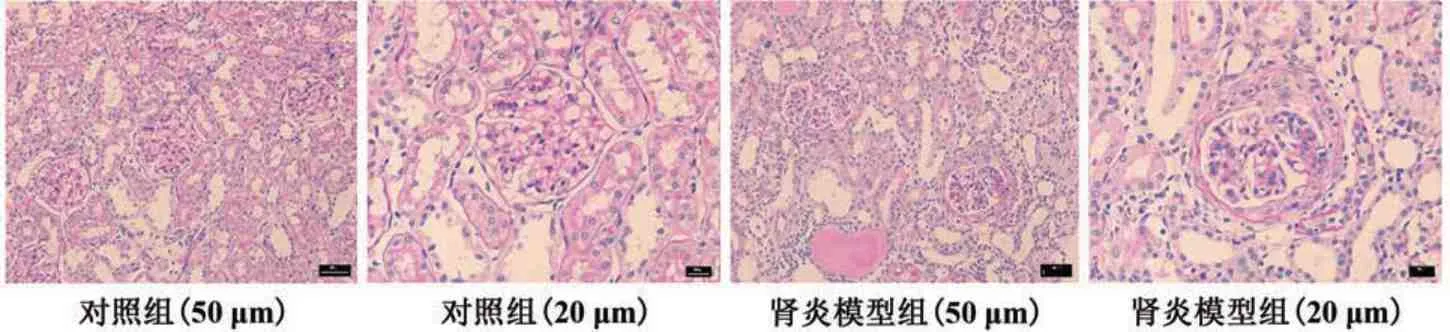
图3 肾炎模型组与对照组大鼠肾组织切片PAS染色Fig.3 PAS staining of renal tissue sections of rats in nephritis model group and control group
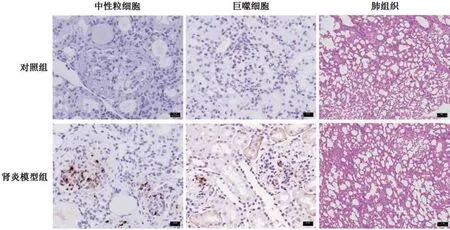
图4 肾炎模型组与对照组大鼠炎性细胞浸润情况及肺组织切片Fig.4 Inflammatory cell infiltration and lung tissue sections of rats in nephritis model group and control group
2.2.2 免疫荧光检查 肾炎模型组大鼠在直接免疫荧光上均呈现沿GBM 的强线性IgG 沉积,但在对照组中未检测到(图5)。
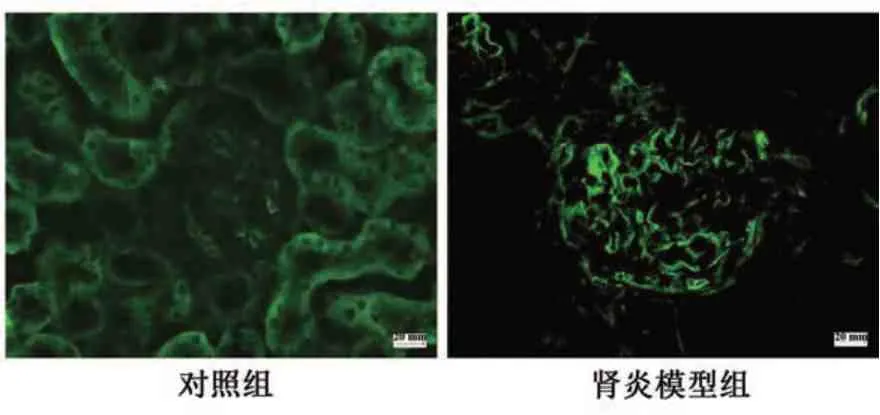
图5 肾炎模型组与对照组大鼠免疫荧光检测结果Fig.5 Results of immunofluorescence detection in nephritis model group and control group
2.2.3 电镜检测 在电子显微镜下,肾炎模型组肾小球中发现GBM 的断裂和收缩,呈新月形,无电子致密物沉积。对照组在电镜下未观察到GBM损伤(图6)。

图6 肾炎模型组与对照组大鼠电镜结果Fig.6 Electron microscope results of nephritis model group and control group
以上结果表明,肾炎模型组大鼠在P14(a3127-148)免疫后诱发出严重的新月体型肾小球肾炎,肾病理表现与人类疾病基本一致。
2.3 抗GBM抗体水平
如图7所示,肾炎模型组大鼠在免疫后第2周,对P14 产生了强烈的血清抗体反应,并在免疫后第5 周达到高峰(2.43±0.18),与对照组(0.04±0.04)相比,差异具有统计学意义(P<0.001)。虽然抗体水平在第5 周后下降,但较对照组差异仍有统计学意义(P<0.001)。

图7 肾炎模型组与对照组大鼠血清中抗GBM抗体的水平随时间变化情况Fig.7 Comparison of serum anti-GBM antibody levels between nephritis model group and control group with time
以上结果表明,肾炎模型组大鼠在免疫后第2 周起对P14(a3127-148)产生了强烈的血清抗体反应,抗体水平较高且趋于稳定。
3 讨论
Goodpasture 综合征亦称抗GBM 病,其典型特点为血清中抗GBM 抗体在肾小球基底膜和肺泡基底膜沉积,可导致快速进展性新月体性肾小球肾炎,超过50%的患者伴有肺出血。虽然该病临床并不常见(发病率为每年每百万人0.5~1.6例)[14],但20%的快速进展性肾小球肾炎患者由抗GBM 病引起,40%的患者可出现肾脏受累[15]。临床上这种疾病的变异或非典型表现的例子越来越多,建立更为稳定的疾病模型可以帮助研究者理解疾病发病机理,从而更好地寻找新疗法。
先前的研究显示,许多抗GBM 病的动物模型是通过直接使用GBM 胶原蛋白或重组的a3(Ⅳ)NC1 进行主动免疫开发的,已经建立了几种抗GBM 病的啮齿动物模型[12,16-18],但这些模型很难确定抗体及T细胞在肾小球损伤过程中介导的机制。随后一些模型开始使用其抗原表位显性肽进行免疫,如来自a3(Ⅳ)NC1 上的单个T 细胞表位pCol(28-40),可在WKY 大鼠中诱发严重的新月体肾炎[8,19-21],明确了T 细胞在肾小球损伤过程中发挥关键作用。值得注意的是,由于人类自身免疫性疾病的异质性,每个动物模型可能只反映人类疾病整个发病机制的一部分[22]。因此,尽管已经为抗GBM 病建立了许多动物模型,未来的研究还需要更新颖和创新的模型。
本研究合成了一个线性表位肽P14(a3127-148)用以免疫WKY大鼠,随后评估实验性自身免疫性肾小球肾炎。P14(a3127-148)作为T 细胞和B 细胞的共同表位,是人类Goodpasture 综合征的初始表位,不仅可以诱导严重的肾小球肾炎,而且还可以引发分子内表位扩散[23]。本研究结果显示,所有肾炎模型组大鼠在P14(a3127-148)免疫后均出现抗GBM 肾小球肾炎,伴有蛋白尿、血清尿素氮和血肌酐升高;肾小球中富于细胞型新月体,显示增生性病变,肾小球周围有炎症反应,球内炎性细胞浸润;IgG沿GBM 呈强线性沉积;电镜下无免疫复合物沉积,可观察到GBM 断裂、坏死;间接ELISA 表明,肾炎模型组大鼠对P14(a3127-148)都产生了强烈的血清抗体反应。通过免疫后每周检测血、尿及循环中抗体水平的变化,证实该动物的肾炎模型与人类抗GBM 病基本一致。此外,一次合成的线性肽免疫就足以诱发这种暴发性的自身免疫疾病,使得这种建模方法显得极为简便而有效。
目前抗GBM 病的管理原则仍然是一样的:快速清除致病性抗体并防止其重新合成。虽然通过血浆交换或IAS 直接清除循环抗体是非常有效的,但由于肾脏破坏的进展,并不能改善患者肾功能[1]。因此替代疗法或附加疗法是必要的,且通过靶向抗原特异性免疫应答治疗效果良好[10-11,24]。
综上所述,人工合成的P14(a3127-148)线性肽在WKY 大鼠中可以成功诱导新月体肾小球肾炎,本研究建立了一种操作简便且较为稳定的抗GBM病动物模型。其中监测循环中抗P14(a3127-148)IgG抗体的含量变化,将有助于开发更为特异的免疫疗法。
