HMGA2基因缺失对PM2.5暴露致大鼠肺损伤和心功能不全的影响
2022-05-27张钰凡余宏鑫唐宋梁建军
张钰凡 余宏鑫 唐宋 梁建军
大气细颗粒物2.5(particulate matter 2.5,PM2.5)污染已成为威胁中国和其他发展中国家公众健康的重大问题[1]。流行病学研究表明,长期暴露于空气中的高浓度PM2.5环境中会增加呼吸道和心血管疾病的风险,如哮喘、支气管炎、慢性阻塞性肺病(Chronic obstructive pulmonary disease,COPD)、冠状动脉疾病和心力衰竭[2]。毒理学研究也证实,PM2.5暴露对健康的不良影响与炎症和氧化应激的增强有关,从而可能导致肺损伤和心功能不全[3]。考虑到环境PM2.5多年来一直处于高水平,空气质量短期内无法改善,寻找有效的治疗方法减少PM2.5相关疾病迫在眉睫。然而,PM2.5导致肺损伤和心功能不全的机制尚不清楚。高迁移率族蛋白 A2(high mobility group protein A2,HMGA2)是HMGA家族(HMGA1a,HMGA1b,HMGA1c和HMGA2)的重要成员,对于细胞的生长和分化非常重要,还参与了上皮-间充质转化(Epithelial-mesenchymal transformation,EMT)[4]。另有研究表明,HMGA1在核转录因子-κB(nuclear factor-kappa B,NF-κB)的作用下,激活炎症和增殖相关基因[5]。同时,NF-κB活化与血浆和组织中促炎细胞因子水平的升高密切相关,可作为感染性疾病治疗的生物标志物和靶点[6]。然而,HMGA2基因缺失对PM2.5暴露致大鼠肺损伤和心功能不全的的作用研究还很少。因此,本研究将PM2.5暴露诱发野生型(Wild type,WT)和HMGA2基因敲除(HMGA2-/-)大鼠炎性反应和氧化应激,并对肺功能和心功能进行检测,以确定通过HMGA2途径保护PM2.5诱导的大鼠肺损伤和心功能不全。
1 材料与方法
1.1 实验动物 SPF级WT大鼠(10只)和HMGA2-/-大鼠(10只),体质量(200±20)g,购自卡文斯实验动物有限公司,动物生产许可证号:SCXK(苏)2020-0010,在温度(23±2)℃、相对湿度为45%~55%的环境中适应性喂养1周后进行实验。
1.2 主要试剂与仪器 白介素-6(Interleukin-6,IL-6)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、3-硝基酪氨酸(3-Nitrotyrosine,3-NT)和4-羟基壬烯醛(4-Hydroxynonenal,4-HNE)酶联免疫吸附(Enzyme-linked immunoadsorption,ELISA)试剂盒(南京建成生物工程研究所);RIPA裂解缓冲液(上海生工生物工程有限公司,批号:175056);HMGA2、NF-κB、过氧化物还原酶5(Peroxiredoxin,PRDX5)、GADPH和HRP标记山羊抗鼠二抗(美国Santa Cruz公司);ECL化学发光液(美国GE公司);TH-150D型智能中流量空气总悬浮颗粒物采样器(武汉市天虹仪表有限责任公司);AniRes2005动物肺功能分析系统和RES3020动物呼吸机(北京贝兰博科技有限公司);VM7型便携式彩色多普勒超声诊断仪(深圳迈瑞生物医疗电子股份有限公司);Sunrise型全自动酶标仪(瑞士Tecan公司);BD垂直电泳仪(美国BD公司);2500凝胶成像和分析系统(上海天能科技有限公司)。
1.3 PM2.5混悬液的制备 用TH-150D型智能中流量空气总悬浮颗粒物采样器连续24 h进行PM2.5采集,用液氮冷冻干燥成粉,4℃保存。用10 mg PM2.5粉末溶于4.8 ml 0.9%氯化钠溶液中等到PM2.5混悬液(现用现配)。
1.4 分组及造模 将WT大鼠按体重用随机数字表法分为对照组和PM2.5组,每组5只;将HMGA2-/-大鼠按体重用随机数字表法分为HMGA2-/-组和HMGA2-/-+PM2.5组,每组5只。对照组和HMGA2-/-组大鼠每天气管滴注0.3 ml 0.9%氯化钠溶液,PM2.5组和HMGA2-/-+PM2.5组每天气管滴注0.3 ml PM2.5混悬液,连续4周后进行相关检测[7]。
1.5 心功能检测 末次干预1 h后,对大鼠进行麻醉,将探头置于胸骨左缘,采用VM7型便携式彩色多普勒超声诊断仪分别测量左心室射血分数(LVEF)和左心室缩短分数(LVFS)。
1.6 大鼠肺功能检测 做完心功能检测,将大鼠置于体描箱中,行气管插管,链接RES3020动物呼吸机,待数据曲线稳定后用AniRes2005动物肺功能分析系统采集力肺活量(FVC)和最大通气量(MVV)。
1.7 血清中IL-6、TNF-α、3-NT和4-HNE水平的检测 对大鼠进行心脏取血处死大鼠,分离肺和心脏,进行冻存;离心分离血清,根据试剂盒说明书,用MSunrise型全自动酶标仪测定血清中IL-6、TNF-α、3-NT和4-HNE水平。
1.8 组织中HMGA2、NF-κB和PRDX5水平检测 每只大鼠分别取100 mg心脏和肺组织,制成匀浆,加入1 ml RIPA裂解缓冲液,裂解2 h后离心取上清,加入1/5体积的5×Buffer,在沸水中变性,进行电泳(20 μg/孔)、切胶、转膜,然后用5%脱脂牛奶在室温下封膜(1 h),将膜与HMGA2(1∶400)、NF-κB(1∶400)和PRDX5(1∶300)进行孵育(4℃过夜),将膜与HRP标记山羊抗兔IgG二抗(1∶10 000)在室温下孵育(30 min),用ECL化学发光液进行显色,采集图像进行分析(以GADPH作为内对照)。

2 结果
2.1 HMGA2基因缺失对PM2.5暴露大鼠肺功能和心功能的影响 与对照组比较,HMGA2-/-组各指标差异无统计学意义(P>0.05),PM2.5组和HMGA2-/-+PM2.5组大鼠FVC、MVV、LVEF和LVFS降低(P<0.05);与PM2.5组比较,HMGA2-/-+PM2.5组大鼠FVC、MVV、LVEF和LVFS降低(P<0.05)。见表1。

表1 HMGA2基因缺失对PM2.5暴露大鼠肺功能和心功能的影响
2.2 HMGA2基因缺失对PM2.5暴露大鼠血清中IL-6、TNF-α、3-NT和4-HNE水平的影响 与对照组比较,HMGA2-/-组各指标差异均无统计学意义(P>0.05),PM2.5组和HMGA2-/-+PM2.5组大鼠血清中IL-6、TNF-α、3-NT和4-HNE增加(P<0.05);与PM2.5组比较,HMGA2-/-+PM2.5组大鼠血清中IL-6、TNF-α、3-NT和4-HNE增加(P<0.05)。见表2。

表2 HMGA2基因缺失对PM2.5暴露大鼠血清IL-6、TNF-α、3-NT和4-HNE水平影响
2.3 HMGA2基因缺失对PM2.5暴露大鼠肺组织中HMGA2、NF-κB和PRDX5水平的影响 HMGA2-/-组和HMGA2-/-+PM2.5组大鼠肺组织中HMGA2无表达;与对照组比较,PM2.5组肺组织中HMGA2降低(P<0.05);与对照组比较,HMGA2-/-组各指标差异无统计学意义(P>0.05),PM2.5组和HMGA2-/-+PM2.5组大鼠肺组织中NF-κB增加、PRDX5降低(P<0.05);与PM2.5组比较,HMGA2-/-+PM2.5组大鼠肺组织中NF-κB增加、PRDX5降低(P<0.05)。见表3,图1。

表3 HMGA2基因缺失对PM2.5暴露大鼠肺组织中HMGA2、NF-κB和PRDX5水平的影响

图1 HMGA2基因缺失对PM2.5暴露大鼠肺组织中HMGA2、NF-κB和PRDX5水平的影响;A 对照组;B HMGA2-/-组;C PM2.5组;D HMGA2-/-+PM2.5组
2.4 HMGA2基因缺失对PM2.5暴露大鼠心脏组织中HMGA2、NF-κB和PRDX5水平的影响 HMGA2-/-组和HMGA2-/-+PM2.5组大鼠心脏组织中HMGA2无表达;与对照组比较,PM2.5组心脏组织中HMGA2降低(P<0.05);与对照组比较,HMGA2-/-组各指标差异无统计学意义(P>0.05),PM2.5组和HMGA2-/-+PM2.5组大鼠心脏组织中NF-κB和PRDX5降低(P<0.05);与PM2.5组比较,HMGA2-/-+PM2.5组大鼠心脏组织中NF-κB和PRDX5降低(P<0.05)。见表4,图2。

表4 HMGA2基因缺失对PM2.5暴露大鼠心脏组织中HMGA2、NF-κB和PRDX5水平的影响
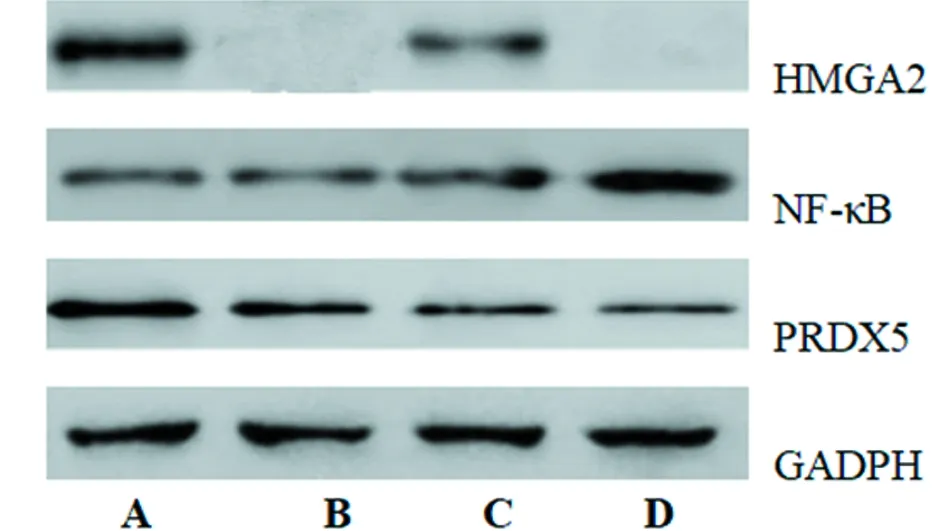
图2 HMGA2基因缺失对PM2.5暴露大鼠心脏组织中HMGA2、NF-κB和PRDX5水平的影响;A 对照组;B HMGA2-/-组;C PM2.5组;D HMGA2-/-+PM2.5组
3 讨论
随着PM2.5浓度的增加,患肺部和心脏疾病的风险增加[8]。由于PM2.5易被吸入气道并沉积在肺泡中,大鼠急性暴露于高浓度PM2.5可引起肺病理损伤,包括肺泡壁增厚、肺泡间隙减少、线粒体结构异常改变等[9]。心脏是PM2.5的另一个主要靶器官,PM2.5对心肌的直接影响包括活性氧(reactive oxygen species,ROS)生成、自发性心律失常及心肌血流改变等[10]。本研究结果显示,PM2.5暴露可以导致大鼠肺功能和心功能损伤。此外,HMGA2基因敲除加剧了PM2.5暴露大鼠肺功能和心功能损伤。研究证明,HMGA2活性受损可在应激条件下诱发呼吸系统和心血管系统代谢紊乱[11]。同时,本研究结果显示,PM2.5暴露会导致大鼠肺组织和心脏组织中HMGA2降低。
研究表明,激活HMGA2可减轻炎症,而抑制HMGA2可加重由不同伤害性刺激引起的炎症[12]。HMGA2激活可以通过磷酸化转录共激活因子p300来抑制NF-κB活性,或通过调节沉默信息调节因子-1(silent information regulator-1,SIRT1)、p53和叉头状转录因子O(Forkhead box O,FoxO)间接调节NF-κB活性[13]。本研究结果显示,HMGA2敲除会加剧PM2.5暴露大鼠肺组织和心脏组织中NF-κB的激活。
PM2.5具有诱导高水平ROS的能力,细胞内ROS的过量产生导致炎性细胞因子释放和DNA损伤,从而导致肺损伤。同时,PM2.5暴露也可能通过降低抗氧化酶的表达促进氧化应激[14]。虽然HMGA2长期以来被认为是代谢调节因子,但在某些条件下,HMGA2可调节ROS的产生和氧化应激[15]。例如,HMGA2激活诱导成纤维细胞中过氧化物酶体增殖物激活受体γ辅助激活子1α(peroxisome proliferator-activated receptor-γ coactivator 1α,PGC-1α)依赖的抗氧化反应[16]。PGC-1α是响应氧化应激的线粒体抗氧化基因表达的重要调控因子,在压力超载的PGC-1α-/-小鼠中,心肌PRDX5表达降低。PGC-1α缺乏也降低了出生后心脏生长过程中PRDX5的表达[17]。本研究推测,HMGA2可能通过PGC-1α依赖通路调控PRDX5的表达。最近研究也证实,在小管上皮细胞中,活化HMGA2可增加PRDX5的表达,而抑制HMGA2可降低PRDX5的表达[18]。本研究结果显示,PM2.5暴露显著增加了血清中3-NT和4-HNE水平,这与线粒体抗氧化酶(PRDX5)的降低有关,而HMGA2缺失特异性降低了PM2.5暴露大鼠肺和心脏中PRDX5的表达,增加了氧化应激。由于PRDX5是一种抗氧化酶,可降低H2O2、烷基氢过氧化物和过氧亚硝酸盐的含量[19]。因此,PRDX5的降低可能是PM2.5暴露后HMGA2-/-大鼠肺和心脏氧化应激增强的原因之一。
综上所述,HMGA2基因敲除能提高NF-κB水平和抑制PRDX5水平,使PM2.5暴露大鼠血清中炎性反应(IL-6和TNF-α)和氧化应激(3-NT和4-HNE)水平增加,显著加重了PM2.5暴露大鼠肺损伤和心功能不全。本研究结果表明,增加HMGA2活性可能是治疗空气污染相关疾病的一种潜在策略。
