肝癌合并肝硬化患者行LH术后发生并发症的危险因素分析
2022-05-27杨世扬马春峰
杨世扬,马春峰
(河南省舞阳县人民医院 普外科,河南 舞阳 462400)
肝癌是一种临床较为常见、发生于肝脏部位的恶性肿瘤,其早期无明显症状,随着病情的进展,将会出现乏力、发热、肝区疼痛等症状。肝癌的发病多由机体肝硬化造成[1]。现阶段,临床治疗肝癌合并肝硬化主要是采用腹腔镜肝切除术(LH),该术式可缓解患者的临床症状,且具有创伤小、恢复快等优点,但其在临床应用中容易出现肝旁囊肿、腹腔积液等并发症[2]。因此,临床研究的重点即找寻关于肝癌合并肝硬化患者行LH术后发生并发症的相关危险因素,以便进行及时有效的了解,并以此为依据采取相应措施,进而对患者进行防治,延长其生命。本文旨在探讨肝癌合并肝硬化患者行LH 术后发生并发症的危险因素,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2016 年1 月至2020 年9 月河南省舞阳县人民医院收治的56 例肝癌合并肝硬化患者,所有患者均经影像学检查确诊、并行LH 治疗。依据是否发生并发症分为发生并发症组15 例和未发生并发症组41 例。诊断标准:两组均参照《2010 年美国肝病学会肝细胞癌临床指南更新版解读》[3]中的相关诊断标准。纳入标准:①符合上述诊断标准;②非精神疾病;③无严重心、肾等功能异常等。排除标准:①合并脑肿瘤;②有凝血功能障碍;③有严重基础疾病等。
1.2 方法
两组患者均使用4 孔法。首先对患者进行全身麻醉及气管插管,使用影像学检查方法进行探查腹腔,并将术中的超声检查结果结合,以便明确肿瘤的详细情况,从而对肝表面的预切除线进行确定。是否采用肝门阻断主要是根据肿瘤体积、术中出血等情况决定,若需实施肝门阻断,将采用全入肝血流阻断法(Pringle 法)。对肝实质使用超声刀进行离断,然后对较为粗大的管道结构进行结扎,最后缝合创面。手术切缘范围≥1 cm,手术结束后,留置1 根腹腔引流管于肝创面旁。
1.3 观察指标
①单因素分析:主要包括性别、年龄、美国麻醉医师学会(ASA)分级、肝功能(Child-Pugh)分级、埃德蒙森分级(Edmonson)、吲哚氰绿15分钟滞留率(ICGR15)、肝硬化程度、手术出血量、术后剩余肝脏体积/总肝脏体积(FLV/TLV)、肝切除方法、肝门阻断、术者经验等资料。其中,ASA 分级共6 级,分级越高表明体质状况越差;Child-Pugh 分级共3 个等级,分级越高表明肝脏储备能力越差;Edmonson 分级共4 级,分级越高表明恶性程度越重;ICGR15:予以患者靛氰绿进行侧臂静脉注射,15 min 后取3 mL 静脉血离心(以3 000 r/min 离心15 min)分离血清,以分光光度计检测。②多因素Logistic 回归分析:采用多因素非条件Logistic 回归分析将单因素分析中差异有统计学意义的变量筛选为独立危险因素。
1.4 统计学方法
采用SPSS 22.0 统计软件进行数据分析。计数资料以百分率(%)表示,组间比较用χ2检验;危险因素的分析用多因素非条件Logistic 回归分析。P<0.05 为差异有统计学意义。
2 结果
2.1 肝癌合并肝硬化患者行LH 术后发生并发症的单因素分析
发生并发症组ASA 分级(Ⅲ级)、Child-Pugh分级(B 级)、ICGR15(>20%)、肝硬化程度(重度)的患者占比均高于未发生并发症组,而FLV/TLV(≥50%)、有术者经验的患者占比低于未发生并发症组,差异有统计学意义(P<0.05)。见表1。
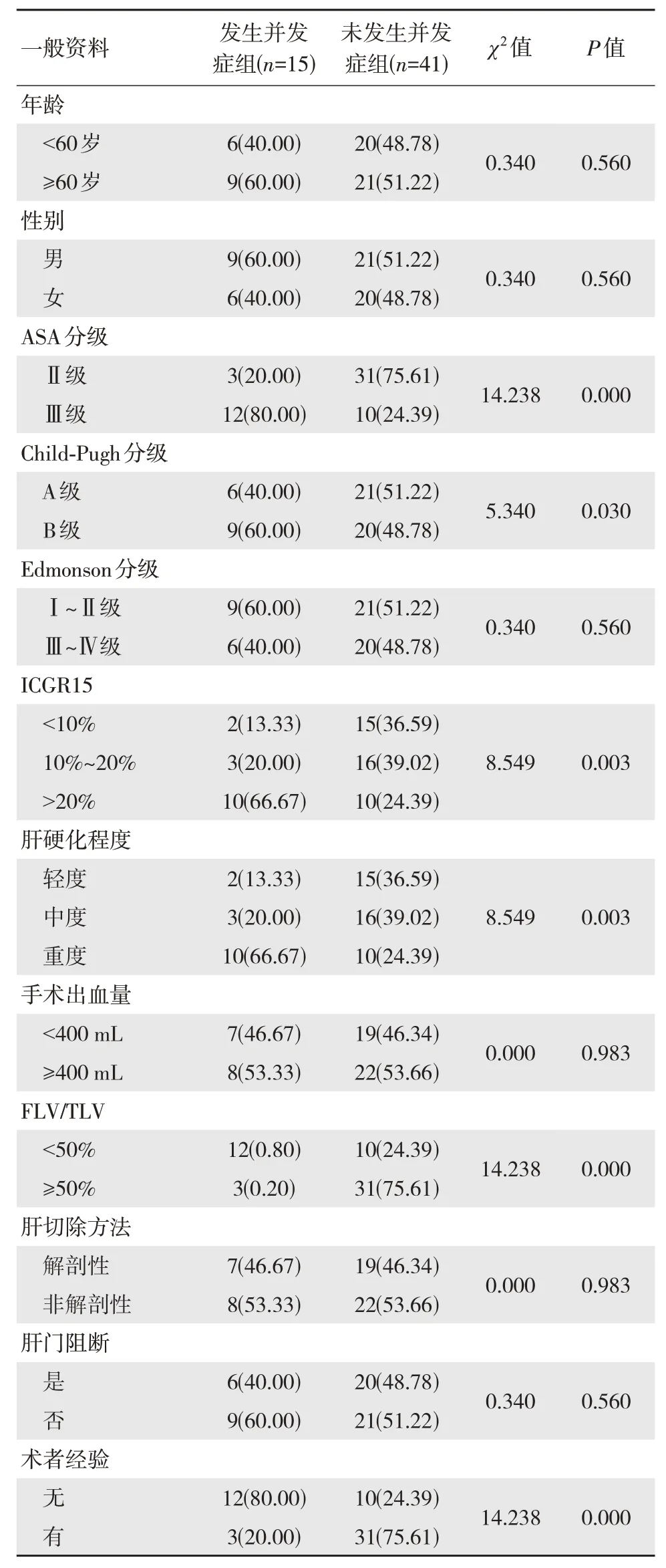
表1 肝癌合并肝硬化患者行LH 术后发生并发症的单因素分析 [n(%)]
2.2 肝癌合并肝硬化患者行LH 术后发生并发症的多因素Logistic 回归分析
以患者术后发生并发症为因变量,将单因素分析中比较有差异的指标作为自变量,纳入多因素非条件Logistic 回归模型,结果显示ASA 分级(Ⅲ级)、ICGR15(>20%)、肝硬化程度(重度)均为肝癌合并肝硬化患者行LH 术后发生并发症的危险因素(=3.274、5.129 和3.666,P<0.05),而FLV/TLV(≥50%)、有术者经验均为肝癌合并肝硬化患者行LH 术后发生并发症的保护因素(=0.249,0.282,P<0.05)。见表2。
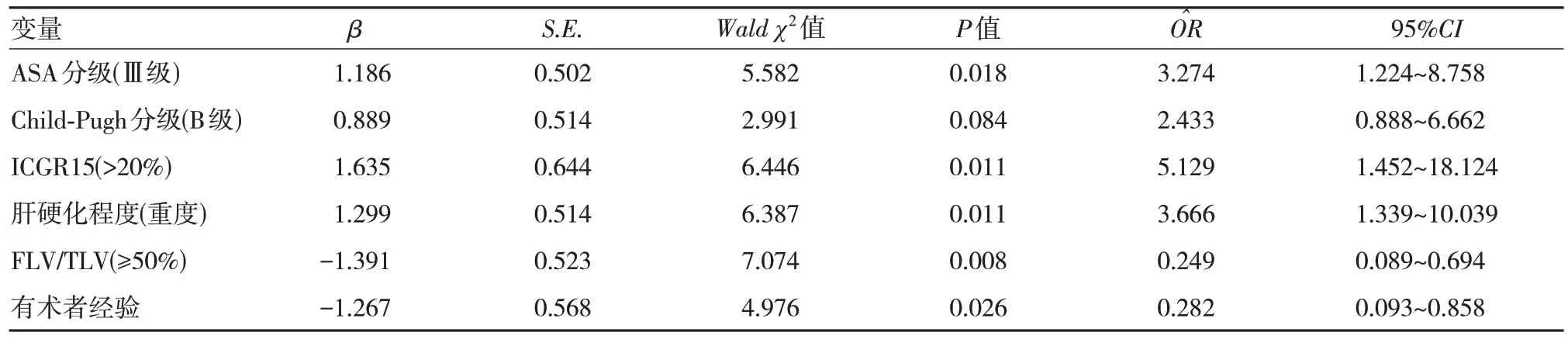
表2 肝癌合并肝硬化患者行LH 术后发生并发症的多因素Logistic 回归分析参数
3 讨论
肝硬化主要是由病毒感染、原发疾病等致病因素引起的一系列较为严重的肝功能损伤。若患者未能得到及时有效的治疗,病情将进一步发展、引发肝癌。肝癌合并肝硬化发病较为隐匿,且病情进展快[4]。近些年肝癌合并肝硬化的发病率呈逐年升高趋势。LH 主要是应用腹腔镜及电视影像学实施的一系列专业手术操作,其可通过对肝脏患处进行切除,达到控制患者病情进展的作用,但其在临床应用中具有并发症较多、手术难度较大等局限性。因此,若能确定肝癌合并肝硬化患者行LH 后发生并发症的相关危险因素,便可对患者实施及时有效的预防、治疗等相关措施。本研究选取56 例行LH 的肝癌合并肝硬化患者,并对其术后发生并发症的相关因素进行探讨。
单因素结果显示,发生并发症组中ASA 分级(Ⅲ级)、Child-Pugh 分级(B 级)、ICGR15(>20%)、肝硬化程度(重度)的患者占比均高于未发生并发症组,FLV/TLV(≥50%)、有术者经验的患者占比均低于未发生并发症组,比较有差异,与李贤杰等[5]研究结果基本相符。分析原因可能在于ASA 分级可用于反映患者实施手术的危险性情况,其分级越高表明患者手术安全性越低,且在围手术期的死亡率越高;Child-Pugh 分级越高提示患者的肝脏储备能力有所下降,进而发生并发症的可能性增加;ICGR15 水平可用于反映患者实施手术的耐受性情况,其水平>20%时,患者的手术耐受性较差,且术后容易发生肝功能衰竭;重度肝硬化患者的肝代偿能力较差,容易造成肝、肾、凝血等功能严重损伤,且于术后已发生诸多并发症;FLV/TLV 是指术后肝脏体积与术前肝脏体积的比值,其水平越高表明患者的肝脏损伤越轻,且手术的安全性越高。手术经验丰富的医师可在术中进行较为精细操作及妥善应对术中出现的问题,且可多保留患者的正常肝组织,减少并发症的发生。本研究中多因素非条件Logistic 回归分析结果显示,ASA 分级(Ⅲ级)、ICGR15(>20%)、肝硬化程度(重度)均为肝癌合并肝硬化患者行LH 后发生并发症发生并发症的危险因素,而FLV/TLV(≥50%)、有术者经验均为肝癌合并肝硬化患者行LH 术后发生并发症的保护因素,与李四桥等[6]研究结果基本相符。
综上所述,ASA 分级(Ⅲ级)、ICGR15(>20%)、肝硬化程度(重度)均为肝癌合并肝硬化患者行LH 后发生并发症发生并发症的危险因素,而FLV/TLV(≥50%)、有术者经验均为其保护因素。因此,临床可采取相应措施预防患者发生并发症,有效改善其肝功能,值得临床推广应用。
