新型生物色谱固定相制备及分析方法学研究进展
2022-05-27柴心怡顾妍秋陈啸飞柴逸峰海军军医大学药学院上海00433上海交通大学医学院附属第九人民医院上海0999
柴心怡,顾妍秋,陈啸飞,柴逸峰 (. 海军军医大学药学院, 上海 00433;. 上海交通大学医学院附属第九人民医院, 上海 0999)
生物色谱法( bio-chromatography)于20 世纪80 年代中后期出现[1],是由生命科学与色谱分离技术交叉形成的一种极具发展潜力的新兴色谱技术。随着色谱柱制备技术和在线联用技术的深入发展,各种具有生物活性的材料,如蛋白质、细胞膜、仿生物膜、活细胞、细胞壁等纷纷被作为固定相成功投入研究。对于生物色谱技术来说,搭载生物材料的色谱固定相是技术的核心所在。对于适宜生物材料的选取、构建以及对于生物材料固定方法学的开发,使得固定相在最大程度上模拟体内的生理过程,是生物色谱技术最重要的研究方向[2-5]。
1 新型生物色谱固定相方法学研究进展
1.1 细胞膜色谱固定相
针对膜受体的活性分子筛选所提出的细胞膜色谱技术发展成为近年来的代表性生物色谱技术,西安交通大学贺浪冲、王嗣岑团队[6-8]开拓了该领域并进行了大量的理论和应用研究工作。该技术原理是直接提取细胞膜并固定于硅胶载体制备液相色谱固定相,通过结合受体动力学与液相色谱分析,在色谱柱内动态模拟药物在体内与受体相互作用的过程,并通过色谱参数来评价化合物的亲和活性。细胞膜色谱固定相[9-10]很好地保住了膜受体的结构和活性,且适用于与各类色谱质谱系统的联用。Ding 等[11-12]在细胞膜色谱固定相方法学方面开展了大量工作,对细胞用量、破碎条件、固定相合成及填装流程进行了全面的方法学优化,对色谱柱质量标准具有较为精准的把控。此外,通过采用外源转染携带特定蛋白基因的质粒构建高表达细胞系,可实现针对特定靶受体的活性化合物筛选。但这种直接提取细胞膜并固定于载体所制备的生物色谱固定相不可避免地带来专属性和灵敏度两方面的局限性[13],主要源于细胞膜上其他膜受体的干扰和膜蛋白自身的低丰度、含量不可控等特性,不适用于靶向目标膜受体活性成分的高通量精准分析。
1.2 仿生膜色谱固定相
利用蛋白脂质体重构技术(proteoliposome reconstitution)[14-15]制备人工仿生膜镶嵌膜受体,包裹于硅胶基质表面,作为色谱固定相,是一种新近发展的体外模拟膜受体生物构象和微环境的新方法。其原理是将二油酰基磷脂酰胆碱、二油酰磷脂酰甘油、棕榈油酰磷脂酰胆碱、胆固醇等细胞膜含有的磷脂类成分与纯化或重组的膜受体按一定比例混合,采用不同的水化超声条件,制备成单层脂质囊泡、双层膜微胞、碟状胶束、平面磷脂膜等形式,实现膜受体-脂质体镶嵌模型重构[16-17]。膜受体脂质体是体外膜受体的理想存在形式,Mathiasen等[14]发展了两种膜受体-脂质体镶嵌模型,实现蛋白数量和融合度稳定可控,并将其用于纳米尺度的高含量分析,其研究结果发表在2014 年的《Nature Methods》上。相比较于细胞膜色谱固定相,膜受体脂质体具有蛋白种类和含量可控,磷脂和蛋白易于标记修饰等优势[18-19]。然而,此项技术仍然存在着蛋白在重构过程中发生结构改变而失活的风险。
1.3 分子生物色谱
分子生物色谱(MBC)是基于生物大分子特异性识别原理,属于扩展的亲和色谱[20]。广泛用于研究药物与血浆蛋白、糖蛋白、受体、DNA 等大分子的相互作用关系,揭示了药物的血浆结合率等重要药理特性,而受体生物色谱[21-22]不仅能判定药物在体内的作用靶点,还可以研究药物与受体的作用强度以及与其他药物的竞争作用。对于生物色谱固定相,无论是应用于药物筛选,还是对蛋白-蛋白或蛋白-药物相互作用的研究,如何能够将大量功能完整的蛋白固定到载体表面都是技术关键。目前,色谱固定相上的蛋白固定化策略主要可分为物理吸附、化学键合、亲和标签偶联[23]。
1.3.1 物理吸附
物理吸附即通过蛋白质与表面之间的弱相互作用(即氢键、静电相互作用、疏水相互作用和范德华力)来实现蛋白质固定化。利用吸附原理进行偶联主要有两点好处,一是不需要对蛋白进行修饰,二是不需要额外的偶联剂[23-24]。在细胞膜色谱固定相及仿生膜生物色谱固定相发展初期,生物材料与硅胶基质的融合依赖于磷脂膜上氨基与硅胶表面硅羟基的氢键和静电吸附作用力。这种固定方式在实际应用中存在着很明显的缺陷[25],主要在于吸附作用力较弱,吸附过程可逆,且取向随机。随着时间推移,蛋白易从硅胶上脱落失活,导致色谱柱寿命短,稳定性不够[26]。
1.3.2 化学键合
鉴于物理吸附的不足,化学修饰策略成为探索热潮。化学修饰策略主要可分为两种途径:①对生物分子进行化学修饰;②对固定相载体进行化学修饰。根据蛋白结构特征,可以对其天然存在的官能团进行共价修饰从而与固定相形成共价结合,以获得更加稳定的附着[24-25]。考虑到蛋白活性位点和固定相的空间相互作用,主要对蛋白质暴露的氨基酸的N 端和C 端进行修饰,用于修饰的基团包括氨基、羧基以及巯基等[24,27]。蛋白质与固定相载体的共价键结合又可分为非特异性结合与定点结合。绝大部分使用传统非特异性结合方法的生物大分子都存在结合取向随机的问题[28],此外,当随机固定化蛋白与表面之间的相互作用太强时,也存在变性的可能性。为了使蛋白质能够在固定相表现均匀的定向排列,开发定点结合的方法显得具有重要意义。
对固定相载体进行化学修饰,很好地避免因蛋白修饰可能影响蛋白生物活性的问题。本课题组利用固定相载体化学修饰技术,先后发展了3-氨基丙基三乙氧基硅烷(APTES)、 3-巯丙基三甲氧基硅烷(MPTS)修饰的硅胶(图1),使硅胶表面游离醛基、酯基等活性基团,与磷脂膜或蛋白上的氨基共价键合[12]。通过考察发现这种修饰方式有效提升了生物色谱柱的使用寿命和稳定性,并由此使得生物色谱在原代细胞、干细胞、纯蛋白等生物材料上的适用性更强。在固定相共价修饰的基础上,纯蛋白色谱固定相也易实现,此技术可广泛应用于各类胞膜及胞质蛋白的亲和活性成分的筛选与相互作用分析。
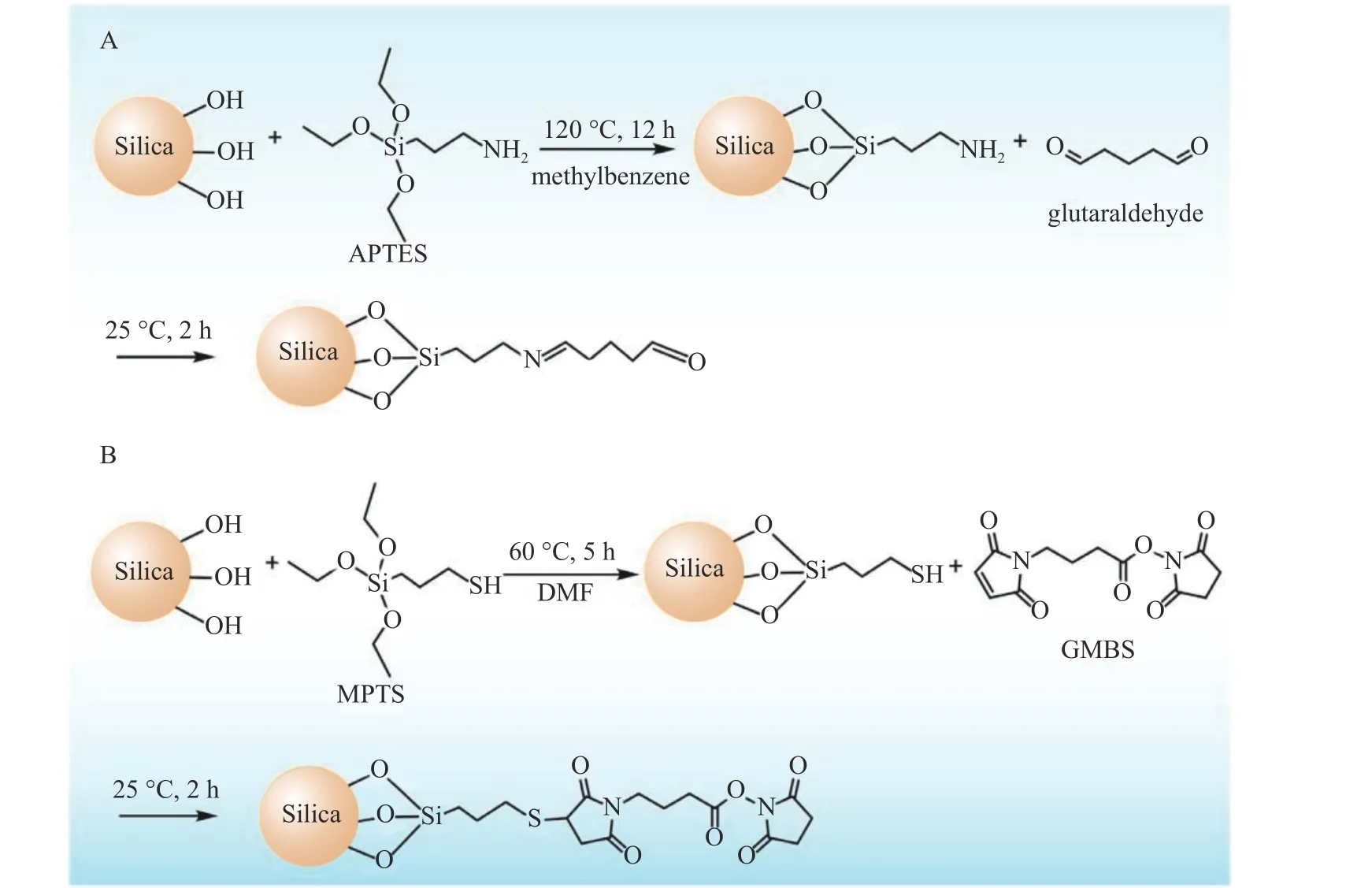
图1 硅胶固定相的APTES(A)和MPTS(B)共价活性基团修饰合成路线
1.3.3 亲和标签偶联
亲和标签偶联法则可以在更温和的条件下,使蛋白质定向均匀地连接到固定相上。不仅降低了蛋白质降解的风险,而且可以解离蛋白质,重复使用固定相[24,27]。生物素-亲和素系统稳定性很高,两者结合亲和常数可为抗原-抗体反应的百万倍,形成复合物的解离常数很小,呈不可逆反应性;而且酸、碱、变性剂等其他苛刻条件均不影响其结合[24,29-30]。Kim 等[31]构建了一种基于氢醌笼状生物素表面的蛋白质模式形成方法,此方法还允许通过使用预先定型的电极阵列来选择性地产生生物素以固定目标蛋白(图2)。His 是最受欢迎的标签,它是6 个组氨酸残基组成的融合标签,可插入在目的蛋白的C 末端或N 末端,其主要优势在于分子量小,一般不影响蛋白的功能;免疫原性相对较低;纯化条件温和等[32]。

图2 在氢醌笼状生物素修饰金表面生成生物素的电化学氧化反应原理图
2 基于新型固定相的生物色谱分析应用研究现状
2.1 应用于药物筛选分析
当药物随流动相流经生物色谱,由于不同成分与固定相上的生物活性物质的作用方式及作用程度的差别而在色谱柱上表现出不同的保留特性, 以此为基础,生物色谱已广泛应用于中药等复杂体系的活性化合物筛选分析[33]。细胞膜色谱技术自提出以来,已经用于160 多种植物或中药的活性成分筛选,极大地推动了中药药效物质基础的发现[34-35]。在细胞膜色谱技术的基础上,一种全二维-CMC-液相色谱-高分辨质谱联用分析系统发展起来,通过对固定相不断进行优化,结合特定膜受体的高表达细胞构建技术,固定相共价修饰技术,使得细胞膜色谱技术在自动化、高通量、稳定性与专属性各方面性能提升的同时,也拓展应用于更多珍稀生物材料的筛选分析。Chen 等利用双通道全二维HepG2/CMC/TOFMS 分析系统(图3),成功筛选出黄柏和苦参中的潜在活性成分[36]。Ding 等采用APTES修饰硅胶策略将HepG2 干细胞膜键合于固定相上,从中药丹参中筛选出了作用于肝癌干细胞膜的活性组分[12]。除此之外,固定相共价修饰技术推进了纯蛋白生物色谱分析系统的发展,使筛选系统实现针对特定受体的高特异性筛选。Gu 等采用MPTS修饰硅胶固定相固定ACE2 受体,从连花清瘟胶囊给药的健康人血浆中筛选出8 种靶向ACE2 的活性化合物,并证实其中5 种化合物具有对ACE2 酶活性具有较高的抑制作用,为连花清瘟胶囊临床上防治新冠肺炎提供了直接的体内药效物质基础和潜在分子机制依据[37]。

图3 全二维细胞膜色谱分析系统示意图
2.2 应用于生物相互作用研究
色谱过程的本质是基于溶质、固定相与流动相之间的相互作用。当生物色谱兴起后,很快被用于生物分子之间的相互作用分析,应用范围涉及药物分子构效关系、靶点结合验证、结合解离动力学分析、蛋白关键作用位点研究等。James 和Philips 提出的前沿色谱法( frontal affinity chromatography)被广泛用于研究蛋白-配体间的相互作用,可同时了解药物蛋白结合情况和测定药物-蛋白平衡解离常数和生物利用度等药动学参数[38]。当色谱走向微型化后,相互作用分析从小分子药物-大分子拓展至大分子之间的作用分析,联合蛋白质组学技术,对蛋白关键作用位点的探测和构效关系研究,通过相互作用能力分析进行多肽及抗体类药物开发等前沿应用正处于快速发展阶段[39-40]。
3 总结与展望
生物色谱作为一种体外分析手段,在发展进程中将始终围绕着两个核心:①开发更好地模拟生物环境、适用性更佳、特异性更高的新型生物色谱固定相;②建立低生物用量、高灵敏度、功能化更全面的生物色谱分析系统。两者相互推进发展,最终建立起令人满意的分析策略。以下列举两点生物色谱分析方法学的新思路:
3.1 发展基于整体柱的生物色谱固定相
填充生物色谱柱的最大困难依然在于固定相制备困难,色谱柱性能不够稳定[41]。整体柱是一种利用有机或无机聚合方法在色谱柱内进行原位合成,形成连续床固定相的色谱柱。与填充柱相比,其优越的多孔性能、良好的重现性和机械强度使其具有更稳定的色谱行为和更高效的分离性能,因有望克服传统色谱分离介质的局限性而备受关注[42-44]。Svec 教授认为[45],新型功能化整体柱的开发是当下整体柱发展的主流。随着多肽、蛋白质、DNA 等各种生物大分子成功发展成为整体柱固定相材料,基于整体柱的生物色谱系统已广泛应用于复杂样品的分离纯化、小分子及抗体药物的筛选、蛋白与配体间的相互作用以及糖蛋白/磷酸化蛋白组学分析等多个生物领域[46]。近年来,暨南大学江正瑾课题组发展了仿生磷脂膜整体柱以及类磷脂膜整体柱[47],即通过在柱内键合脂质膜或柱后衍生化使得固定相表面暴露磷脂链来模拟细胞膜微环境,用于药物研发以及药物与细胞膜之间的相互作用研究[47]。总之,整体柱固定相制备过程简单,且因其优越的固定相性能,整体柱的通量与分析速度相比传统填充色谱有了很大提高,有望克服传统生物色谱固定相制备和应用中的不足,成为近年来新药研发和色谱研究领域的热点之一[43,48]。
3.2 发展微型液相生物色谱分析系统
新药研发、蛋白质组学分析、中药复杂成分分析等前沿领域的快速发展,对分析检测方法的灵敏度、样品通量等都提出了更高的要求。而且,对于生物色谱而言,生物材料往往获取不易,十分珍贵,常规色谱系统在生物领域的适用性上面临着很大挑战。Nano 液相色谱分析系统是现阶段实现低生物用量、高灵敏度分析的重要手段[49-50],为新型生物色谱固定相的开发提供了有利条件。本课题组曾在nano 色谱柱中装填细胞膜及仿生膜色谱固定相,实现了nano 液相色谱串联三重飞行时间质谱用于中药活性成分的筛选分析。此外,nano 液相能够更方便地与各种质谱联用,降低了对样品量的限制,将为多肽药物的筛选、生物大分子之间相互作用分析、蛋白组学分析等提供广阔的应用前景。
