PET/CT代谢参数及临床特征用于诊断非小细胞肺癌表皮生长因子受体基因突变
2022-05-25孙艺珊
李 珅,王 璐,孙艺珊,辛 军
(中国医科大学附属盛京医院核医学科,辽宁 沈阳 110004)
肺癌发病率和死亡率均高居恶性肿瘤前列,其中约85%为非小细胞肺癌(non-small cell lung cancer, NSCLC)[1];早期NSCLC症状隐匿,多数患者就诊时已错失根治性手术机会。表皮生长因子受体(epidermal growth factor receptor, EGFR)基因突变为NSCLC最常见的基因突变。研究[2]表明,酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)可延长晚期NSCLC伴EGFR突变患者的总生存时间。病理是诊断EGFR突变的金标准,但穿刺活检有创,可能引发气胸等并发症,且部分患者无法耐受[3]。18F-FDG PET/CT成像已广泛用于诊断NSCLC及评估疗效。前期研究[4-5]发现,EGFR突变型与野生型NSCLC的最大标准摄取值(maximum standard uptake value, SUVmax)、肿瘤代谢体积(metabolic tumor volume, MTV)及病灶糖酵解总量(total lesion glycolysis, TLG)存在明显差异,且女性、腺癌及无吸烟史NSCLC患者发生EGFR突变的概率更高[6-7]。本研究观察PET/CT代谢参数和临床特征用于诊断NSCLCEGFR突变的价值。
1 资料与方法
1.1 研究对象 回顾性分析2018年1月—2021年6月127例于中国医科大学附属盛京医院接受PET/CT检查的经病理确诊NSCLC患者,男62例,女65例,年龄36~83岁,平均(60.9±8.6)岁;随机抽取15例(EGFR突变型7例、野生型8例)为验证集,将其余112例按7∶3比例随机分为训练集(n=77)及测试集(n=35),并根据EGFR基因检测结果分为突变型组(n=55)及野生型组(n=57)。纳入标准:①检查前未接受抗肿瘤治疗;②于检查前或后2周内接受EGFR基因检测;③原发灶最大径≥1 cm。排除标准:①合并其他恶性肿瘤;②肿瘤邻近纵隔,或因边界不清等难以准确测出代谢参数。检查前患者均签署知情同意书。
1.2 仪器与方法 检查前嘱患者禁食6 h以上,控制其空腹血糖<11.10 mmol/L。经静脉注射18F-FDG 3.70~5.55 MBq/kg后,嘱患者安静休息1 h。采用 GE Discovery Elite PET/CT扫描仪,GE MINI trace Ⅱ回旋加速器生产的18F-FDG,放射化学纯度>95%。嘱患者仰卧,扫描颅顶至股骨中段水平;CT参数:管电压140 kV,自动管电流(180~240 mA),层厚3.75 mm;PET参数:3D采集模式,层厚3.75 mm,每个床位采集1.5 min,依据患者身高采集6~7个床位。采用三维有序子集期望最大化算法重建PET/CT图像,迭代2次后上传至GE AW 4.6工作站。
1.3 图像分析 由核医学科具有1年PET/CT操作经验的医师和具有5年工作经验的主治医师各1名于AW工作站采用半自动方法测量NSCLC原发灶的SUVmax,并以40% SUVmax为阈值对原发灶进行容积分割,得到平均标准摄取值(mean standard uptake value, SUVmean)和MTV并计算TLG:TLG=MTV×SUVmean[8];意见不一致时,提请具有15年工作经验的核医学科副主任医师进行判断。
1.4 统计学分析 采用SPSS 25.0统计分析软件。以±s表示符合正态分布且方差齐的计量资料,采用两独立样本t检验;以中位数(上下四分位数)表示非正态分布的计量资料,采用非参数秩和检验;以频数表示计数资料,采用Pearsonχ2检验或Fisher精确概率法。采用GE IPM statistics V 2.3.0(IPMs),以单因素和多因素logistic回归分析筛选参数以构建诊断模型,并进行5次交叉验证。以活检或手术病理结果为金标准,绘制训练集及测试集受试者工作特征(receiver operating characteristic, ROC)曲线,评估模型诊断EGFR突变的效能;最后将模型载入IPMs“Predict or radscore”模块,输入内部验证集数据,以EGFR基因检测结果为参考标准,评估模型诊断EGFR突变的准确率。P<0.05为差异有统计学意义。
2 结果
突变型组女性及腺癌占比均高于野生型组(P均<0.05),而原发灶最大径、MTV及TLG均小于野生型组(P均<0.05)。见表1及图1、2。
以TLG、MTV、SUVmax和SUVmean诊断NSCLCEGFR突变的ROC曲线下面积(area under the curve, AUC)分别为0.68、0.66、0.63和0.63。见图3。
经单因素logistic回归分析筛选后,初步获得MTV、TLG和性别3个参数;再经多因素logistic回归分析,最终保留TLG和性别2个参数,绘制预测NSCLCEGFR突变风险的列线图(图4)并建立模型;该模型在训练集诊断EGFR突变的AUC为0.72、准确率为67.53%(52/77),在测试集的AUC为0.67、准确率为71.43%(25/35),见表2和图5,在验证集诊断NSCLCEGFR突变的准确率为66.67%(10/15)。
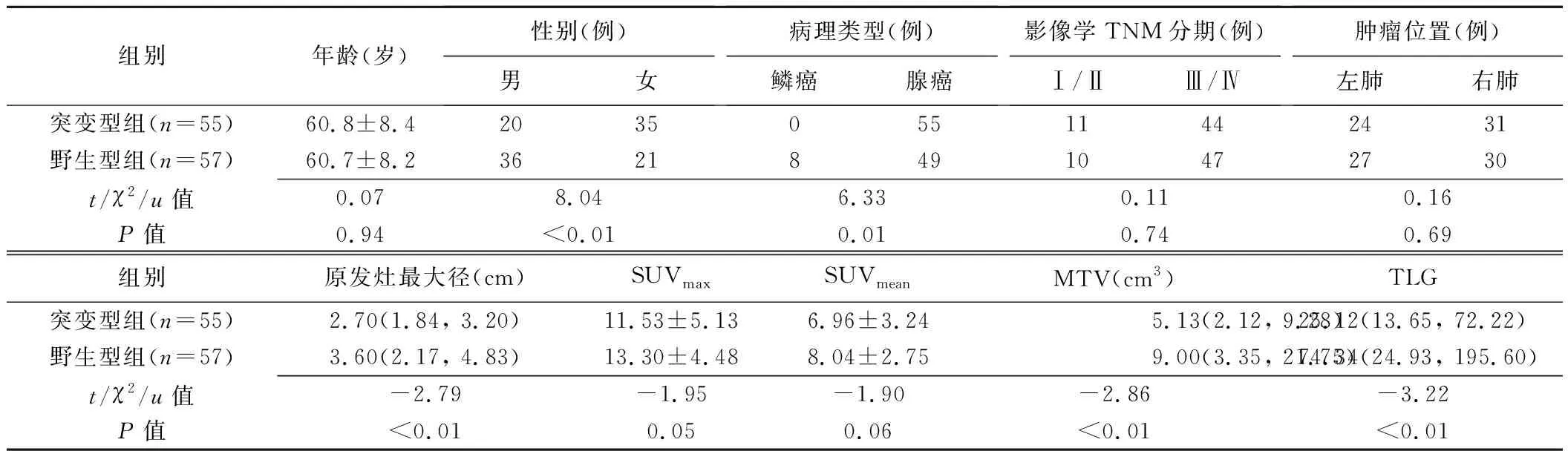
表1 训练集及测试集112例EGFR突变型与野生型NSCLC患者临床特征和PET/CT代谢参数比较
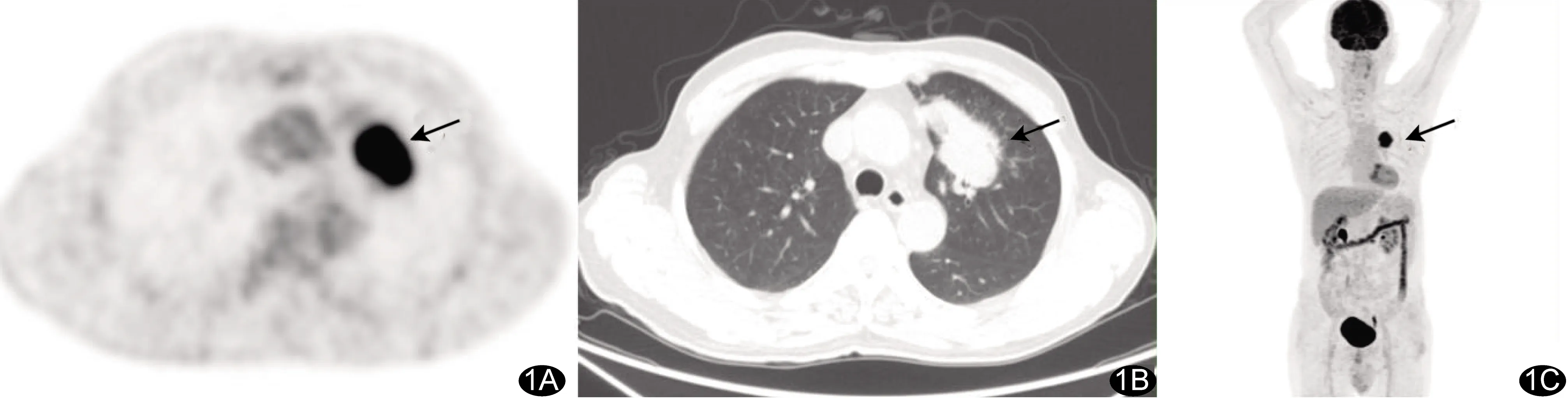
图1 EGFR野生型NSCLC患者,男,63岁 A.PET图示左肺上叶高代谢肿块(箭),SUVmax=10.75,SUVmean=7.31,MTV=28.34 cm3,TLG=207.17; B.CT图示左肺上叶4.5 cm×3.4 cm病灶(箭); C.全身最大密度投影(maximum intensity projection, MIP)图示左肺上叶病灶(箭),影像学TNM分期为Ⅳ期
图2 EGFR第19号外显子缺失突变型NSCLC患者,女,49岁 A.PET图示左肺上叶高代谢结节(箭),SUVmax=20.30,SUVmean=12.93,MTV=4.17 cm3,TLG=53.92; B.CT图示左肺上叶2.8 cm×2.0 cm病灶(箭); C.全身MIP图示左肺上叶病灶(箭),影像学TNM分期为Ⅳ期
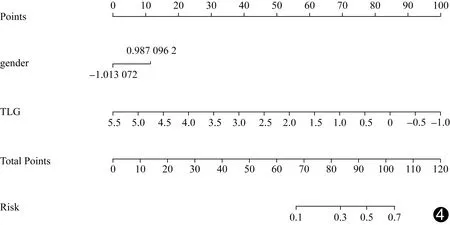
图4 预测NSCLC EGFR突变风险列线图 对TLG和性别(gender)进行标准化处理并重新赋值,各绘制一条横轴线,并在横轴线上找到每例患者的对应值;以该点为起点,向上绘制一条垂直线至分数值(Points)轴线,得出TLG和性别的分数,并在总分数值(Total Points)轴线上找到二者分数相加之和的值,以该点为起点,向下绘制一条垂直线至风险系数(Risk)轴线上,该对应系数代表NSCLC患者发生EGFR突变的风险
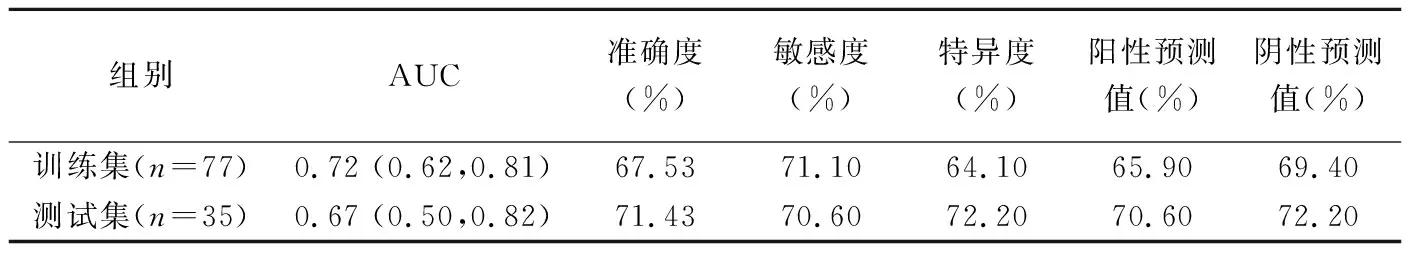
表2 以TLG及性别构建的诊断模型诊断训练集及 测试集NSCLC EGFR突变的效能

图3 PET/CT代谢参数诊断NSCLC EGFR突变的ROC曲线
3 讨论
近年来,对于NSCLC已进入靶向治疗的新时代。EGFR-TKIs可延长NSCLC伴EGFR突变患者的无病生存期及总生存期[9],而EGFR野生型NSCLC患者则获益不大[10],使得快速鉴别靶向治疗获益人群至关重要。
PET/CT已广泛用于诊断NSCLC及评估疗效。已有学者观察PET/CT代谢参数反映NSCLCEGFR突变的能力,如CHO等[11-12]发现EGFR突变型组SUVmax显著低于野生型组。本研究突变型组与野生型组患者SUVmax差异无统计学意义,与CAICEDO等[13]的结论一致;分析原因,可能在于SUVmax多反映肿瘤组织代谢最活跃处的18F-FDG摄取值,其用于诊断EGFR突变的效能易受患者个体差异、采集设备和样本量等因素影响。相比SUVmax,体积代谢参数TLG和MTV能更好地反映肿瘤代谢状况。本研究发现突变型组女性及腺癌占比均高于野生型组,而原发灶最大径、MTV及TLG均小于野生型组,与CHANG等[14]的结果基本一致。
YANG等[15]结合MTV与吸烟史构建模型,其诊断NSCLCEGFR突变的AUC为0.70。LV等[16]根据SUVmax、吸烟史、性别及病理类型建立模型,其诊断NSCLCEGFR突变的AUC约为0.70。姜阳等[17]则以MTV、SUVmax、性别及原发灶最大径构建模型,其诊断NSCLCEGFR突变的AUC为0.78,准确率为73.30%。本研究对PET/CT代谢参数和临床特征进行多重筛选,最终选取TLG和性别构建模型,诊断训练集、测试集EGFR突变的AUC分别为0.72、0.67,准确率为67.53%、71.43%;AUC均低于0.80,可能与样本量小及ROI选取有关。内部验证结果显示,该模型诊断验证集NSCLCEGFR突变的准确率为66.67%(10/15),表明其稳定性和可重复性均较好。
本研究的主要局限性:①为回顾性研究,且样本量小;②难以避免医师主观因素对于测量结果的影响;③未分析吸烟史及血清肿瘤标记物等临床数据;④所获模型缺乏外部数据验证。
综上所述,PET/CT代谢参数如TLG和临床特征如性别等可用于诊断NSCLCEGFR突变。

图5 以TLG和性别诊断模型诊断NSCLC EGFR突变的ROC曲线 A.训练集; B.测试集
