南方红豆杉菌根紫杉醇含量及其菌根菌组分离纯化和种属鉴定
2022-05-25彭凤珍杜亚填周春长龚雪元
彭凤珍,杜亚填*,周春长,龚雪元
1吉首大学 林产化工工程湖南省重点实验室,张家界 427000;2浙江大学基础医学院,杭州 310000;3基蛋生物科技股份有限公司,南京 210044
菌根是土壤真菌与植物根的共生体,菌根真菌作为一类能与绝大多数植物根系建立互惠共生体的有益微生物,相关研究多集中其特定的形态结构和功能等方面。菌根真菌菌丝体侵染宿主植物尚未木栓化的根部,在根尖表面形成菌套,根皮层内形成哈蒂氏网,根外形成外延菌丝等特征性结构[1],其具有促进植物的生长发育,增强植物的抗逆性和抗病性,提高植物吸收利用矿质元素(尤其是N、P)能力等功能[2],还可以通过在根际土壤和根皮层细胞间形成密集的菌丝网来扩大植物根系吸收面积、提高水分利用率、促进矿质营养元素的吸收和利用、改善体内碳循环、影响植物的初生代谢和次生代谢等[3]。菌根真菌与陆地大多数植物形成密切的共生关系,且不同真菌可以同时入侵单个根片段[4],除了上述生物学与生理生态学作用外,其还影响、参与植物根系的次生代谢,但相关研究报道甚少。
南方红豆杉(Taxuschinensisvar.mairei)为国家一级保护植物,是红豆杉分布在我国的1个变种,属第四纪冰川孑遗物种,主要分布在长江流域以南。红豆杉属的植物目前是世界上公认濒临灭绝的天然珍稀抗癌植物,其根、茎、叶中均含有天然抗癌药用成分紫杉醇及其前体物10-DABⅢ等紫杉烷类化合物[5]。因此,为寻求新的药源,关于南方红豆杉内生真菌的研究报道较多[6,7],但关于南方红豆杉菌根真菌的研究报道极少。张翔宇等研究紫杉醇在南方红豆杉植物各器官组织中含量分布时发现[8],须根中紫杉醇含量最高,为0.101%,之后龚雪元等[9]进一步研究发现须根中有部分菌根,经分离培养,从菌根组织中获得21株菌根真菌,经液体发酵纯培养发现,其中4株产10-DABⅢ,但不产紫杉醇,6株产紫杉醇,但不产10-DABⅢ,但21株菌根真菌未进行种属鉴定。本课题对菌根进行解剖后发现中心部位呈现出一红色结构区(见图1),该结构区外均为薄壁细胞,解剖剥离出红色结构区发现其为原始根组织,经检测研究发现其中紫杉醇含量为0.209%,比须根高0.065%。本课题还进行了南方红豆杉菌根真菌与其茎段愈伤组织互作培养,发现互作之后愈伤组织的紫杉醇含量大幅度提高。菌根套是菌根相对普通须根所增加的唯一关键组织解剖学结构,所以菌根套中的菌根真菌应是菌根原始根组织中紫杉醇高积累量的关键作用因素,为了揭示二者间的相关性,本课题重启组织培养法分离纯化南方红豆杉菌根真菌研究,拟利用形态学观测加分子生物学技术进行该菌根真菌的种属鉴定,以期获得相关性机制方面的信息,结果与相关文献[10-12]的研究报道相对比发现,南方红豆杉菌根真菌的种属多样性与南方红豆杉植物其他各器官组织中内生真菌生物多样性间存在较大差异,表明南方红豆杉菌根真菌种属的特异性可能与其原始根中紫杉醇高含量间存在相关性,这对紫杉醇生物合成存在多样性生物参与、菌根真菌与植物互作生产次生代谢产物的研究具有非常重要的科学意义。

图1 南方红豆杉菌根
1 材料与方法
1.1 实验材料
南方红豆杉新鲜菌根、须根于2020年12月在吉首大学张家界校区后山林产化工工程湖南省重点实验室红豆杉课题组南方红豆杉种植基地中挖取。
南方红豆杉茎段愈伤组织,菌根真菌混合菌与茎段愈伤组织互作的茎段愈伤组织(林产化工工程湖南省重点实验室红豆杉课题组培养提供)(见图2)。

图2 南方红豆杉菌根真菌与愈伤组织互作后的形态特征
1.2 培养基、主要试剂和仪器
E固体培养基:MS培养基(无激素)、1 g/L水解酪蛋白、0.5 g/L酵母浸膏、100 mL/L土豆煮滤液(100 g鲜土豆小块,加水500 mL,煮沸30 min,过滤收集滤液即得)、12 g/L琼脂、30 g/L蔗糖,pH5~6。上述培养基于121 ℃、1×105Pa灭菌30 min后倒平板备用。
主要试剂:RNA酶(捷瑞,上海);蛋白酶(Merck,德国);2×Taq Mix(BioLinker,上海);DNA Marker(DL9000 欣百诺,DL2000 Takara);琼脂糖(molecular biology grade, 翌圣);AxyPrepDNA凝胶回收试剂盒(AXYGEN,USA);紫杉醇(坛墨质检-标准物质中心,批号CU4F-A802,质量分数大于98%)。
主要仪器:LC-1260高效液相色谱(美国安捷伦);1260 Infinity二级管阵列检测器;Waters Symmetry C18分析柱(250 mm ×4.6 mm ×5 μm,美国沃特世公司);YB-150T型多功能粉碎机(永康市速锋工贸有限公司);R-215旋转蒸发仪(德国海道夫);XO-5200DT超声波清洗器(南京先欧仪器制造有限公司);超净工作台(BCM-1000A,苏州安泰空气技术有限公司);立式自动压力蒸汽灭菌器(GI54DWS,厦门致微仪器有限公司);生物显微镜(CX-31,日本尼康);电泳仪和凝胶成像仪(Bio Rad,美国);PCR仪(ABI9700,美国);测序仪(ABI3730,美国)。
1.3 紫杉醇含量检测
1.3.1 材料预处理
新鲜菌根,洗净,用解剖针、细尖嘴镊将菌根套组织从菌根的原始根组织(其上有薄红色表皮)上剥离下来,将菌根分成菌根套组织和原始根组织两部分,40 ℃下烘干,分别粉碎,过60 mm筛后避光干燥保存备制检测制样用。
新鲜须根和侧根,洗净,于40 ℃下烘干后直接粉碎过60 mm筛,避光干燥保存备制检测样用。
茎段愈伤组织于40 ℃下烘干后直接粉碎过60 mm筛,避光干燥保存备制检测样用。
选取与菌根真菌混合菌互作10天的茎段愈伤组织,于40 ℃下烘干后直接粉碎过60 mm筛,避光干燥保存备制检测样用。
1.3.2 供试品检测样的制备
准确称取上述各种材料的干燥样品各1.000 g,同时另取相同材料检测含水量,菌根套、菌根原始根组织、须根、侧根和茎段愈伤组织(未互作和互作的愈伤组织)干燥材料中的含水量分别为:α1=(4.11±0.11)%,α2=(6.66±0.17)%,α3=(15.11±0.24)%,α4=(8.38±0.30)%,α5=(2.78±0.15)%,α6=(2.56±0.17)%(均为5次重复的平均值)。之后将准确称取的材料分别置于100 mL三角瓶中,各加入40 mL甲醇,超声提取1 h,静置充分澄清后收集上清液,沉淀复加等体积甲醇,重复操作3次,合并上清液,过滤除渣,滤液于40 ℃减压蒸干,先用适量的甲醇溶解,再用30 mL二氯甲烷复溶,用二氯甲烷∶水=2∶1(V/V)萃取,重复3次。弃去水相,合并三次二氯甲烷相,40 ℃减压浓缩,后用少量甲醇(色谱级)充分洗出浓缩瓶中固形物于2 mL容量瓶中定容,最后用0.45 μm微孔膜过滤至Tube管中,置于冰箱中冷藏备检测用。
1.3.3 对照品溶液的制备
精密称取紫杉醇对照品10.00 mg,置于5 mL容量瓶中,用甲醇(色谱级)溶解并定容制成标准溶液备用。
1.3.4 色谱条件及梯度洗脱方案
检测波长227 nm,进样量20 μL,流速1 mL/min,柱温30 ℃。用乙腈和磷酸水为流动相进行梯度洗脱,即乙腈(A)∶0.01%磷酸水(B)为:0~10 min,20%→40% A;10~14 min,40%→50% A;14~25 min,50% A;25~26 min,50%→100% A;26~30 min,100% A;30~35 min,100%→20% A。
1.3.5 标准曲线绘制
分别精密吸取紫杉醇对照品标准液0.02、0.06、0.1、0.4、0.6、0.8、1.0 mL于1 mL容量瓶中,用色谱级甲醇定容至1 mL,按“1.3.4”依次进样检测。以紫杉醇浓度y(mg/mL)为函数,峰面积值x为自变量,绘制标准曲线,建立回归方程:y=7.06×10-5x+0.004 8(R2=0.999 4,n=7),表明紫杉醇在0.04~2 mg/mL浓度范围内浓度与峰面积值之间具有良好的线性关系。
1.3.6 精密度试验
以2 mg/mL紫杉醇对照品标准液为检测样,按“1.3.4”重复检测5次,测得峰面积值分别为27 435.4、28 748.6、28 254.9、27 638.3、29 190.8,其RSD值为2.61%。
1.3.7 重复性试验
精确称取“1.3.1”制取的南方红豆杉须根干粉末5份,各1.000 g,分别按“1.3.2”方法制备成检测样,按“1.3.4”进样检测,分别测得紫杉醇的峰面积值为11 001.9、10 810.5、11 269.4、11 542.3、11 727.4,其RSD值为3.32%。
1.3.8 稳定性试验
用已知浓度为1.6 mg/mL紫杉醇对照品标准液,按“1.3.4”方法分别于0、4、8、12、24 h后进样检测,测得紫杉醇峰面积值分别为23 363.2、22 011.3、23 667.7、22 594.5、21 312.5,其RSD为4.27%,结果表明供试品溶液在24 h内稳定。
1.3.9 加样回收率试验
准确称取按“1.3.1”中方法制取的南方红豆杉菌根干粉样品5份,每份1.000 g,分别加入浓度0.2 mg/mL紫杉醇对照品标准溶液各1.00 mL,然后按“1.3.2”方法制备检测样,按“1.3.4”方法进样检测紫杉醇含量,得紫杉醇的加样回收率为84.68%(平均值,RSD值为1.70%)。
1.4 菌根真菌的分离与纯化
将新采集菌根充分冲洗,用软毛刷轻微擦拭去除菌根表面的泥土和杂质,后置于锥形瓶中,加入适量蒸馏水震荡清洗,然后于无菌工作台中夹出剪切成0.5 cm小段,置于无菌瓶中,用70%酒精浸泡10 s后倒掉酒精,再改用无菌水反复震荡清洗20次,取出菌根段置于无菌培养皿中备接种用。取少量最后一次清洗液,备作材料表面非菌根菌残留排除接种用。
用解剖刀将上述经无菌水反复清洗灭菌后的菌根段切成1~2 mm薄片,接种于E固体平面培养基上,于26 ℃恒温箱中培养,每天仔细观察,只要薄片上有菌落点出现便立即挑取转接于固体斜面培养基上扩增培养,3~7天后据菌落形态特征观察,若为单菌株菌落,则任其长满斜面,若为一个以上菌株,待菌落充分扩展后挑取菌落边缘菌丝捣碎、稀释,用接种环蘸取菌液于培养皿固体平面培养基上划线接种培养,待新的菌落点出现后立即转接,反复进行,直到获得显微观测形态特征单纯一致的菌株。
对照组:无菌吸取100 μL最后一次菌根清洗液,均匀涂布接种于E固体平板培养基上,于上述相同培养条件下培养3~7天后若出现菌落点,则立即用接种针将菌落点仔细无菌挑取转接于固体斜面培养基上,于上述相同条件下培养,备与上述所获菌株进行形态学比较,为非菌根菌排除对象。若未出现菌落点,说明上述分离纯化培养所获得菌株全为菌根菌。
1.5 菌株形态学观测分析鉴定
根据菌株在固体培养基上的生长状态、菌落颜色和菌丝是否有隔、分枝、大小、分生孢子等的光学显微形态观测,进行菌株种类的初步分析鉴别,并拍照记录。
1.6 菌株分子生物学分析鉴定
根据上述形态学观测所获得的初步分析鉴定结果,进一步采用分子生物学方法进行菌株的种属分析鉴定,采用蛋白酶K裂解的方法对各菌株基因组DNA进行抽提,分别各取3 μL进行单向凝胶电泳分离。即将纯化后的菌根真菌基因组DNA作为模板,选用通用引物ITS1-F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2-R(5′-TCCTCCGCTTATTGATATGC-3′),经PCR扩增后再在1%琼脂糖凝胶薄板中进行电泳分离,采用AxyPrepDNA凝胶回收试剂盒进行回收,在ABI3730测序仪上进行测序。
PCR反应体系:Biolinker 2×Taq Mix 20 μL,正反向引物(10 μM)各1 μL,模板DNA 20~50 ng,补充超纯水至40 μL。
PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃修复延伸5 min,10 ℃保持10 min。
1.7 数据分析
去掉测序结果起始和末端质量差的碱基,将序列和NCBI进行Blast比对,找到Identity最高的物种信息,作为该序列的物种信息,并得到他的Lineage。选择Identity最高的前10个物种信息,去掉比对上的重复的序列信息,利用Mega5.0软件对序列进行比对并通过邻接法构建系统发育进化树,最终得出菌株所属种属。
2 结果与分析
2.1 南方红豆杉根系及其茎段愈伤组织中紫杉醇的含量
经检测研究(见表1)发现,南方红豆杉菌根原始根组织中紫杉醇含量最高,为0.209%,比须根高0.065%,比侧根高0.046%,菌根套组织中紫杉醇含量较低,即南方红豆杉根系中紫杉醇积累量最高的组织解剖学结构是菌根中的原始根组织。进一步检测发现,南方红豆杉茎段愈伤组织中紫杉醇含量为0.037%,与菌根真菌共培养互作后的茎段愈伤组织紫杉醇含量为0.063%,是未互作的愈伤组织的1.72倍。结果表明,南方红豆杉菌根中原始根组织之所以能积累较高紫杉醇的含量,关键的生物学机制是菌根真菌与菌根套组织薄壁细胞间的互惠共生互作及其关系持续稳定的维持。

表1 南方红豆杉根各部位及愈伤组织中紫杉醇含量
2.2 南方红豆杉菌根真菌形态学与分子生物学种属分析鉴定及系统发育树
经分离纯化,从南方红豆杉菌根组织中共获得30个真菌菌株,其中编号为Myc-7、Myc-22的两菌株,经反复分离培养未能纯化而被淘汰,菌根材料表面灭菌处理最后一次菌根清洗液涂布培养无菌落产生,表明其余28个菌株均为菌根菌。经菌落、菌丝、子实体等的形态学结合光学显微观测(见图3)初步鉴定,Myc-15、Myc-19、Myc-20为同种菌株,因此最终确定所采样地内南方红豆杉菌根组织中的菌根菌株数为26株。基因组DNA经抽提、扩增、凝胶电泳(见图4、图5)、rDNA-ITS测序、与NCBI进行blast比对分析,相似度为99%~100%(见表2),结合《真菌鉴定手册》[13]《半知菌分属图册》[14]形态学鉴定,再运用Mega5.0软件中的 Neighbor-joining 法构建系统发育树(见图6)确定了菌株的系统发育地位,最后得出:26株菌根真菌种属分属3门6纲9目11科14属,其中92.308%的菌株属于子囊菌门(24株),3.846%的菌株属于半知菌亚门(1株),3.846%的菌株属于担子菌门(1株)。子囊菌门包括以曲霉属(Aspergillus,5株)、木霉菌属(Trichoderma,5株)为优势10菌株和镰孢霉属(Fusarium)、青霉属(Penicillium)、Cylindrodendrum属、小帚梗柱孢属(Cylindrocladiella)、螺旋聚孢霉属(Clonostachys)、炭角菌属(Xylaria)、枝孢霉属(Cladosporium)、棒孢属(Corynespora)、Paraboeremia属、无柄盘菌属(Pezicula)的真菌。半知菌亚门仅刺盘孢属1属(Colletotrichum)。担子菌门也仅烟管菌属1属(Bjerkandera)。
2.2.1 菌株形态学分析
Cylindrodendrum:菌株Myc-1(见图3)菌株为Cylindrodendrum属,E培养基培养7~8天长满整个培养基,显出绒毛状的毡状气生菌丝体,培养基上的颜色从白色变为黄色,最后变为深棕色。菌丝非常粗有分枝且有横隔,分生孢子梗轮状分枝,分生孢子卵圆形。

图3 南方红豆杉菌根真菌各菌株的形态学特征
小帚梗柱孢属(Cylindrocladiella):菌株Myc-2、Myc-13为小帚梗柱孢属,在E培养基培养5~6天长满整个培养基,菌面湿润,菌落呈褐色,气生菌丝白色。菌丝无色、分枝、有分隔。分生孢子梗呈青霉状分枝,分生孢子圆柱形。
镰孢霉属(Fusarium):菌株Myc-15、Myc-16、Myc-17为镰孢霉属,在E培养基培养3~4天长满整个培养基,菌丝在培养基上扩展呈棉絮状。菌株Myc-15气生菌丝为白色,培养基上有粉红色渗出物;菌株Myc-16气生菌丝为白色,培养基上有紫红色渗出物;菌株Myc-17菌落呈紫红色,有黄色渗出物。菌丝分枝不规则或着生一圈小梗,在孢子座上单生或成群生,且分生孢子梗不一。大型分生孢子包含几个细胞,典型的镰刀形;小型分生孢子为单胞呈卵圆形,单个着生或成链。
螺旋聚孢霉属(Clonostachys):菌株Myc-18为螺旋聚孢霉属,在E培养基黑暗培养3~4天长满整个培养基,菌落在培养基上扩展呈白色丝状。分生孢子梗是帚状分枝,有少量的厚垣孢子产生,分生孢子为椭圆形。
木霉菌属(Trichoderma):菌株Myc-24、Myc-26、Myc-27、Myc-28为木霉菌属,菌株Myc-24、Myc-28在E培养基培养3~4天长满整个培养基,而菌株Myc-26、Myc-27在E培养基培养5~6天长满整个培养基。4株菌株最终形成毡状、柔毛状、羊绒状和蛛网状的气生菌丝,菌落颜色从无色到浅黄色、绿色、琥珀色或者黄绿色。其分生孢子梗连续重复多次分枝,排列成树状结构,分生孢子为单细胞呈椭球形。
炭角菌属(Xylaria):菌株Myc-30为炭角菌属,在E培养基培养7~8天长满整个培养基,菌落圆形分层呈短绒毛状白色气生菌丝。菌丝分枝,侧枝线形,顶端常变厚并呈顶环构造,且气生菌丝顶端横隔分裂形成链状孢子。子囊单囊壁壁薄,子囊孢子单胞呈卵形或椭圆形。
青霉属(Penicillium):菌株Myc-4、Myc-12为青霉属,在E培养基培养3~4天长满整个培养基。菌落圆形生长,表面湿润。菌株Myc-4菌落为军绿色,反面呈黄色;菌株Myc-12菌落为深橄榄绿色,反面呈菊黄色。分生孢子梗自菌丝单个地发生或不常成束,在顶部附近分枝,末端生小梗,分生孢子球形或卵圆形。
曲霉属(Aspergillus):菌株Myc-3、Myc-5、Myc-6、Myc-10、Myc-11为曲霉属,在E培养基培养3~4天长满整个培养基。菌落是圆形,中间略凸,初为白色,后渐变为棕色,最后变为黑色,菌落反面呈淡黄色。分生孢子梗由一根直立的菌丝形成,菌丝的末端形成球状膨胀(顶囊),分生孢子为球形,于顶囊处呈串链生长。
枝孢霉属(Cladosporium):菌株Myc-8为枝孢霉属,在E培养基培养3~4天长满整个培养基。其菌落颜色从橄榄绿到啡黑色,背面为黑色,质地的变化由柔软到粉末状再到羊毛样,菌落的生长方向从中央向四周分散。菌丝为细枝状分枝且有隔,有分生孢子梗,分生孢子成串状并呈顶端生长。
棒孢属(Corynespora):菌株Myc-9为棒孢属,在E培养基培养3~4天长满整个培养基。菌落黄卡其色,圆形生长,中心有凸起,背面呈墨绿色。菌丝无隔膜,分生孢子梗长且单身,极少有分枝,呈圆柱状,分生孢子圆形。
Paraboeremia:菌株Myc-14为Paraboeremia属,在E培养基培养7~8天长满整个培养基。菌落灰橄榄色呈圆形生长,絮状气生菌丝。菌丝有隔有分枝,分生孢子器壁拟薄壁组织状黑棕色,翁形或近球形,单生。分生孢子为单胞,圆柱形或椭圆形。
无柄盘菌属(Pezicula):菌株Myc-23为无柄盘菌属,在E培养基培养3~4天时菌落白色,7天时长满整个培养基菌落,呈灰色棉絮状。菌丝有分枝有隔,产生圆柱状或进球状厚垣孢子,分生孢子呈卵圆形。
刺盘孢属(Colletotrichum):菌株Myc-29为刺盘孢属,在E培养基培养5~6天长满整个培养基。菌落圆形生长,背面呈黄色,菌丝有分枝有隔。球形分生孢子堆,分生孢子单胞,无隔无色,长椭圆形,产于瓶状小梗上,萌发后产生附着胞。
烟管菌属(Bjerkandera):菌株Myc-21为烟管菌属,在E培养基培养5~6天长满整个培养基。菌落圆形,边缘平整,呈白色绒毛状。菌丝呈树状分枝,具有锁状联合孢子球形。
2.2.2 菌株分子生物学分析
采用蛋白酶K裂解方法抽提的基因组DNA,各取3 μL点于1%琼脂糖凝胶板上,经电泳后得到的各菌株基因组DNA琼脂糖凝胶电泳图(见图4)显示,各样本基因组间存在明显差异,形态学观测结果得到验证。
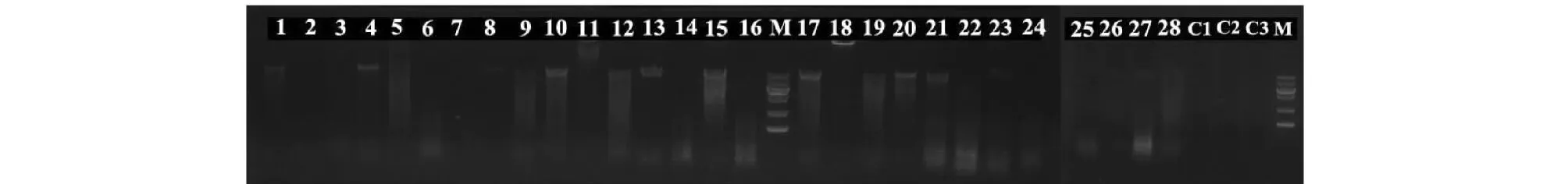
图4 各菌株基因组DNA琼脂糖凝胶电泳图
样本基因组DNA的PCR产物(各取3 μL)于1%琼脂糖凝胶上样电泳后的结果(见图5)表明:ITS片段条带单一,大小正确,浓度适中,可用于测序。

图5 各菌株rDNA-ITS片段PCR扩增后的琼脂糖凝胶电泳图
ITS片段大小约为600 bp,由于测序起始端测序质量较差,所以我们去除质量较差的序列后得到了测序结果,经与NCBI进行Blast比对分析,相似度为99%~100%(见表2),再运用Mega 5.0软件中的Neighbor-joining 法构建系统发育树(见图6),确定了被测菌株的系统发育地位,最终获得了26株菌株的种属结果(见表2)。

表2 南方红豆杉菌根真菌rDNA-ITS序列与相近菌株相似性比对

续表2(Continued Tab.2)
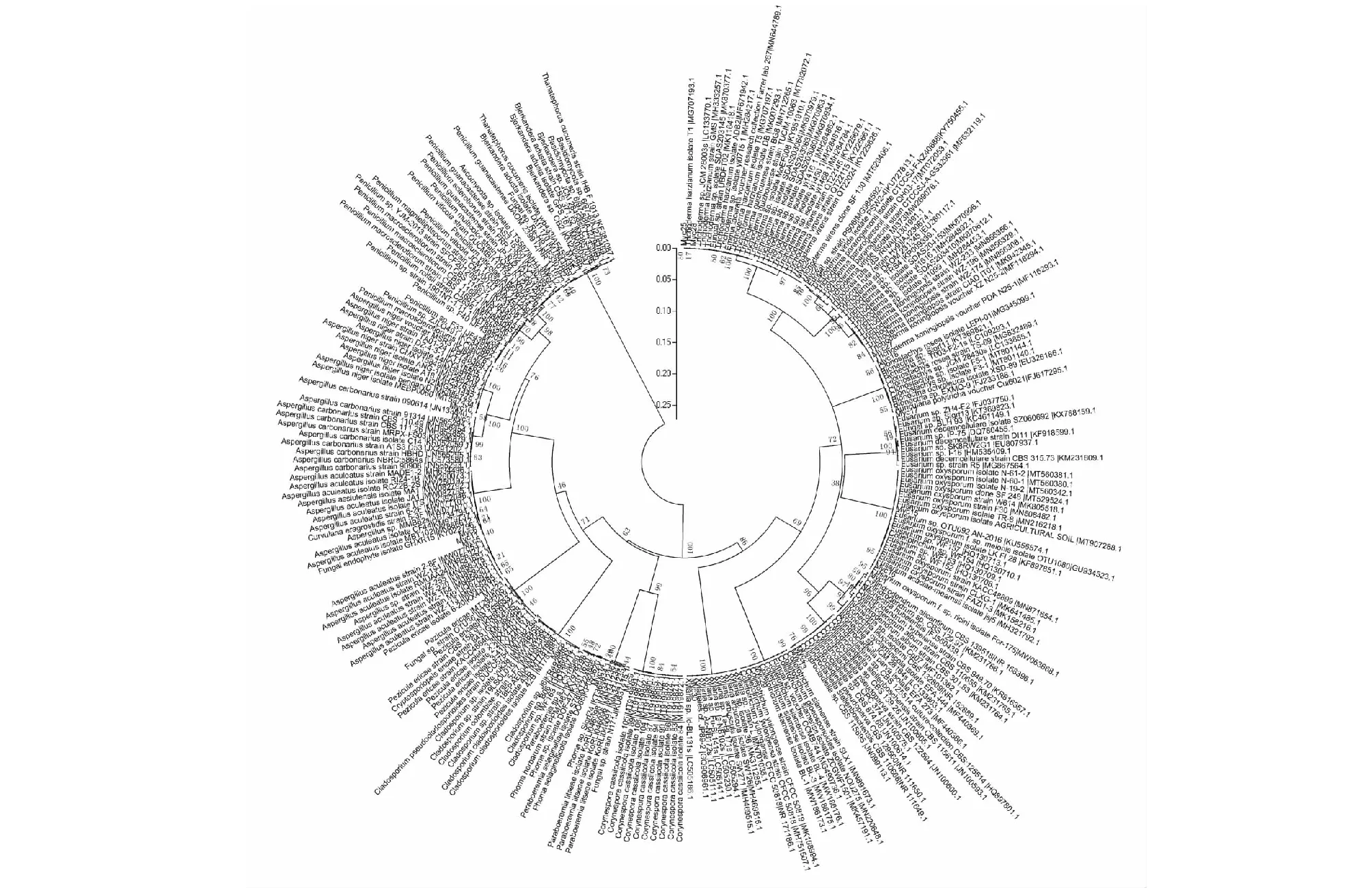
图6 菌株系统发育树
3 讨论与结论
全球红豆杉属植物有11种,包括1个变种和1个杂交种,其中有9种红豆杉属植物内生真菌具有产生紫杉醇的能力[15]。Li等[16]用产紫杉醇内生真菌培养液与东北红豆杉悬浮培养细胞进行共培养处理,结果显示其不仅可提高紫杉醇的释放率,而且不会引起东北红豆杉细胞膜的明显伤害,说明内生真菌发酵液可能具有激活紫杉醇主动运输相关酶类的功能活性。也有研究表明榛树细胞与菌株的共培养也有效,其中真菌接种量和共培养时间是在该共培养系统中实现紫杉醇最大产量的重要因素[17]。但内生真菌与红豆杉细胞在紫杉醇生物合成过程中究竟是怎样的生物学关系,一直未见有明确的报道,Gong等[9]报道了南方红豆杉菌根菌具有产紫杉醇和10-DABⅢ的能力,但经继代培养后即快速衰减直至消失,故菌根菌与菌根原始根组织中较高紫杉醇含量间的相关机制,仍然具有深入研究的价值。
有专著将红豆杉植物定为内生菌根植物[18],并指出南方红豆杉可与丛枝菌根真菌形成丛枝-囊泡型菌根。孢子的形态多样性不足以揭示生态系统中真菌的实际多样性,在菌根真菌研究中应用分子生物学技术,可使其分类多样性显著增加,研究表明种群内甚至单个孢子内的遗传多样性都很高[19]。此外,有证据表明,菌根真菌群落组成的差异可能对植物产生不同的影响,并在决定植物多样性、生态系统多样性和生产力方面发挥潜在的作用[20]。本研究结果显示,南方红豆杉菌根具有不同于其他器官组织内生真菌[10-12]的菌群,其原始根组织中有远高于普通根及其他器官组织的紫杉醇含量,且愈伤组织与菌根菌互作可提高其紫杉醇含量。因此,菌根菌与南方红豆杉根细胞在紫杉醇生物合成过程中的互作协同机制,是非常值得研究的重要方向,这对菌根菌的开发利用和天然有机功能活性化合物的高效绿色生产等具有非常重要的科学意义和应用价值。
