基于UHPLC-Q-Orbitrap HRMS的不同年限陈皮入血成分分析
2022-05-25申梦园陈鸿平刘友平
吴 蓓,申梦园,王 福,陈鸿平,刘友平,陈 林
成都中医药大学药学院 西南特色中药资源国家重点实验室,成都 611137
陈皮为芸香科植物橘CitrusreticulataBlanco及其栽培变种的干燥成熟果皮[1],自古认为产自广东新会的陈皮质量较优。传统上认为其有理气健脾、燥湿化痰之功,用于治疗脘腹胀满、食少吐泻、咳嗽痰多等症[1]。陈皮主要含有黄酮、挥发油、生物碱、柠檬苦素等类化学成分[2],现代药理表明,其有降血脂[3]、抗氧化[4]等作用,并广泛应用于临床。
传统中医药理论认为陈皮应陈化后使用。但是,对于陈皮具体陈化时间,历代本草书籍说法不一,《药鉴》载有“陈皮须用隔年陈”,又称“陈皮必须年久者为美”[5];《本草要略》云“陈皮隔年者方可用”;《日用本草》载:“陈皮多年者更妙”。即使是同一古籍,对于陈皮陈化时间尚未明确。现代对陈皮陈化年限的研究多从化学成分和药效作用比较方面,且多从体外对不同陈化时间广陈皮的化学成分进行研究。课题组前期已通过UHPLC-Q-Orbitrap HRMS技术对不同陈化时间的广陈皮中黄酮类成分进行分析。大多数中药仍通过口服给药方式应用,通过分析口服给药后血清中化学成分,确定中药的体内直接作用物质,成为快速、准确研究及确定中药药效物质基础的有效途径[6]。目前,对广陈皮体内成分鲜有报道。
本研究首次采用具有高分离度、高分辨率以及高灵敏度的超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(UHPLC-Q-Orbitrap HRMS)技术,对不同年份广陈皮进行入血成分比较研究,为广陈皮药效物质基础及药效学研究提供参考依据。
1 材料与方法
1.1 仪器
Q-Exactive型超高效液相色谱联用仪(美国Thermo公司);Agilent Extend-C18色谱柱(3.0 mm × 100 mm,1.8 μm),十八烷基键合硅胶为填充剂(美国Agilent公司);电子天平(上海民桥精密科学仪器有限公司);ST18型台式离心机(美国Thermo公司);V76025型真空减压干燥器(美国Thermo公司)。
1.2 材料
1.2.1 药材及试剂
于广东省江门市新会区三江镇新马单村,收集陈化2、4、8年(分别于2019、2017、2013年采集)的广陈皮样品(同一环境下贮存)各1批,经成都中医药大学药学院严铸云教授鉴定为芸香科植物陈皮Citrusreticulate‘Chachi’的干燥果皮。经检验,药材质量符合《中华人民共和国药典》2020年版一部中对陈皮的质量要求。对照品橙皮苷(批号为MUST-20031701,纯度为98.46%)、川陈皮素(MUST-20041210,98.86%)、橘皮素(MUST-20072310,99.61%)购于成都曼思特生物科技有限公司;对羟基苯甲酸乙酯(批号为2020052601)购于成都市科隆化学品有限公司;水为超纯水,甲醇、乙腈、乙酸为色谱纯,其他试剂均为分析纯。
1.2.2 动物
健康雄性SD大鼠,40只,SPF级,体质量(180±20)g,由四川成都达硕实验动物有限公司提供,动物许可证号为SCXK(川)2020-030。实验方案经成都中医药大学动物实验伦理委员会审批同意,伦理审查批准号为2021-11。
1.3 方法
1.3.1 广陈皮提取液的制备
分别称取2、4、8年广陈皮样品各250 g,打碎置锅中,加入10倍量水浸泡1 h,文火微沸煎煮30 min,滤过,药渣加入8倍量水,文火微沸继续煎煮30 min,再次滤过,合并两次滤液,浓缩至0.4 g/mL,供灌胃用。
1.3.2 对照品溶液的制备
分别精密称取对照品橙皮苷、橘皮素、川陈皮素适量,加甲醇溶解并定容至10 mL量瓶中,制成质量浓度为0.159、0.126、0.147 g/L的混合对照品溶液。
1.3.3 内标溶液的制备
准确称取对羟基苯甲酸乙酯25 mg,加甲醇溶解,定容至25 mL容量瓶中。
1.3.4 供试品溶液的制备
取1.3.1项下广陈皮提取液1 mL,至EP管中,稀释十倍,在13 000 r/min离心10 min,取上清液,供LC-MS分析用。
1.3.5 动物给药与血浆样品采集
雄性SD大鼠饲养于成都中医药大学动物实验房,室温控制在20~25 ℃,适应性喂养1周,自由进食及饮水。连续灌胃3天,每天早晚各一次。末次给药前禁食12 h,自由饮水。空白组给予生理盐水。给药组按0.4 g/mL剂量广陈皮提取物灌胃给予大鼠,为尽可能多地检测到含药血浆中的成分,选取0.5、1、1.5、2、3、4 h总共6个时间点进行眼眶静脉丛取血(左、右眼交叉取血约0.3 mL),将血样收集至装有肝素钠的EP管中,室温静置30 min,在3 000 r/min离心10 min,取上层血浆,储存在-20 ℃冰箱中,备用。
1.3.6 血浆样品处理
取给药后各时间点血浆样品等体积混合,得到600 μL血浆样本,加入3倍量甲醇,并加入100 μL内标溶液涡旋5 min后,在4℃、13 000 r/min离心10 min,取上清液至干净EP管中,真空干燥至干,固体残渣加100 μL甲醇复溶,涡旋5 min,在13 000 r/min离心10 min后,取上清液供LC-MS分析用。
1.3.7 色谱条件
Agilent Extend C18色谱柱(3.0 mm × 100 mm,1.8 μm),流动相为0.5%乙酸水溶液(A)-0.5%乙酸乙腈溶液(B),梯度洗脱(0~10 min,8%→15%B;10~20 min,15→20%B;20~30 min,20%→24%B;30~45 min,24%→64%B;45~60 min,64%→100%B),流速为0.3 mL/min,柱温为30 ℃。进样量为5 μL。
1.3.8 质谱条件
采用电喷雾离子源(ESI),正、负离子切换模式扫描,扫描范围为m/z100~1 500,Full MS一级分辨率为35 000,二级分辨率为17 500;正、负离子喷雾电压分别为3.5和-3.0 kV;离子源温度为350 ℃,鞘气流速为35 arb,辅助气流速为10 arb,离子传输管温度为320 ℃。S状透镜电压(S-Lens)为50 V,碰撞能量梯度为20、40、60 eV。
2 结果与分析
依据“1.3.7”项色谱条件及“1.3.8”项质谱条件进行分析,在正、负离子模式下采集给药后血浆的色谱图(见图1~6)。

图1 负离子模式下2年广陈皮血浆 UHPLC-Q-Orbitrap HRMS的总离子流图
利用Compound Discover 3.0软件,将实验所得数据的分子式和分子质量与mzcloud和mzvault数据库进行匹配,设置一级及二级质量偏差5 ppm,匹配度分值大于80。分析大鼠灌胃广陈皮药液后的给药血浆与空白血浆、广陈皮提取液的差异,获得入血成分。对于有对照品的化合物,通过与对照品比对保留时间、特征碎片离子来确定其结构及分子式,对于没有对照品的化合物,根据文献及碎片离子信息进行成分推测鉴定。结果,鉴定出2年陈皮入血原型成分和代谢产物分别为16个和18个;4年陈皮入血原型成分和代谢产物各为12个;8年广陈皮入血原型成分和代谢产物分别为7个和8个(见表1)。

表1 2、4、8年广陈皮入血成分

续表1(Continued Tab.1)

续表1(Continued Tab.1)

图2 负离子模式下4年广陈皮血浆 UHPLC-Q-Orbitrap HRMS的总离子流图
图3 负离子模式下8年广陈皮血浆UHPLC-Q-Orbitrap HRMS 的总离子流图

图4 正离子模式下2年广陈皮血浆(a)、空白血浆样品(b)及2年广陈皮提取液(c)的总离子流图

图5 正离子模式下4年广陈皮血浆(d)、空白血浆样品(b)及4年广陈皮提取液(e)的总离子流图
2.1 黄酮苷元化合物鉴定
从大鼠的血浆中共鉴定出7个黄酮苷元,其中以川陈皮素为例做裂解规律分析。通过MS1图谱确定其准分子离子峰为m/z403.138 9 [M+H]+,预测分子式为C20H20O8;MS2图谱中,碎片离子为m/z313.960 2,主要是由母离子脱掉6个甲氧基团(C6H18,90)形成,碎片离子为m/z163.989 9和240.060 0,主要是由母离子断裂1,2位和3,4位之间的共价键形成,碎片离子为m/z196.017 0,是由m/z240.060 0碎片离子脱去一个二氧化碳(CO2,44)形成,经过与文献[8]比对,其质谱数据库与川陈皮素一致,因此鉴定化合物31为川陈皮素,裂解规律如图7所示。
图6 正离子模式下8年广陈皮血浆(f)、空白血浆样品(b)及8年广陈皮提取液(g)的总离子流图

图7 川陈皮素的裂解途径
2.2 黄酮醇类化合物
黄酮醇化合物的裂解主要是特征的丢失CHO。通过MS1图谱确定其准分子离子峰为m/z389.123 2 [M+H]+,预测分子式为C20H20O8;MS2图谱中,碎片离子为m/z345.097 0,主要是由母离子脱去(CH3CHO,44)形成;碎片离子为m/z317.119 1,主要由碎片离子m/z345.097 0脱去一分子CO形成;碎片离子为m/z197.020 4和193.122 8主要由1,2位和3,4位共价键断裂形成;碎片离子为m/z197.020 4也可能由碎片离子m/z345.097 0脱去碎片(C9H9O2149)形成。与文献[18]数据对比,化合物25与艾黄素质谱数据一致,因此鉴定化合物25为艾黄素,裂解规律如图8所示。
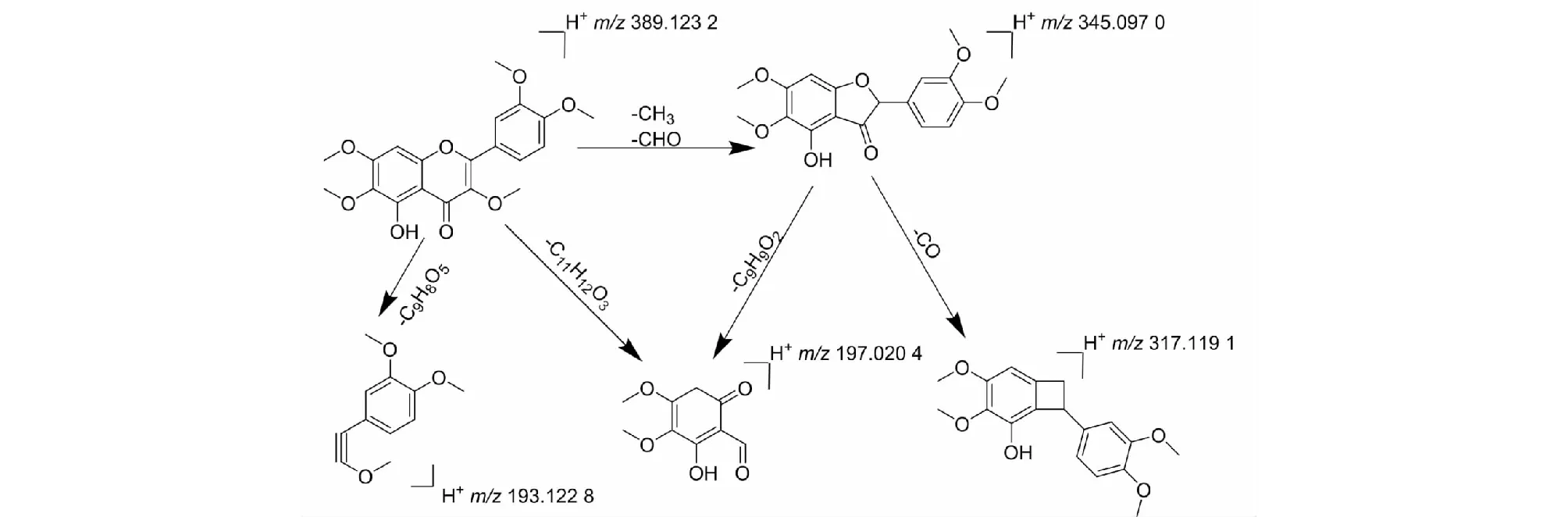
图8 艾黄素的裂解途径
2.3 不同陈化时间广陈皮中黄酮类入血成分的相对含量比较
依据内标品峰面积,计算2、4、8年广陈皮黄酮类入血成分相对含量,发现陈化2年广陈皮黄酮类入血成分相对含量较陈化4、8年广陈皮高(见表2)。

表2 不同陈化时间广陈皮黄酮类入血成分的相对含量比较(n=3)
3 讨论与结论
中药陈用历史悠久,陈皮为“六陈”之首,结合历代本草著作和现代研究,陈皮的具体陈化时间问题尚未解决。课题组前期通过UHPLC-Q-Orbitrap HRMS技术对不同陈化时间的广陈皮中黄酮类成分进行分析,从体外角度已证明“陈皮须用隔年陈”具有一定合理性。
本实验基于UHPLC-Q-Orbitrap HRMS快速、精确的特点,固定采收时间、采样地点、贮藏环境等条件,首次对不同年限广陈皮进行入血成分比较分析,鉴定出陈化2年、4年和8年广陈皮入血成分分别为34、24和15个。实验发现,3个年份广陈皮入血成分种类大致相同,依据峰面积比较相对含量,2年广陈皮较其他两个年份高,与前期体外实验结果较一致,证明广陈皮化学成分含量的差异会导致其入血成分含量的差异,可为“陈皮须用隔年陈”[18]的阐释提供进一步依据。
陈皮主要成分为黄酮类化合物,陈皮中黄酮类化合物具有保护肝损伤[23,24],降低血脂[25]等作用。川陈皮素是神经保护的代表性成分,可通过激活p-Akt、p-CREB、BDNF和Bcl-2通路及改善大鼠BBB通透性保护脑缺血[26]。橘皮素可以通过线粒体JNK/Baxpathway对心肌细胞产生抗凋亡作用[27]。异橙黄酮对HL-60、A549、HO8910和MCF-7四种癌症细胞显示出明显的抗增殖作用[28]。艾黄素具有抗氧化、抗炎及抗病毒的作用[29]。结合陈皮传统功效和现代药理研究,初步推断,川陈皮素、橘皮素等7个黄酮类成分可能是广陈皮潜在的药效物质基础,后期仍需进行生物活性测定和药效评价,并从中筛选能够表达与中药传统临床疗效相关活性的成分作为药效物质基础。本实验为陈皮的药效物质基础研究提供了一个新的有效的方法,后期可对不同年限广陈皮入血成分进行比较研究,且结合药效共同阐释陈皮“陈久者良”科学内涵。
对于一些同分异构体,Compound Discoverer 3.0软件只能从其碎片信息中提取到一些母核离子的具体信息进行结构上的推测,并不能对同分异构体进行区分,还需结合核磁共振技术对这些同分异构体进行结构鉴定[30]。
