异钩藤碱调控ERK/p27Kip1信号通路改善博莱霉素诱导的小鼠肺纤维化
2022-05-25李泽朋何晓伟李先伟
陈 晓,李泽朋,何晓伟,李先伟*
1皖南医学院药学院药理学教研室;2安徽省皖南植物药活性物质筛选与再评价工程实验室,芜湖 241002
肺纤维化(pulmonary fibrosis,PF)是一种慢性间质性肺疾病,其特征是肺成纤维细胞异常增殖、细胞外基质(extracellular matrix,ECM)过度积累、炎症损伤和组织结构破坏,最终导致肺瘢痕形成、肺功能不全和呼吸衰竭[1]。氧化应激、炎症反应、成纤维细胞增殖活化和ECM异常沉积等多种因素都参与了PF的发病机制,更重要的是肺成纤维细胞向肌成纤维细胞(myofibroblast,MFb)增殖分化的过程可能是肺纤维化形成的关键[2]。大量研究表明在转化生长因子-β1(transforming growth factor-β1,TGF-β1)等细胞因子的刺激下,肺成纤维细胞可大量增殖并分化为α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)阳性的MFb[3]。MFb通过其合成大量的ECM和促纤维化因子导致病理性肺组织重塑被认为是PF进展性的关键致病机制[4]。因此,探究肺成纤维细胞增殖和分化的机制并寻找其抑制靶点可能是减轻PF的潜在策略。
异钩藤碱(isorhynchophylline,IRN)是从中药钩藤中分离出来的四环羟吲哚生物碱,前期研究发现IRN具有抗氧化、抗炎、抗增殖和神经保护等多种作用[5,6]。Guo等[7]研究发现IRN通过抑制肺动脉平滑肌细胞增殖并减轻肺血管重塑而缓解野百合碱诱导的肺动脉高压。进一步研究发现,IRN通过抑制支气管平滑肌细胞增殖而对支气管哮喘具有一定的缓解作用[8]。最新的研究发现异钩藤碱对二氧化硅诱导的小鼠肺损伤具有一定的保护作用[9]。而我们前期研究发现含羞草碱通过抑制细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)的磷酸化、上调p27Kip1的表达能够明显抑制TGF-β1诱导的肺成纤维化细胞的增殖分化[10,11]。而IRN通过抑制ERK1/2的磷酸化而明显抑制血管紧张素II(angiotensin II,AngII)诱导的新生大鼠心室肌细胞的增殖[12]。基于以上的研究背景,本课题以ERK1/2、p27Kip1信号通路靶点,探究IRN抗PF的作用及机制,从而为研究开发具有抗PF作用的中药提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物
C57BL/6J小鼠,体质量(18±2 g),购自斯贝福(北京)生物技术有限公司,动物许可证号:SCXK(京)2019-0010。
1.1.2 药物与试剂
IRN(北京索莱宝科技有限公司,货号II0310);注射用盐酸博莱霉素(Bleomycin,BLM)(浙江瀚晖制药有限公司,批号H20055883);SABC-AP免疫组化染色试剂盒(福州迈新生物技术开发有限公司,批号KIT-5004);Alexa Fluor 488标记山羊抗小鼠IgG、DAPI染色液、细胞周期检测试剂盒、5-乙炔基-2′-脱氧尿苷(5-ethynyl-2′-deoxy uridine,EdU)掺入细胞增殖检测试剂盒、结晶紫染色液(上海碧云天生物技术有限公司,批号分别为A0428、C1005、C1052、C0085S、C0121);Transwell小室(美国Corning公司);重组小鼠TGFβ1(美国R&D公司,批号7666-MB);PrimeScriptTMRT reagent Kit、TB Green®Premix Ex TaqTMII(北京宝日医生物技术有限公司,批号分别为RR037Q、RR820Q);改良Masson染色试剂盒、TGF-β1抗体、ERK1/2抗体、磷酸化ERK1/2(p-ERK1/2)抗体、I型胶原蛋白(collagen I)抗体及GAPDH抗体(北京博奥森生物技术有限公司,批号分别为S0076、bs-0086R、bsm-33337M、bs-3016R、bs-7158R、bsm-33033M);p27Kip1抗体、周期素依赖性激酶2(cyclin dependent kinase 2,CDK2)抗体和周期素E1(cyclin E1)抗体(美国Cell Signaling Technology公司,批号分别为#3686、#18048、#4129);波形蛋白(vimentin)抗体、α-SMA抗体(美国Santa Cruz公司,批号分别为sc-6260、sc-8432);PVDF膜和ELC化学发光液(美国Merck Millipore公司,批号分别为IPVH00005、WBKlS0100)。
1.2 方法
1.2.1 实验分组、模型制备与给药
C57BL/6J小鼠随机分为正常(control,CON)组、BLM组、BLM+IRN低剂量(10 mg/kg)组和BLM+IRN高剂量(20 mg/kg)组,每组各12只。BLM(5 000 U/kg)气管注射(药物总量分两次注射,每次间隔30 min),制备肺纤维化模型。IRN用0.5%羧甲基纤维素钠充分混匀,于造模后第三天连续灌胃给药21天,CON组与BLM组灌胃给予等体积的0.5%羧甲基纤维素钠。
1.2.2 肺组织病理检测与胶原沉积分析
肺组织用4%多聚甲醛灌流后,参照我们前期实验方法进行HE及Masson染色[10],光镜下观察肺组织病理学变化及胶原沉积情况。根据文献[13]以Ashcroft评分体系评价纤维化程度。此外,根据我们前期研究方法[14],Masson染色结果以Image Pro Plus 6.0软件测量并计算小鼠肺组织胶原容积分数(collagen volume fraction,CVF):
CVF=(蓝色胶原纤维面积/视野总面积)×100%
1.2.3 肺组织α-SMA免疫组化染色
肺组织用4%多聚甲醛灌流后,根据SABC-AP(链霉亲和素-碱性磷酸酶)免疫组化法检测肺组织α-SMA蛋白表达,α-SMA一抗浓度为1∶500。相应二抗浓度为1∶2 000。肺组织α-SMA蛋白阳性表达呈黄至棕黄色颗粒。
1.2.4 小鼠原代肺成纤维细胞培养及实验分组
组织法分离C57BL/6J小鼠肺成纤维细胞,并用差时贴壁法进行纯化,因成纤维细胞特异表达波形蛋白(vimentin)而上皮细胞波形蛋白表达比较低,经vimentin(1∶500)细胞免疫荧光染色鉴定后(鉴定结果见图1),取3~6代细胞用于后续实验,具体培养方法详见我们前期研究成果[11]。细胞实验设对照(Control)组、TGF-β1 10 ng/mL剂量组、TGF-β1+IRN(5、10、20 μmol/L)剂量组。细胞先用TGF-β1预处理1 h,再加入IRN共孵育48 h。每组设2个复孔,实验重复3次。
图1 细胞免疫荧光检测Vimentin的表达(×400)
1.2.5 EdU掺入法测定细胞增殖
细胞(4×104/well)接种于96孔板,按照细胞实验方案处理细胞后,用BeyoClickTMEdU细胞增殖检测试剂盒检测细胞增殖情况。
1.2.6 流式细胞术测定细胞周期
细胞(1×106/well)接种于6孔板处理后,按照细胞实验方案处理细胞后,收集肺成纤维细胞制成细胞悬液,细胞周期检测试剂盒染色后用流式细胞仪检测细胞周期。
1.2.7 Transwell细胞迁移实验
细胞(2×105/well)接种于Transwell小室上室,按照细胞实验方案处理细胞后,用4%多聚甲醛固定细胞30 min,结晶紫染色液染色30 min,PBS洗涤后,显微镜下观察细胞迁移情况。
1.2.8 实时定量聚合酶链式反应(RT-qPCR)检测相关基因表达
Trizol法提取肺组织和肺成纤维细胞总RNA,测定浓度后将其逆转录成cDNA。以2 μL cDNA为模板,20 μL反应体系,用StepOnePlusTMReal-Time PCR System进行PCR扩增。PCR反应条件参照我们前期的研究结果[10]。以GAPDH为内参,用2-ΔΔCt法计算各基因mRNA的相对表达量。引物序列见表1。
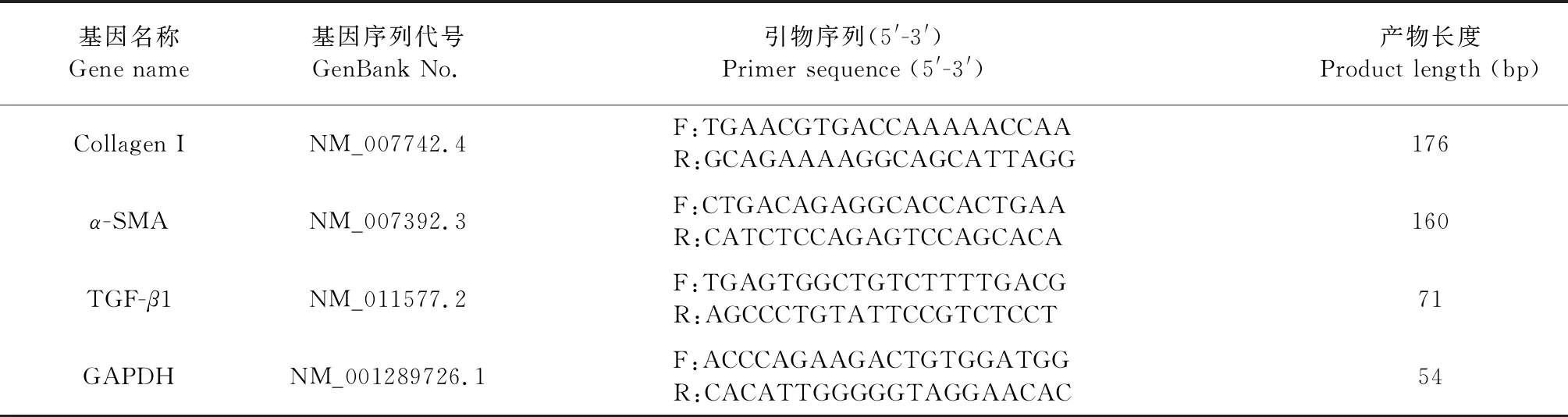
表1 实时定量聚合酶链式反应引物序列
1.2.9 Western blot检测相关蛋白表达
收集6孔板细胞,加入50 μL 0.1% PMSF的RIPA裂解液;称取200 mg肺组织,液氮研磨后加入300 μL含0.1% PMSF的RIPA裂解液,吹打混匀,冰浴摇床裂解40 min。4°C、12 000 r/min离心10 min,吸取上清。BCA法测定蛋白浓度。参照我们前期的研究方法进行Western Blot检测[10]。相关蛋白一抗浓度分别为TGF-β1(1∶1 000)、collagen I(1∶1 000)、α-SMA(1∶2 000)、p-ERK1/2(1∶2 000)、ERK1/2(1∶2 000)、p27Kip1(1∶1 000)、CDK2(1∶1 000)、Cyclin E1(1∶1 000)及GAPDH(1∶2 000),相应二抗浓度(1∶2 000~1∶5 000)。用Image J 1.43软件进行灰度值测量并统计分析蛋白相对表达量。
1.2.10 统计学方法

2 结果
2.1 IRN对PF小鼠肺组织病理学变化的影响
HE染色结果显示CON组肺泡结构正常,未见炎症反应,而BLM组肺泡结构出现萎缩和塌陷并发生融合,肺泡壁增宽增厚明显,且可见大量炎性细胞的浸润及分泌物,Ashcroft评分纤维化程度明显升高(P<0.01)。而与BLM组相比,IRN低、高两个剂量组给药21天后,上述肺组织病理损伤均有不同程度的减轻,纤维化评分明显降低(P<0.05)(见图2、图3)。

图2 小鼠肺组织HE染色(×200)

图3 肺组织纤维化评分及胶原容积分数
2.2 IRN对PF小鼠肺组织胶原及TGFβ1表达的影响
Masson染色结果显示,CON组肺组织可见少量蓝色胶原纤维,而BLM组肺组织可见大量蓝色胶原纤维的沉积,CVF明显升高(P<0.05)。而IRN低、高两个剂量组给药21天后,肺组织蓝色胶原纤维染色明显减少,CVF明显降低(P<0.05)(见图3、图4)。另外,与CON组相比,BLM组collagen I、TGFβ1 mRNA和蛋白表达明显升高(P<0.01)。与BLM组相比,IRN低、高剂量组TGFβ1、collagen I mRNA和蛋白表达均明显降低(P<0.05)(见图5)。

图4 小鼠肺组织Masson染色(×200)
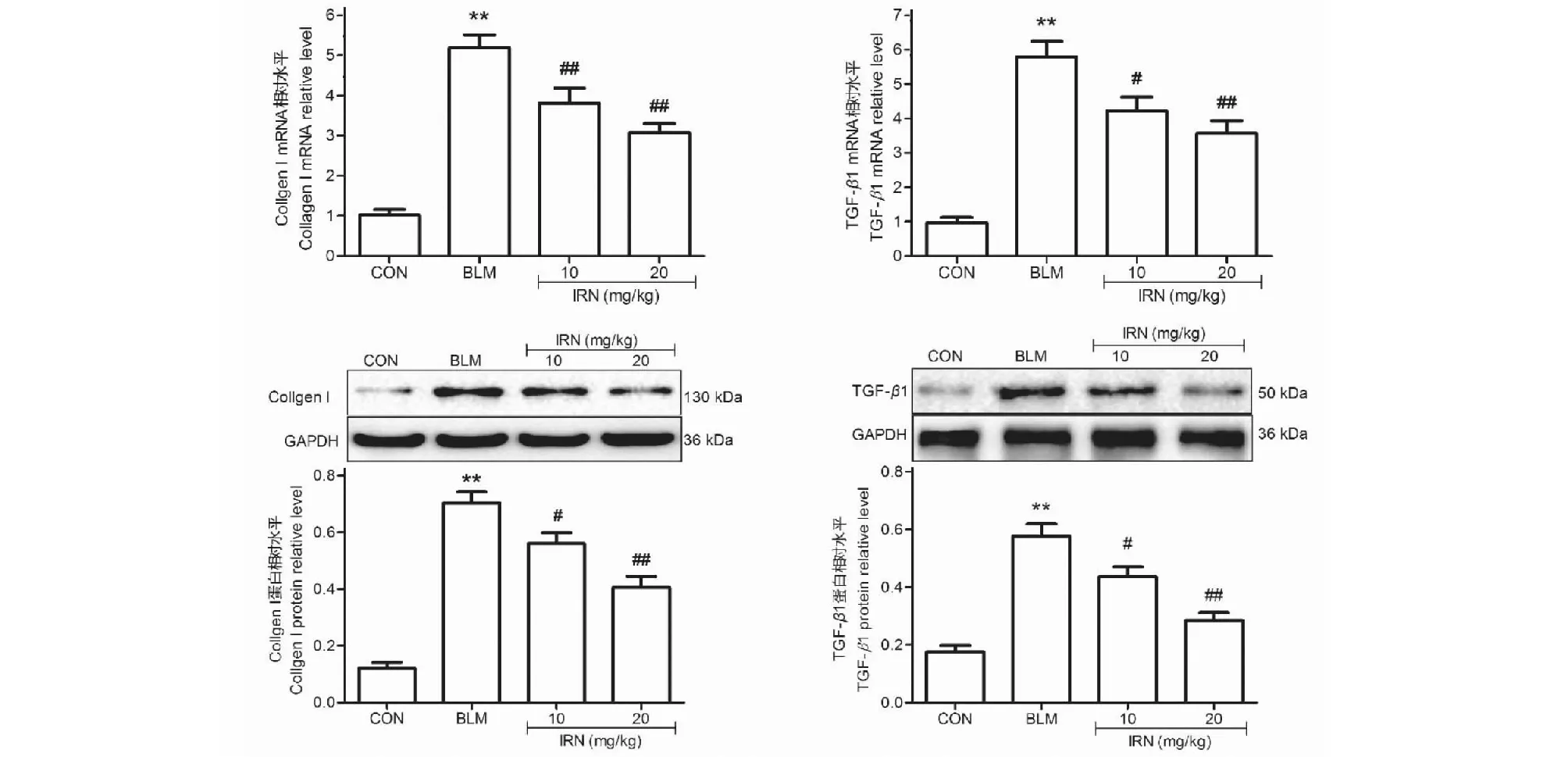
图5 异钩藤碱对肺纤维化小鼠肺组织TGFβ1、I型胶原mRNA和蛋白表达的影响
2.3 IRN对PF小鼠肺组织α-SMA表达的影响
免疫组化结果发现,CON组肺组织α-SMA阳性表达水平较低,BLM组肺组织α-SMA阳性表达明显增多,与BLM组相比,IRN低、高两个剂量组α-SMA蛋白阳性表达均不同程度降低(见图6)。另外,与CON组相比,BLM组α-SMA mRNA和蛋白表达明显升高(P<0.01)。与BLM组相比,IRN低、高两个剂量组α-SMA mRNA和蛋白表达均明显降低(P<0.05)(见图7)。

图6 免疫组化检测肺组织α-SMA蛋白表达(×200)

图7 异钩藤碱对肺纤维化小鼠肺组织α-SMA mRNA和蛋白表达的影响
2.4 IRN对PF小鼠肺组织ERK1/2、p27Kip1信号通路相关蛋白表达的影响
Western blot检测发现,与CON组相比,BLM组ERK1/2磷酸化水平明显升高、周期素依赖性激酶抑制蛋白p27Kip1表达明显下调、CDK2和Cyclin E1的表达明显上调(P<0.01)。与BLM组相比,IRN低、高两个剂量组ERK1/2磷酸化水平明显降低、p27Kip1表达明显上调、CDK2和Cyclin E1的表达明显下调(P<0.05)(见图8)。
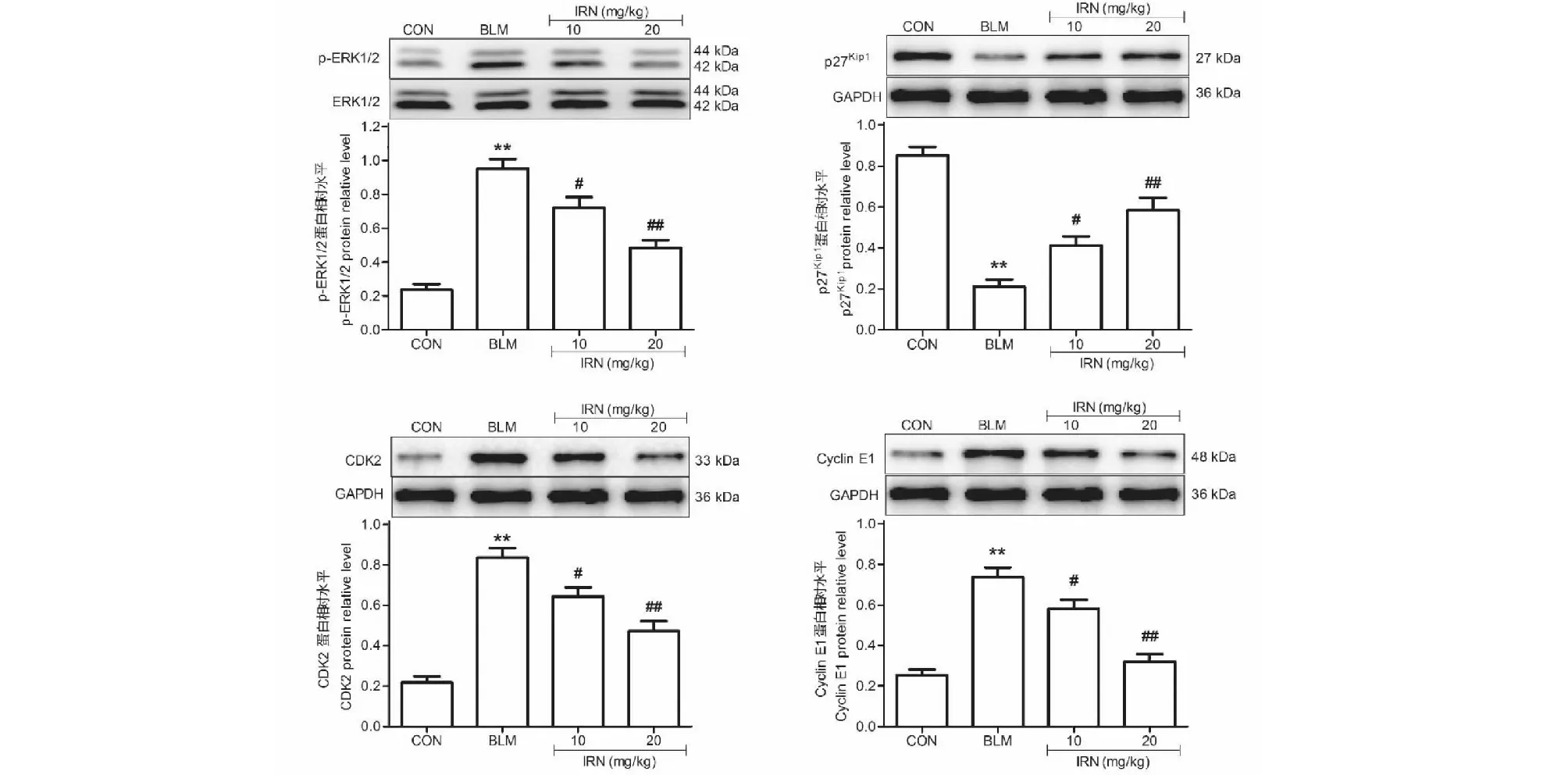
图8 异钩藤碱对肺纤维化小鼠肺组织p-ERK1/2、p27Kip1、CDK2和Cyclin E1蛋白表达的影响
2.5 IRN对原代肺成纤维细胞增殖和迁移的影响
与CON组相比,TGF-β1能显著诱导肺成纤维细胞增殖、明显增加(S期+G2期)细胞周期比率(P<0.01),而与TGF-β1组相比,IRN 5、10、20 μmol/L剂量组均不同程度地抑制肺成纤维细胞的增殖和降低细胞周期(S期+G2期)比率(P<0.05)(见图9和图10)。Transwell实验检测结果显示,TGF-β1能显著提高小鼠肺成纤维细胞的迁移能力,而与TGF-β1组相比,IRN 5、10、20 μmol/L剂量组均不同程度地降低肺成纤维细胞的迁移能力(见图11)。
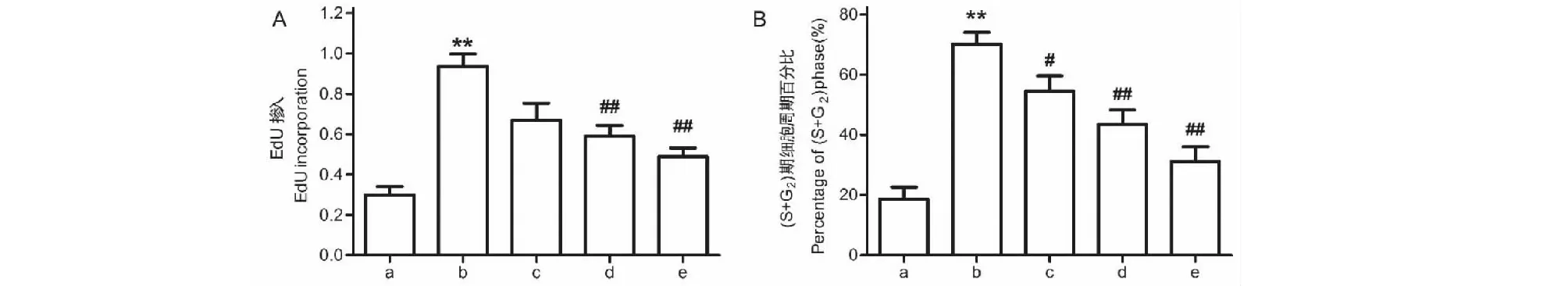
图9 异钩藤碱对TGF-β1诱导的小鼠肺成纤维细胞增殖和迁移的影响

图10 流式细胞术检测细胞周期
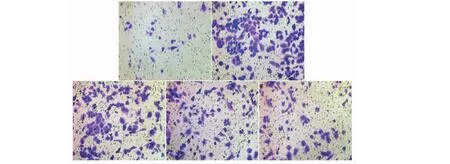
图11 Transwell实验观察肺成纤维细胞迁移能力
2.6 IRN对TGF-β1诱导的小鼠肺成纤维细胞α-SMA和collagen I表达的影响
RT-qPCR和Western blot检测发现,与Control组相比,TGF-β1能显著上调肺成纤维细胞α-SMA和collagen I mRNA和蛋白表达(P<0.01)。而与TGF-β1组相比,IRN 5、10、20 μmol/L剂量组均不同程度地抑制TGF-β1诱导的肺成纤维细胞α-SMA和collagen I mRNA和蛋白的表达(P<0.05)(见图12)。
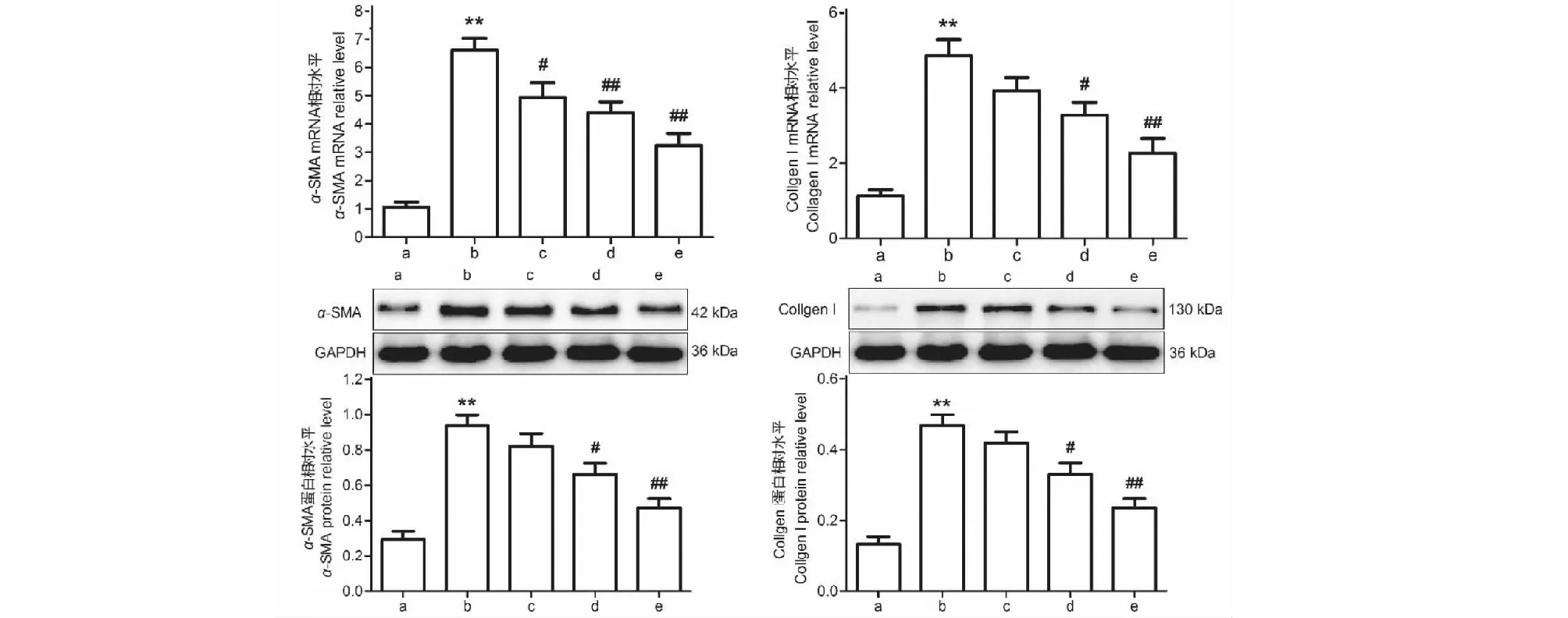
图12 异钩藤碱对TGF-β1诱导的小鼠肺成纤维细胞α-SMA和collagen I mRNA和蛋白表达的影响
2.7 IRN对TGF-β1诱导的小鼠肺成纤维细胞ERK1/2、p27Kip1信号通路相关蛋白表达影响
Western blot检测发现,与Control组相比,TGF-β1能显著升高肺成纤维细胞ERK1/2磷酸化水平、明显下调p27Kip1蛋白表达而显著上调CDK2和cyclin E1的蛋白表达(P<0.01)。而与TGF-β1组相比,IRN 5、10、20 μmol/L剂量组ERK1/2磷酸化水平不同程度降低、p27Kip1表达不同程度上调而CDK2和cyclin E1的表达不同程度下调(P<0.05)(见图13)。

图13 异钩藤碱对TGF-β1诱导的小鼠肺成纤维细胞p-ERK1/2、p27Kip1、CDK2和Cyclin E1蛋白表达的影响
3 讨论与结论
肺纤维化是一种进行性间质性疾病,其特征是成纤维细胞过度增殖和细胞外基质沉积,最终导致肺结构的破坏和纤维病灶的形成,预后较差[15]。目前,治疗肺纤维化的药物主要是糖皮质激素与免疫抑制剂,但其具有较严重的副作用。近年来,随着对肺纤维化研究的不断深入,利用中药治疗肺纤维化的探索与应用逐渐增多。中药及其有效成分通过降低炎症因子表达、抑制肺成纤维细胞增殖、诱导肺成纤维细胞凋亡、阻断纤维化进程,表现出了良好的抗肺纤维化活性,并能够有效改善纤维化症状并延缓病程进展[16,17]。前期研究发现生物碱类中药单体如甲基莲心见、氧化苦参碱等都具有一定的缓解肺纤维化的作用[18,19]。我们课题组前期研究还发现,含羞草碱和吴茱萸次碱对博莱霉素诱导的肺纤维化也有一定的缓解作用[10,20]。另有研究表明,中药丹参素、丹酚酸B等通过抑制肺成纤维细胞增殖分化而改善了博莱霉素诱导的肺纤维化[21,22]。而前期研究发现IRN通过抑制PASMCs增殖并减轻肺血管重塑而缓解MCT诱导的PAH[7],通过抑制支气管平滑肌细胞增殖而对支气管哮喘具有一定的缓解作用[8]。而本研究发现,给予IRN处理21天后,PF小鼠肺组织胶原沉积和collagen I的表达明显减少、α-SMA的表达明显降低、肺损伤程度明显减轻。体外实验进一步发现,IRN能够明显抑制TGF-β1诱导的肺成纤维细胞增殖、显著降低TGF-β1诱导的细胞迁移,不同程度地抑制TGF-β1诱导肺成纤维细胞α-SMA和collagen I的表达。这些结果表明异钩藤碱可能通过抑制肺成纤维化细胞增殖分化而改善了BLM诱导的肺纤维化。
研究表明肺成纤维细胞增殖、迁移和分化为MFb在肺纤维化发展过程中起着重要的作用[2]。其中,TGF-β1在成纤维细胞向MFb的增殖分化中起着关键作用。研究发现TGF-β1即可通过激活Smad信号通路促进肺成纤维细胞的增殖分化,也可通过激活MAPK信号通路诱导肺成纤维细胞的增殖分化[23]。周期素依赖性激酶抑制蛋白p27Kip1是CDK抑制蛋白Cip/Kip家族的成员,是蛋白激酶CDK2/cyclin E的负调节因子,可在G0/G1期阻断细胞周期。p27Kip1在细胞周期的G0/G1期水平较高,在有丝分裂刺激下,p27Kip1迅速降解,从而允许CDK2/cyclin E的促进细胞增殖作用[24]。我们课题组前期研究发现,TGF-β1通过上调ERK1/2磷酸化水平、抑制p27Kip1的表达而诱导肺成纤维化细胞的增殖分化,而ERK1/2抑制剂PD98059通过抑制ERK1/2磷酸化、上调p27Kip1的表达而抑制TGF-β1诱导的肺成纤维化细胞增殖活化[11]。同时我们还发现,含羞草碱通过上调p27Kip1的表达而抑制了TGF-β1诱导的肺成纤维化细胞增殖活化[10]。而前期研究发现,IRN通过抑制ERK1/2的磷酸化、上调p27Kip1的表达而抑制了血小板活化因子诱导的PASMCs而缓解了MCT诱导的PAH[7]。进一步研究还发现,IRN通过抑制MAPK信号通路而抑制了心肌肥厚的发展[12]。本研究发现,IRN给药3周后能够明显降低肺纤维化小鼠肺组织TGF-β1的表达、抑制ERK1/2的磷酸化、上调p27Kip1的表达而下调CDK2/cyclin E1的表达。体外实验进一步发现,IRN能够明显抑制TGF-β1诱导的ERK1/2磷酸化、显著上调p27Kip1的表达而明显下调CDK2/cyclin E1的表达。这些结果提示IRN可能通过调控ERK/p27Kip1而抑制肺成纤维化细胞的增殖分化。
综上所述,我们的研究表明IRN可能通过抑制ERK信号通路、上调p27Kip1的表达而抑制了成纤维细胞向肌成纤维细胞的转化,从而减轻了BLM诱导的PF。本研究为IRN的临床应用提供了新的理论依据,并为PF的治疗提供了新的思路。
