白云鄂博稀土矿来源放线菌Actinorectispora metalli 的次生代谢产物研究
2022-05-25何江波石洋铢康大伟牛燕芬王纪爱毕晓旭曹艳茹
何江波,石洋铢,康大伟,牛燕芬,王纪爱,陈 秀,秦 静,毕晓旭,栾 杰,曹艳茹**
(1.昆明学院,云南 昆明 650214;2.云南省疾病预防与控制中心,云南 昆明 650022)
白云鄂博稀土矿是一座世界罕见的多金属共生矿床,矿产资源十分丰富,被誉为“世界稀土之乡”[1],其铌−铁矿床的稀土资源居世界第一[2].除此以外,该矿还含有丰富的铜矿、金矿等资源.白云鄂博稀土矿微生物是特殊的环境微生物,对这一特殊矿区的微生物资源进行多样性的研究,有利于我们研究其次生代谢产物的多样性.特殊环境微生物具有独特的新陈代谢途径、适应机制,因此会产生具有新颖结构的次生代谢产物,可以为药物的研发提供参考.放线菌Actinorectispora metalli是我们从白云鄂博矿区分离得到的一个放线菌新种[3],前期研究表明该菌的典型菌株KC 198T在酵母膏−蛋白胨培养基中发酵产蛋白酶活性较好,分别在第7 d 和第8 d 时酶活性较高,其蛋白酶酶活性在28 ℃时达到最高.研究结果表明A.metalliKC 198T可作为工业酶制剂的菌株来源[4].因此,我们课题组继续对A.metalliKC 198T进行深入研究,挖掘高活性的次生代谢产物,为该菌的深入开发奠定基础.
1 材料与方法
1.1 材料
1.1.1 菌株 自白云鄂博稀土矿中分离,16S rRNA 基因序列分析结果表明KC 198 与印度放线菌(Actinorectispora indicaYIM 75 728)相似性最高,为98.4%.经多相分类实验,命名为Actinorectispora metallisp.nov[3],菌种目前保存于昆明学院农学与生命科学学院菌种库(编号为KC 198).
1.1.2 培养基 ISP2 培养基(1 L):酵母膏4 g,酵母浸粉5 g,葡萄糖4 g,动物蛋白胨2 g,植物蛋白胨1 g,微量盐1 mL,复合维生素少许,自来水1 000 mL,pH 7.2.
PDB 培养基(1 L):土豆200 g,葡萄糖20 g,自来水1 000 mL,微量盐1 mL.
1.1.3 主要试剂和仪器 1.1-二苯基-2-苦肼基自由基(梯希爱化成工业发展有限公司);柱层析用硅胶(0.054~0.077 mm)、薄层层析用硅胶GF254 均为青岛海洋化工厂生产,Sephadex LH-20 (25~100 μm)为Pharmacia 公司产品;RP-18 (40~60 μm)为日本Daiso 产品.色谱试剂:甲醇、乙腈(上海星可高纯溶剂有限公司).显色剂为H2SO4(10%)的乙醇溶液.分析纯甲醇超高压液相色谱三重四级杆串联质谱联用仪器(英国Waters 公司,Xevo TQ-S);Avance 600 MHz 核磁共振仪(TMS 作为内标);岛津UV-2401 紫外分光光度计;Hanbon-NP7000C 制备液相(汉邦仪器公司),制备柱(Zorbax XDB-C-18,φ21.2×150 mm,5 μm);旋转蒸发仪(东京理化,N-1100);摇床(上海智城分析仪器制造有限公司,ZWY-2102);万分之一电子天平(上海越平电子天平,FA1004B).
1.2 方法
1.2.1 菌株活化与种子液的培养 将保存于−20 ℃的菌株接种于PDA 平板,28 ℃,7 d,以进行活化.然后将单菌落接种至改良ISP2 培养基,恒温摇床28 ℃,180 r/min,3 d,作为种子液.
1.2.2 菌株发酵 将种子液接种至PDB 培养基(121 ℃,灭 菌30 min,pH 7.2),培 养8 d,28 ℃,180 r/min,发酵液采用纱布过滤,收集滤液,得发酵液25 L,然后将发酵液浓缩至2 L.
1.2.3 提取与分离 浸膏采用等体积的乙酸乙酯萃取3 次,浓缩萃取液,得乙酸乙酯浸膏3.5 g.水层再次采用等体积正丁醇萃取3 次,浓缩萃取液,得正丁醇浸膏12.5 g.乙酸乙酯浸膏采用甲醇溶解后,过滤,除去不溶物,经Sephadex LH-20 凝胶柱色谱初步分离,根据薄层色谱(TLC),10%浓硫酸乙醇溶液显色合并相似成分,得3 个组分Fr A~C.Fr A 组 分(238.3 mg)采用硅胶柱色谱(0.054~0.077 mm,φ2 cm×50 cm)再次纯化,以石油醚−丙酮系统梯度洗脱(体积比10∶1~0∶1),根据TLC合并相似组分,再经Sephadex LH-20 柱(MeOH)分离后得到化合物1(4.3 mg).Fr C 经RP-18 反相柱色谱(甲醇−水10%~100%,梯度洗脱,每梯度200 mL)分离,经TLC (GF254硅胶板)检测后为样品Fr C1(162.2 mg),采用制备液相进一步分离,40%色谱甲醇等度洗脱(流速10 mL/min,tR12′33′′),得化合物2(7.8 mg).Fr C2 质量18.9 mg,采用制备液相分离纯化,以10%色谱甲醇等梯度洗脱(流速10 mL/min,tR10′57′′)得化合物3(9.5 mg).正丁醇浸膏采用甲醇溶解,过滤,弃去不溶物,采用Sephadex LH-20 凝胶柱色谱脱糖,得到Fr A-F 部分.Fr A 部分采用硅胶柱色谱分离,洗脱剂为石油醚−丙酮体系(体积比10∶1~0∶1,梯度洗脱),得到FrA1-3,FrA-1 再次采用Sephadex LH-20 凝胶柱色谱纯化得到化合物4(11 mg).FrA-2 采用Sephadex LH-20凝胶柱色谱纯化得到化合物5(8.2 mg).Fr C 1.2 g,采用RP-18 (10%~100%,梯度洗脱,每个梯度200 mL),根据TLC 显色合并相似部分,然后采用硅胶柱色谱法石油醚−丙酮梯度洗脱(体积比5∶1~0∶1),得化合物6(25.8 mg).Fr D 部分采用Sephadex LH-20 凝胶柱色谱脱色,根据TLC 合并相似组分,然后采用制备液相70%甲醇水等度洗脱纯化(流速10 mL/min,tR14′00′′),得化合物7(9.0 mg).以上化合物结构见图1.

图1 化合物1~7 的结构式Fig.1 Chemical structure of compounds 1−7
1.2.4 抗氧化活性实验 称取一定量的DPPH粉末,用甲醇溶解,配成1 mmol/L 的母液.测定时用甲醇稀释10 倍,配成0.1 mmol/L 的DPPH 反应液.取用甲醇稀释的不同浓度样品0.5 mL 于5 mL离心管中,加入2 mL 的DPPH 工作液,混匀,振荡30 min,在517 nm 处测定吸光值.然后按照公式计算DPPH 自由基清除率,并计算IC50值.
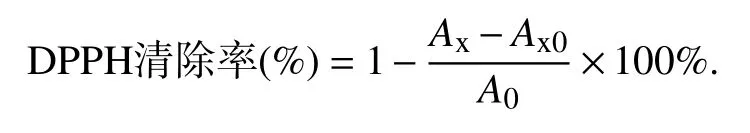
其中:A0—对照组吸光值,0.5 mL 甲醇+2 mL DPPH;Ax0—0.5 mL 样品+2 mL 甲醇;Ax—0.5 mL 样品+2 mL DPPH.
2 结果与分析
2.1 新化合物的结构鉴定
化合物1,无色油状物,易溶于甲醇;ESI-MS:m/z365 [M-H]−;HR-ESI-MS:m/z401.100 7,[M+Cl]−,calcd.for根据1H NMR 和13C NMR 推测该化合物为含有萘环的结构,同时还含有一个β型(δ=5.04,J=6.0 Hz)葡萄糖的单元.根据质谱推断该化合物含有18 个碳,其中包含一个萘环单元,一个葡萄糖单元,以及两个甲氧基.再次结合1H NMR 分析,萘环上有5 个未取代的H 信号,两个甲氧基信号在δ=3.96 (3H,s,1-OCH3)和3.99 (3H,s,4-OCH3).根据1H-1H COSY谱可知,δH=8.11 与δH=7.35 相 关,δH=7.35 与δ=7.49 相关,δH=7.49 与δH=8.00 相关.因此推断δC=123.1 与δC=125.0 连接,δC=125.0 与δC=127.9 连接,δC=127.9 与δC=122.1 连接(图2).根据HMBC 图谱,确定δH=3.96 与δC=138.2 连接,δH=3.99 与δC=153.8连接.δH=5.04 与δC=147.5 存在相关,确定糖单元的连接位置(图2).
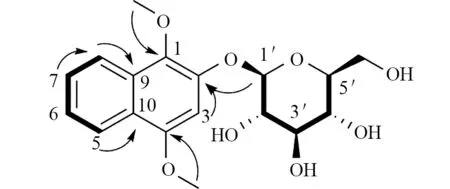
图2 化合物1 的重要1H−1H COSY(─)和HMBC(→)相关Fig.2 The key 1H−1H COSY(─) and HMBC(→) correlations of compound 1
因此化合物1的结构被确定,并命名为1,4-dimethoxy-2-hydroxy naphthalene-2-O-β-D-glucopyra noside,该化合物为新化合物,与文献化合物1,2,4-trihydroxynaphthalene-2-O-β-D-glucopyranoside [5]相似.核磁数据为1H NMR (600 MHz,CD3OD)δ:8.11(1H,dt,J=6.0,0.8 Hz,H-5),8.00 (1H,dt,J=6.0,0.6 Hz,H-8),7.49 (1H,ddd,J=6.0,5.0,0.8 Hz,H-7),7.35 (1H,ddd,J=6.0,5.0,0.8 Hz,H-6),6.99 (1H,s,H-3),5.04 (1H,d,J=6.0 Hz,H-1′),3.99 (3H,s,4-OCH3),3.96 (3H,s,1-OCH3),3.91 (1H,dd,J=9.0,1.8 Hz,H-6′b),3.68 (1H,dd,J=9.0,4.8 Hz,H-6′a),3.56 (1H,dd,J=7.2,6.0 Hz,H-2′),3.50 (1H,t,J=6.6 Hz,H-3′),3.46 (1H,ddd,J=7.2,4.8,1.8 Hz,H-5′),3.38 (1H,dd,J=7.2,6.6 Hz,H-4′);13C NMR(150 MHz,CD3OD)δ:138.2 (C-1),147.5 (C-2),99.2(C-3),153.8 (C-4),123.1 (C-5),125.0 (C-6),127.9 (C-7),122.1 (C-8),130.3 (C-9),123.8 (C-10),103.7 (C-1′),75.2 (C-2′),78.2 (C-3′),71.6 (C-4′),78.5 (C-5′),62.7 (C-6′),62.2 (1-OCH3),56.3 (4-OCH3).
2.2 已知化合物的核磁数据
化合物2:无色油状物,易溶于甲醇.1H NMR(600 MHz,CD3OD)δ:7.93 (1H,d,J=7.2 Hz,H-8),7.65~7.62 (2H,m,H-5,H-6),7.42 (1H,m,H-7),4.92 (1H,dd,J=6.0,3.0 Hz,H-4),2.86 (1H,ddd,J=13.2,5.4,3.6 Hz,H-2a),2.62 (1H,ddd,J=13.2,7.8,3.6 Hz,H-2b),2.36 (1H,m,H-3a),2.11 (1H,m,H-3b).13C NMR (150 MHz,CD3OD)δ:200.2 (C-1),36.4 (C-2),33.1 (C-3),68.4 (C-4),127.8 (C-5),135.4(C-6),128.7 (C-7),128.8 (C-8),129.2 (C-9),148.1 (C-10).以上数据与文献化合物[6]一致,故鉴定为4-hydroxy-tetralone.
化合物3:白色粉末,易溶于甲醇.1H NMR(600 MHz,CD3OD)δ:7.49 (1H,d,J=6.0 Hz,H-8′),7.35 (1H,d,J=6.0 Hz,H-5′),7.09 (1H,t,J=6.0 Hz,H-6′),7.04 (1H,s,H-2′),7.01 (1H,t,J=6.0 Hz,H-7′),4.19 (1H,t,J=3.6 Hz,H-9),3.46 (1H,dd,J=10.8,2.4 Hz,H-6),3.40 (1H,dt,J=12.0,6.0 Hz,H-3),3.10 (1H,dd,J=11.4,3.6 Hz,H-10),2.99 (1H,ddd,J=9.0,7.2,1.8 Hz,H-3),2.20 (1H,dd,J=8.4,4.8 Hz,H-10),1.85 (1H,m,H-5),1.75 (1H,m,H-4),1.52 (1H,m,H-5),1.20 (1H,m,H-4);13C NMR (150 MHz,CD3OD)δ:166.8 (C-1),44.6 (C-3),20.9 (C-4),29.8 (C-5),58.1 (C-6),170.2 (C-7),57.8 (C-9),28.3(C-10),107.9 (C-1′),124.8 (C-2′),136.6 (C-4′),111.0 (C-5′),121.3 (C-6′),118.1 (C-7′),118.6 (C-8′),127.2 (C-9′).以上数据与文献化合物[7]一致,故鉴定为环(L-色氨酸-L-脯氨酸).
化合物4:白色粉末,易溶于DMSO.1H NMR(600 MHz,DMSO-d6)δ:10.94 (1H,s,NH),7.39 (1H,d,J=7.5 Hz,H-6),5.45 (1H,d,J=7.5 Hz,H-5);13C NMR (150 MHz,DMSO-d6)δ:151.6 (C-2),164.4 (C-4),142.3 (C-5),100.3 (C-6).以上数据与文献化合物[8]一致,故鉴定为尿嘧啶.
化合物5:13C NMR (150 MHz,DMSO-d6)δ:151.5 (C-2),165.0 (C-4),107.7 (C-5),137.8 (C-6),11.8 (CH3-5).以上数据与文献化合物[9]一致,故鉴定为胸腺嘧啶.
化合物6:白色粉末,易溶于DMSO.1H NMR(600 MHz,DMSO-d6)δ:8.34 (1H,s,H-8),8.13 (1H,s,H-2),7.34 (2H,s,NH2),5.87 (1H,d,J=6.0 Hz,H-1′),5.48 (1H,d,J=6.0 Hz,OH-2′),5.42 (1H,dd,J=7.2,4.8 Hz,OH-5′),5.22 (1H,d,J=4.8 Hz,OH-3′),4.60 (1H,d,J=6.0 Hz,H-2′),4.14 (1H,dd,J=7.8,3.6 Hz,H-3′),3.96 (1H,q,J=3.0 Hz,H-4′),3.66 (1H,dt,J=12.0,3.6 Hz,H-5′),3.55 (1H,ddd,J=11.4,6.6,3.6 Hz,H-5′);13C NMR (150 MHz,DMSO-d6)δ:152.4 (C-2),149.1 (C-4),119.4 (C-5),156.2 (C-6),139.9 (C-8),87.9 (C-1′),73.5 (C-2′),70.7 (C-3′)85.9 (C-4′),61.7 (C-5′).以上数据与文献化合物[10]一致,故鉴定为β-adenosine.
化合物7:无色油状物,易溶于甲醇.1H NMR(600 MHz,CD3OD)δ:7.56 (1H,d,J=7.8 Hz,H-4),7.32 (1H,d,J=7.8 Hz,H-7),7.09 (1H,s,H-2),7.07(1H,t,J=7.8 Hz,H-7),6.99 (1H,t,J=7.8 Hz,H-5),3.94 (1H,m,H-11),3.55 (1H,dd,J=10.8,3.6 Hz,H-12a),3.48 (1H,dd,J=10.8,6.0 Hz,H-12b),2.96 (1H,dd,J=10.8,6.0 Hz,H-10a),2.85 (1H,1H,dd,J=10.8,6.0 Hz,H-10b);13C NMR (150 MHz,CD3OD)δ:124.3 (C-2),112.6 (C-3),119.7 (C-4),119.6 (C-5),122.4 (C-6),112.3 (C-7),138.3 (C-8),129.2 (C-9),30.7 (C-10) 74.0 (C-11),67.0 (C-12).以上数据与文献化合物[11]一致,故鉴定为3-(2,3-dihydroxypropyl)indole.
2.3 抗DPPH 自由基结果实验采用DPPH 自由基清除实验评价化合物1~7的抗氧化能力.单体化合物分别配成50、40、30、20 μmol/L 的溶液.分别添加50 μL 到96 孔板,再加入200 μL DPPH 液体.在暗处放置30 min,再用酶标仪于517 nm 处测定吸光度,并计算清除率.实验结果显示,化合物1~7均未显示出DPPH 自由基清除活性.
3 讨论与结论
微生物次生代谢产物是药物的重要先导化合物来源,链霉菌的次生代谢产物被广泛用作临床药物.从常规微生物资源中寻找药物先导化合物面临巨大的调整,因此我们选择白云鄂博稀土矿中的微生物资源 进行挖 掘.通过对A.metalliKC 198T进行PDB 液体发酵产物研究,发现7 个化合物,其中化合物1为新化合物,且化合物1的类似物1,2,4-trihydroxynaphthalene-2-O-β-D-glucopyranosides 具有抗氧化活性和拮抗Aβ42 疏水肽聚集活性,被认为可以作为治疗阿尔治海默症的先导物[5].但是本次研究中未发现化合物1具有显著的抗氧化活性,初步推断其原因是酚羟基被甲基化后活性消失.另外,β-adenosine 也在本项研究中分离得到,该化合物在Domondon DL[10]的报道中,具有促进蘑菇生长的作用.从A.metalliKC 198T良好的产酶活性,到次生代谢产物研究,均表明该菌具有较高的研究价值.
本研究对白云鄂博稀土矿放线菌A.metalliKC 198T的次生代谢产物进行了初步的研究,运用现代分离分析方法共分离并鉴定了7 个化合物成分,其中化合物1为新化合物,其余化合物为已知化合物.通过抗氧化活性测试表明,所分离得到的化合物均无显著的抗氧化活性.以上研究结果为进一步挖掘白云鄂博稀土矿微生物资源奠定了物质研究基础,同时也丰富了链霉菌的次生代谢产物.
