透视情境维度 把准问题角度 形成思维模型
——试谈化学反应原理试题解题策略
2022-05-23王洁
王 洁
(江苏省天一中学 214000)
化学反应原理试题多以工业生产或前沿科技为情境,题目综合应用强、化学信息多(文本、图表)、设问角度活.化学反应原理在江苏近三年重大考试中的分布情况见表1.

表1
高频考点有:ΔH计算或书写热化学方程式,自发与ΔH、ΔS的关系;电极反应书写,电极附近的反应,pH变化,离子或电子的移动与数目及相关计算,金属的腐蚀与防护;平衡常数K的计算及与温度的关系,根据K判断平衡的移动,比较浓度、物质的量、压强、转化率、百分含量等 ;四大平衡影响因素及其在生产生活中的应用 ;判断或计算溶液中的pH,调控溶液的酸碱性 ;溶液中的三个守恒,离子浓度大小比较;酸碱中和滴定及应用;分析图像从限度、速率角度讨论反应条件的选择.
化学反应原理试题情境主要包含四个维度:考察热化学和电化学的化学反应与能量情境;考察焓变、活化能、中间体(中间产物)和反应速率的化学反应机理情境;考察化学反应速率、方向限度和平衡移动的情境;考察溶液中的离子反应的情境.透过这些情境维度,分析和精准把握问题的角度,最后形成解决这类问题的思维模型,从而让学生有法可依.下面具体从四个情境维度出发,通过典型考题来分析解题策略.
1 化学反应与能量
这类题命题角度主要有:根据能量图像判断焓变ΔH;结合盖斯定律进行ΔH计算或书写热化学方程式;结合背景材料或新型实用的电池结构图进行原电池原理、电解原理的问题分析.
例1(2021江苏高考节选 )CH4与CO2重整的主要反应的热化学方程式为

2CO(g) + 2H2(g) ΔH=246.5 kJ·mol-1

CO(g)+H2O(g) ΔH=41.2 kJ·mol-1
ΔH=-172.5 kJ·mol-1
①在CH4与CO2重整体系中通人适量H2O(g),可减少C(s)的生成,反应

4CO(g) + 8H2(g)
的ΔH=____.
此题考查角度为运用盖斯定律计算ΔH.
例2(2020 新课标Ⅰ卷节选)硫酸是一种重要的基本化工产品, 接触法制硫酸生产中的关键工序是SO2的催化氧化:
ΔH=-98 kJ·mol-1
回答下列问题:(1)钒催化剂参与反应的能量变化如图1 所示, V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:____.
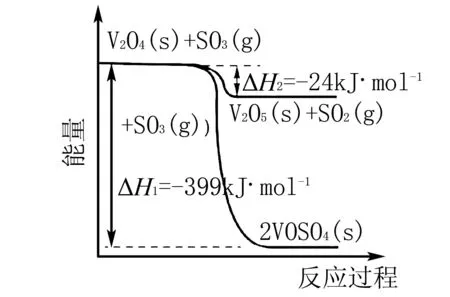
图1
此题考察角度主要是运用盖斯定律计算焓变,其信息的呈现方式在传统的文字信息基础上,增加了考查图表信息.
解决以上利用盖斯定律试题的思维模型如图2所示.

图2
2 反应机理
2017年普通高中化学课程标准在“化学反应速率”章节中,要求“知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响”.
例3(2020江苏节选) HCOOH催化释氢.在催化剂作用下, HCOOH分解生成CO2和H2可能的反应机理如图3所示.①HCOOD催化释氢反应除生成CO2外,还生成____(填化学式). ②研究发现:其他条件不变,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是____.
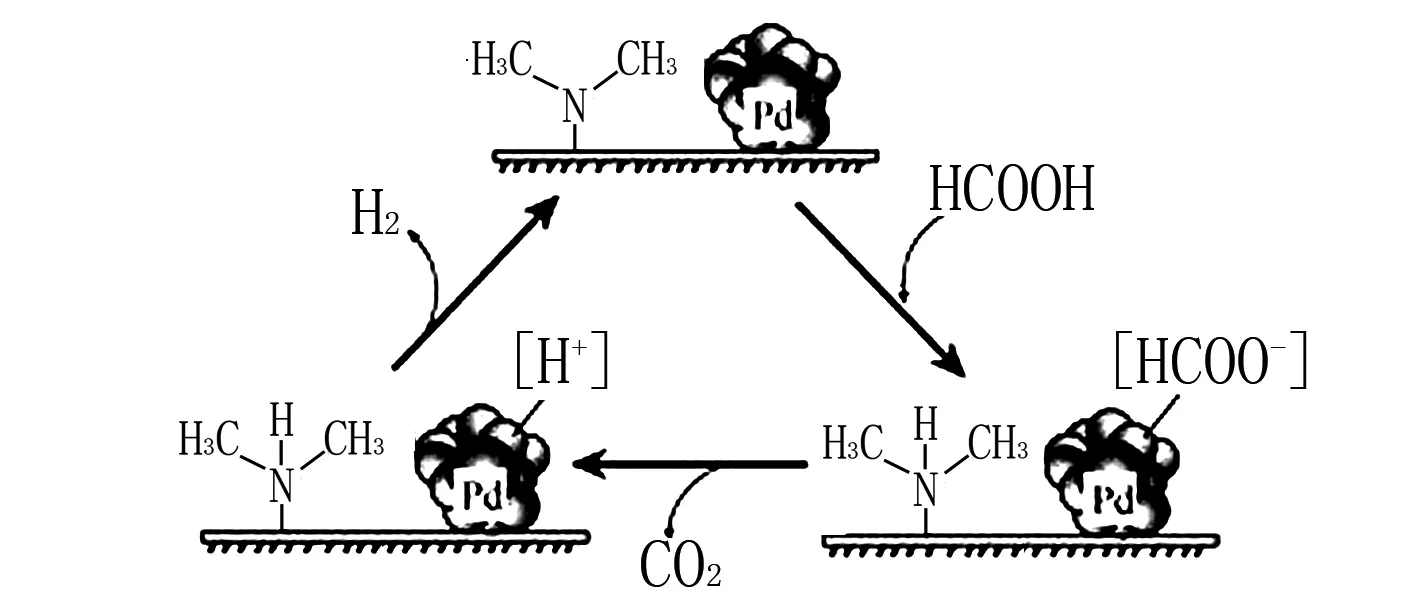
图3
以上考查角度常以陌生反应为载体,通过机理图(“循环式”)考察对催化剂、反应物、生成物的判断,以及对反应速率的影响.
解决以上机理题的思维模型如图4所示.

图4
3 化学反应速率、方向限度和平衡移动
近几年化学反应速率与化学平衡试题的呈现形式常结合图表、图像考查考生的综合分析能力和解题能力,综合性较强.命题角度主要有:能书写平衡常数表达式,能进行平衡常数、转化率的简单计算,能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及平衡移动的方向;能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化;能从限度、速率等角度对化学反应和化工生产条件进行综合分析.
例4(2018江苏节选)反应相同时间NOx的去除率随反应温度的变化曲线如图5所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是____.
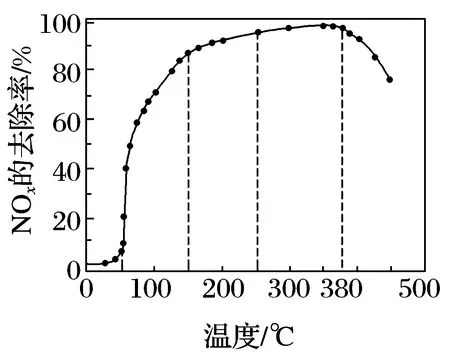
图5
此题考察角度从速率角度讨论反应条件的选择.此处没有出现可逆反应,强调的是反应相同时间,去除率的大小用化学反应速率理论来解释.温度影响化学反应速率,影响催化剂的活性.
解决以上速率和平衡理论应用的思维模型如图6所示.

图6
4 溶液中的离子反应
近几年高考试题中,水溶液中的离子反应和平衡呈现的形式多以表格形式、图像形式和实验形式.综合性较强,思维性较强.命题角度主要有:能从电离、离子反应、平衡的角度分析溶液的性质;进行溶液pH的简单计算,正确测定溶液pH,调控溶液的酸碱性;综合运用离子反应、平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题;电离常数、水的离子积、水解常数、Ksp的关系及其计算;pH曲线的理解与应用等.
例5(2021江苏11)室温下,通过下列实验探究NaHCO3、Na2CO3溶液的性质.
实验1:用pH试纸测量0.1mol·L-1NaHCO3溶液的pH,测得pH约为8.
实验2:将0.1mol·L-1NaHCO3溶液与0.1mol·L-1CaCl2溶液等体积混合,产生白色沉淀.
实验3:向0.1mol·L-1Na2CO3溶液中通入CO2,溶液pH从12下降到约为9.
实验4:向0.1mol·L-1Na2CO3溶液中滴加新制饱和氯水,氯水颜色褪去.
下列说法正确的是( ).
B. 实验2中两溶液混合时有:
C. 实验3中发生反应的离子方程式为:
此题考察四个独立的溶液,溶液有单一溶液或混合溶液(考虑反应),常涉及二元弱酸或含“弱”的盐.涉及电离平衡常数和水解平衡常数、沉淀溶解平衡、离子反应、离子浓度的大小比较.
解决以上离子反应和平衡的思维模型如图7所示.
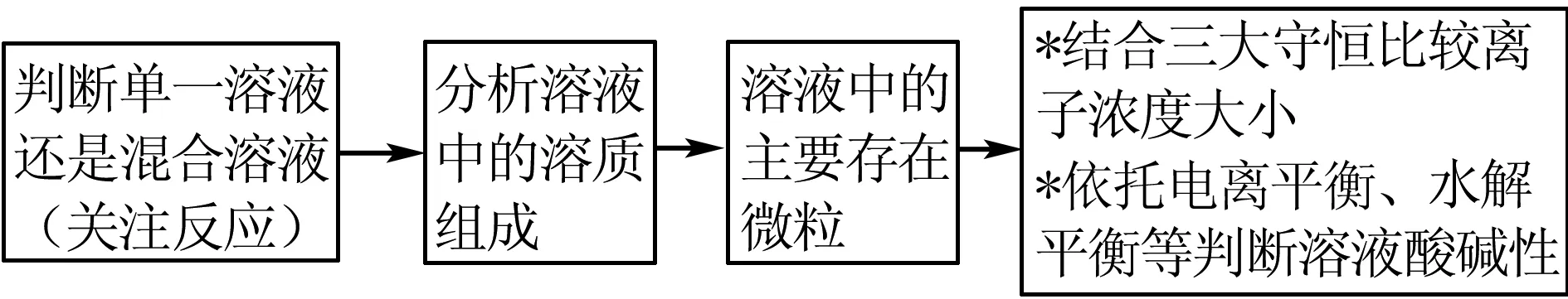
图7
总之,考察化学反应原理试题的核心知识不变,平时复习中要夯实基础,形成解题的思维模型.另外要关注高考题,精选试题,熟悉高考的考查方式和内容;创设和研读新情境、抓住信息、联系理论.重视看图、画图、析图,训练文字表达的方式分析反应原理.经过这样的复习,相信学生对化学学科的本质能更好的理解,促进学生的化学学科核心素养的进一步提升.
