早期肠内营养对贲门癌术后患者肠黏膜屏障及免疫功能的影响
2022-05-23张利敏
张利敏
(濮阳市油田总医院临床营养科,河南 濮阳 457100)
贲门癌发生于胃贲门部,是胃癌中的特殊类型,早期临床症状主要表现为间歇性胸骨后胀闷或轻微疼痛、吞食有顿挫感等,但当症状维持3个月以上,即可发展至中晚期,给临床治疗带来极大挑战[1]。目前为止,外科手术治疗是贲门癌的首选方式,但手术对机体创伤较大,易造成脏器功能及免疫水平大幅度降低,导致肠黏膜屏障受损,肠道中细菌、内毒素进入血液,引发全身感染,严重影响术后恢复[2]。近年来,采用营养支持改善胃部肿瘤患者术后营养状况受到各界关注。营养支持是基于营养学原理,采用肠内营养支持及肠外营养支持的方式,改善或维持机体代谢、脏腑功能等,调节患者生理机能,提高临床效果,促进患者康复[3,4]。本研究旨在探讨早期营养支持对贲门癌术后患者肠粘膜屏障保护的效果及对机体免疫细胞功能的影响。
1 资料与方法
1.1 一般资料
选取2020 年4 月至2021 年4 月本院收治的95 例贲门癌患者作为研究对象,采用信封法分为对照组(n=47)和观察组(n=48)。其中对照组患者男25 例,女22 例;年龄25~75 岁,平均年龄51.65±2.45 岁;早期贲门癌9 例,中晚期38 例,其中发生直接扩散15 例,淋巴结转移20 例,血源性转移5 例,未发生转移7 例。观察组患者男23 例,女25 例;年龄24~75 岁,平均年龄51.13±2.52 岁;早期贲门癌9 例,中晚期39 例,发生直接扩散14 例,淋巴结转移21 例,血源性转移6 例,未发生转移7 例。两组患者一般资料差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准(伦理批号:20200325)。
纳入标准:符合贲门癌的临床症状,且根据病理活检确诊为贲门癌;患者及家属对本研究全面了解,自愿参与,并签署知情同意书。排除标准:对本研究使用药物有严重过敏症状者;有严重肝肾功能障碍者;合并有其他恶性肿瘤者。
1.2 方法
术后给予两组患者均静脉滴注0.9%的氯化钠(规格:500 mL:4.5g,北大医药重庆大新药业股份有限公司,国药准字:H50020700)和头孢西丁钠(规格:1.0 g:瓶,深圳市海滨制药有限公司,国药准字:H20058908),维持酸碱平衡、纠正电解质紊乱及抗感染。术后待患者清醒后,给予早期营养支持。
对照组患者采用早期肠外营养支持。术后12~24 h 采用标准3 L 营养袋进行静脉补液,配置方案为:中/长链脂肪乳(规格:20%:250 mL,华瑞制药有限公司,国药准字:H20041101)15 mL·kg-1;复方氨基酸(规格:250mL:25.90g 总氨基酸,辰欣药业股份有限公司,国药准字:H20057116)50 mL·kg-1;维生素C(规格:2mL:0.5g,河南科伦药业有限公司,国药准字:H20064634)180 mg;葡萄糖氯化钠注射液(规格:500 mL 中含葡萄糖50g、氯化钠4.5g,朝阳凌桥制药有限公司,国药准字:H21021540)500 mL;复方电解质注射液(规格:1000 mL 中含氯化钠6.80g、氯化钾0.30g、六水合氯化镁0.20g、二水合氯化钙0.37g、三水合醋酸钠3.27g、L-苹果酸0.67g,山西振东泰盛制药有限公司,国药准字:H20113035),结合患者具体情况设置剂量。补充营养能量按照125.52 kJ·d-1,维持剂量直至患者病情稳定可进流食为止。
观察组实施早期肠内营养支持。首先给予所有患者置入喂养管到胃、十二指肠或空肠上端。术后12 h,先利用营养管输注30℃生理盐水250 mL,观察患者临床症状,若无不良反应发生,第2d 给予患者能全力(规格:0.75 kcal·mL-1,纽迪希亚制药(无锡)有限公司,国药准字:H20010284)1500 kcal·d-1,初始滴速设置为15 滴·min-1,若患者无不适症状,滴速调整为30 滴·min-1,第5d 开始增加能全力用量使补充营养能量达到2000 kcal,维持剂量,在营养支持期间,营养制剂可保温在38~40℃。每隔4 h 对喂养管进行管道冲洗一次,待患者病情稳定,可进流食物时,撤出喂养管。
比较两组患者营养状况改善情况、免疫水平变化、术后恢复情况、肠黏膜屏障功能以及并发症的发生。
1.3 观察资料
1.3.1 营养状况改善情况对比
分别在术后24 h 及术后1w 早晨抽取患者4 mL 外周静脉血,4000 rpm 离心10 min,分离血清,使用iMagic-M7 型号的全自动生化分析仪检测患者血清前白蛋白(Prealbumin,PA)、血清白蛋白(Serum albumin,ALB)、血清总蛋白(Serum total protein,STP)水平。仪器由上海寰熙医疗器械有限公司提供。
1.3.2 免疫水平变化对比
分别在术后24 h 及术后1w 早晨抽取患者5 mL 外周静脉血,4000 rpm 离心10 min,分离血清,置于-28℃的低温储藏柜中备用。使用全自动生化分析仪检测患者血清中免疫球蛋白 A(Immunoglobulin A,IgA)、免疫球蛋白 M(Immunoglobulin M,IgM)、免疫球蛋白 G(Immunoglobulin G,IgG)水平。
1.3.3 术后恢复情况对比
详细记录两组患者术后肛门排气时间、排便时间及总住院时间。
1.3.4 肠黏膜屏障功能评价指标对比
分别在术后24 h 及术后1w 后,抽取备用的离心后的静脉血清,采用偶氮基质显色法检测两组患者内毒素;采用化学比色法测定两组血清二胺氧化酶(Diamine oxidase,DAO);采用酶联免疫法检测两组肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)。试剂均由上海笃玛生物科技有限公司提供。
1.3.5 并发症发生率
观察两组患者在治疗过程中并发症的发生情况,包括:应激性溃疡、呼吸抑制、腹胀腹泻、急性心衰情况。
1.4 统计学分析
所有数据使用SSPS25.0 软件进行统计学分析。计量资料以均数±标准差(±SD)表示,采用t检验;计数资料以例数(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 营养状况改善情况对比
术后1w,两组患者PA、ALB、STP 水平较术后24 h 明显升高(P<0.05);观察组术后1 周PA、ALB、STP 水平均明显高于对照组(P<0.05)。见表1。
表1 两组营养状况改善情况对比(±SD)
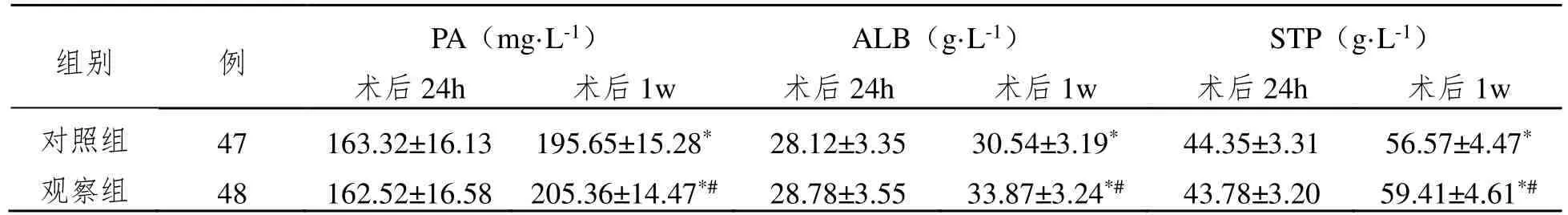
表1 两组营养状况改善情况对比(±SD)
注:与术后24h 相比,*P <0.05;与对照组相比,#P <0.05。
组别 例 PA(mg·L-1) ALB(g·L-1) STP(g·L-1)术后24h 术后1w 术后24h 术后1w 术后24h 术后1w对照组 47 163.32±16.13 195.65±15.28* 28.12±3.35 30.54±3.19* 44.35±3.31 56.57±4.47*观察组 48 162.52±16.58 205.36±14.47*# 28.78±3.55 33.87±3.24*# 43.78±3.20 59.41±4.61*#
2.2 术后恢复情况对比
观察组肛门排气时间、排便时间、住院时间较对照组更短(P<0.05)。见表2。
表2 两组术后恢复情况对比(±SD)

表2 两组术后恢复情况对比(±SD)
注:与对照组相比,#P <0.05。
组别 例 肛门排气时间(h) 排便时间(h) 住院时间(d)对照组 47 73.35±22.31 74.35±7.68 15.67±1.98观察组 48 48.28±17.65# 66.35±6.28# 12.87±1.95#
2.3 免疫水平变化对比
术后1w,两组患者血清IgA、IgM、IgG 较术后24 h 明显升高(P<0.05);观察组术后1w 的血清IgA、IgM、IgG 水平高于对照组(P<0.05)。见表3。
表3 两组免疫水平变化对比(±SD)
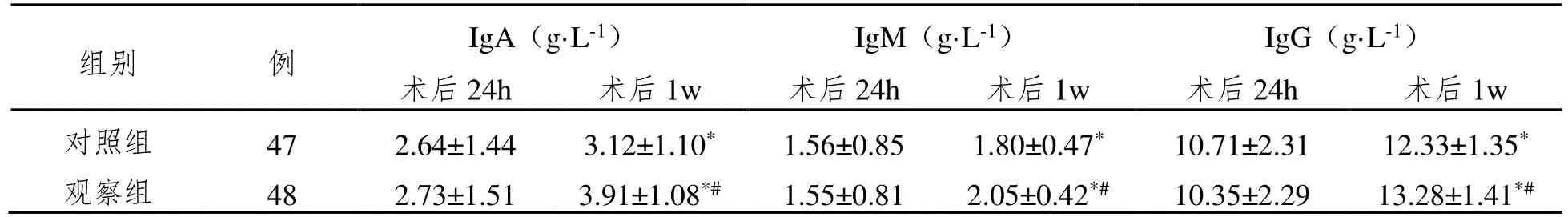
表3 两组免疫水平变化对比(±SD)
注:与术后24h 相比,*P <0.05;与对照组相比,#P <0.05。
组别 例 IgA(g·L-1) IgM(g·L-1) IgG(g·L-1)术后24h 术后1w 术后24h 术后1w 术后24h 术后1w对照组 47 2.64±1.44 3.12±1.10* 1.56±0.85 1.80±0.47* 10.71±2.31 12.33±1.35*观察组 48 2.73±1.51 3.91±1.08*# 1.55±0.81 2.05±0.42*# 10.35±2.29 13.28±1.41*#
2.4 肠黏膜屏障功能评价指标对比
术后1w,两组患者内毒素、DAO、TNF-α水平较术后24 h 明显降低(P <0.05);观察组术后1w 内毒素、DAO、TNF-α水平均低于对照组(P <0.05)。见表4。
表4 肠黏膜屏障功能指标变化对比(±SD)

表4 肠黏膜屏障功能指标变化对比(±SD)
注:与术后24h 相比,*P <0.05;与对照组相比,#P <0.05。
组别 例 内毒素(EU·mL-1) DAO(U·mL-1) TNF-α(pg·mL-1)术后24 h 术后1 w 术后24 h 术后1 w 术后24 h 术后1 w对照组 47 0.74±0.25 0.60±0.27* 6.75±2.11 5.21±1.62* 50.34±12.21 44.54±9.58*观察组 48 0.75±0.26 0.43±0.22*# 6.73±2.15 4.22±1.58*# 51.19±11.18 38.64±8.85*#
2.4 并发症发生率对比
观察组并发症发生率明显低于对照组(P <0.05)。见表5。

表5 两组并发症发生率对比(例(%))
3 讨论
外科手术是临床治疗贲门癌的有效方式,但对患者躯体损伤较大,加上癌症患者多伴随身体素质、恢复力、免疫力、抵抗力显著下降,且术后极易发生机体代谢异常,出现高代谢、营养吸收障碍、免疫应激反应等,引起肠粘膜下血管扩张,导致肠道微循环障碍,进而发生肠道粘膜屏障功能受损,加剧患者抵抗力、免疫力降低及营养不良的情况,术后并发症的发生风险高,影响预后[5~7]。营养支持是以营养学为基础,为机体提供所需营养,根据其具体情况,给予肠内或肠外营养支持,可有效维护患者消化道的形态及功能,调节肠道黏膜,优势明显[8]。本研究对贲门癌患者术后采用营养支持,分析对比肠内外营养支持对胃粘膜的保护作用及免疫功能的影响,为贲门癌患者术后营养支持的最佳方式提供参考。
本研究对贲门癌患者采用肠内营养支持,结果显示,手术切除24 h 后结合患者情况进行营养支持,1w 后,两组患者PA、ALB、STP 水平均升高,且观察组PA、ALB、STP 水平均明显高于对照组,肛门排气时间、排便时间、住院时间均较对照组更短,而观察组并发症发生率为8.33%,明显低于对照组25.53%,与Virizuela JA 等研究结果一致[9],说明贲门癌患者术后进行肠内营养支持可明显提高患者的营养状况,促进患者术后恢复,并且可减少恢复过程中不良情况的发生率,增加治疗安全性。肠外营养支持主要通过静滴的方式向机体输送营养液,可在一定程度上提高患者的营养功能,但对胃肠功能的恢复无明显效果。而肠内营养支持通过肠道途径,更符合人类正常生理特点,肠内营养混悬液含有大量的膳食纤维及人体必需营养要素,可为肠粘膜提供足够的营养素,能改善机体营养状态,促进术后恢复[10]。
本研究结果还显示,术后1w,两组患者血清IgA、IgM、IgG 较术后24 h 明显升高,内毒素、DAO、TNF-α水平较术后24 h 明显降低,观察组术后1w 的血清IgA、IgM、IgG 水平及内毒素、DAO、TNF-α水平均较对照组改善更佳。说明贲门癌患者肠内营养支持可改善患者肠黏膜屏障功能,提高免疫水平。分析原因:IgA、IgM、IgG 均是人体中免疫复合物,是人体的免疫屏障,当机体出现感染,IgA、IgM、IgG 明显降低,提示患者免疫水平降低,导致术后感染风险增加。内毒素、DAO、TNF-α均是临床反映肠粘膜屏障功能的常用指标,术后若未能及时给予患者肠道必要的刺激及营养支持,极易发生肠粘膜通透性增加、萎缩、损伤等生理机械屏障改变,导致肠道中内毒素、细菌等移位,进入血液,发生全身感染,从而导致血液中内毒素、DAO、TNF-α含量升高,对患者进行早期肠内营养支持,有助于维持胃肠道结构和屏障功能完整性,减少肠粘膜屏障萎缩等情况,避免肠道菌群移位,降低并发症发生风险[11]。激活肠道神经内分泌免疫轴,提高机体免疫功能[12]。
综上所述,贲门癌患者术后采用肠内营养支持可有效改善患者的营养状况,提高免疫功能,促进肠黏膜屏障功能恢复,降低并发症发生率,应用价值较高。
