低K+条件下罗布麻对盐胁迫的光合响应机制
2022-05-23崔彦农夏曾润柴薇薇王文颖王锁民
崔彦农,夏曾润,贾 文,柴薇薇,王文颖,王锁民
(1. 草地农业生态系统国家重点实验室 / 农业农村部草牧业创新重点实验室 / 兰州大学草地农业科技学院, 甘肃 兰州 730020;2. 农业农村部富硒产品开发与质量控制重点实验室 / 富硒食品开发国家地方联合工程实验室 / 安康市富硒产品研发中心, 陕西 安康 725000)
土壤盐渍化是限制植物生长最主要的环境因素之一[1]。全球约10%的陆地和30%的灌溉地已受到不同程度盐渍化的影响,每年造成的农业经济损失超过110亿美元[2-3]。我国盐渍化土地分布范围广且类型复杂,总面积约为1亿hm2[4]。研究表明,盐胁迫会抑制大多数植物的光合作用,主要表现为光合速率降低、气孔关闭和叶绿素含量减少等[5-7];同时,盐胁迫下植物叶绿素荧光参数如最大荧光、最大光电子产率、潜在光化学活性、光系统(PS)Ⅱ有效光电子产量及光化学猝灭系数等也会明显降低[8]。
钾离子(K+)作为植物必需矿质营养元素之一,是多种酶的活化剂,在维持蛋白结构和膜电势中发挥着重要作用,也是植物体内最主要的无机渗透调节物质之一;同时K+还具改善气孔运动、优化光合性能、促进光合产物的转运等功能[9-10]。由于K+容易被硅酸盐和黏土颗粒吸附,因此自然条件下可供植物根系吸收的K+通常处于较低水平[11-12]。我国现有耕地中,有近三分之一的土壤缺K+,尤其是在西北干旱和半干旱地区,由于土壤贫瘠、氮肥和磷肥的大量使用使得土壤中K+进一步流失,因此K+亏缺是限制这些地区农业生产的另一主要环境因素[13]。
农作物和牧草因长期生长在优裕的耕作条件下,其抗逆性的遗传潜力十分有限[14-15]。在全球气候变化和人口不断增加的背景下,利用现代分子遗传学手段提高农作物和牧草对逆境的适应能力已成为保证粮食安全的重要途径之一[16]。因此研究并明晰植物的耐盐机制将为农作物和牧草抗逆性的遗传改良提供重要的理论依据,同时对我国农牧业发展与生态环境建设具有重要的战略意义[17]。
罗布麻(Apocynum venetum)是夹竹桃科罗布麻属多年生灌木,对多种环境胁迫如干旱和盐渍化具极强的适应能力,因此是防风固沙、水土保持和荒漠绿化的理想树种;同时罗布麻极高的药理活性和纤维利用价值使其成为我国荒漠地区的重要资源植物[18-21]。前期研究[21-22]表明,罗布麻是一种典型的钾营养高效植物,其在低K+环境下可以维持极高的K+吸收和利用效率;同时,干旱胁迫下罗布麻可在地上部同时积累大量Na+和K+以提高叶片渗透调节能力。但目前有关该植物对低K+条件和盐胁迫的光合响应机制还未见报道。鉴于此,本研究通过温室盆栽试验,研究低钾和正常钾供应水平下罗布麻幼苗叶片光合气体交换、PSⅡ光化学活性及光能分配对盐胁迫的响应,以期揭示罗布麻对缺钾和高盐生境的适应特性。
1 材料与方法
1.1 材料培养
于2015年5月采用扦插法培养罗布麻幼苗,试验用土为黄土与草炭土按10 : 1比例混合,全氮含量为0.74 mg·g-1,全磷含量为0.95 mg·g-1,有机质含量为1.62 mg·g-1,K+含量为0.11 mg·g-1。待扦插苗生长4周后,选取株高约10 cm、长势一致的扦插苗移栽至装有1 kg培养土的花盆(口径14.5 cm,底径10.0 cm,高10.5 cm)中,每盆移植15株幼苗,并用1/2 Hoagland营养液[2 mmol·L-1KNO3,0.5 mmol·L-1KH2PO4,0.5 mmol·L-1Ca(NO3)2,0.5 mmol·L-1MgSO4,60 μmol·L-1Fe-citrate,50 μmol·L-1H3BO3,10 μmol·L-1MnCl2,1.6 μmol·L-1ZnSO4,0.6 μmol·L-1CuSO4,0.05 μmol·L-1Na2MoO4,pH 5.7]培养。温室昼夜温度为25 ℃/19 ℃,相对湿度为60%,光强约为800 μmol·(m2·s)-1,光照时长为16 h·d-1。移栽两周后间苗,每盆保留8~10株生长健壮的幼苗。
1.2 试验处理
间苗一周后将罗布麻幼苗随机分为低钾(0.01 mmol·L-1K+)组和正常钾(2.5 mmol·L-1K+)组处理。低钾组处理设置为:1)对照 Ⅰ:用含0.01 mmol·L-1K+的1/2 Hoagland营养液(原营养液中KH2PO4和KNO3分别用等浓度H3PO4和HNO3替换,0.01 mmol·L-1K+由KCl补充,用Tris溶液调pH至5.7)处理。2)轻度盐胁迫:用含50 mmol·L-1NaCl及0.01 mmol·L-1K+的1/2 Hoagland营养液处理。3)重度盐胁迫:用含200 mmol·L-1NaCl及0.01 mmol·L-1K+的1/2 Hoagland营养液处理。正常钾组处理设置为:1)对照Ⅱ :用含2.5 mmol·L-1K+的1/2 Hoagland营养液(原营养液中KH2PO4和KNO3分别用等浓度H3PO4和HNO3替换,2.5 mmol·L-1K+由KCl补充,调pH至5.7)处理。2)轻度盐胁迫:用含50 mmol·L-1NaCl及2.5 mmol·L-1K+的1/2 Hoagland营养液处理。3)重度盐胁 迫:用含200 mmol·L-1NaCl及2.5 mmol·L-1K+的1/2 Hoagland营养液处理。每3 d浇灌一次处理液,每盆每次浇灌量300 mL。处理5周后观察到低钾组重度盐胁迫处理下的幼苗叶片开始发黄,随即测定各处理下植株光合速率、光合气体交换及叶绿素荧光动力学参数。所有参数均使用6株幼苗作为重复。
1.3 指标测定及方法
1.3.1光合气体交换参数
用LI-6400便携式光合测量系统(LI-COR,美国)于08:30 - 11:30测定成熟功能叶的净光合速率(net photosynthetic rate, Pn),气孔导度(stomatal conductance, Gs)、蒸腾速率(transpiration rate, Tr)及胞间CO2浓度(intercellular CO2concentration, Ci)等光合气体交换参数。测定时,维持温室中空气CO2浓度(air CO2concentration, Ca)为410 μmol·mol-1,光强 为800 μmol·(m2·s)-1,温 度 为25 ℃,相 对 湿 度 为50%~55%。最后计算叶片水分利用效率(water use efficiency, WUE),WUE=Pn/Tr[23],以及气孔限制值(Ls) = 1 -Ci/Ca[24]。
1.3.2叶绿素荧光动力学参数
参照Zhang等[25]的方法,在温室光周期开始前用MINI-PAM叶绿素荧光仪(Walz,德国)测定各处理下植株叶绿素荧光动力学参数。测量利用饱和脉冲模式,首先开启检测红光[光强为0.5 μmol·(m2·s)-1,脉冲频率为1 Hz],得到叶绿素初始荧光(Fo),再开启强饱和脉冲光[4 000 μmol·(m2·s)-1,0.8 s]测得最大荧光(Fm)。计算得出可变荧光(Fv),Fv=Fm-Fo。随后 使用 光 化光[500 μmol·(m2·s)-1]和强 饱 和脉 冲 光[8 000 μmol·(m2·s)-1,0.8 s]照射罗布麻叶片,在执行饱和脉冲前测得瞬时荧光(Ft),每隔20 s照射一次饱和脉冲,测量光诱导的最大荧光(Fm′)。
从WinControl-3-3.21软件输出的结果中选取趋于稳定的数值计算PSⅡ最大光化学效率(Fv/Fm) =(Fm-Fo)/Fm′潜在光化学活性(Fv/Fo) = (Fm-Fo)/Fo以及实际光化学效率(ΦPSⅡ) = (Fm′-Ft)/Fm′、激发能量 捕获 效 率(Fv′ /Fm′) = (Fm′-Fo)/Fm′、光化学 猝 灭(qP) = (Fm′-Ft)/(Fm′-Fo′)及 非 光 化 学 荧 光 猝 灭(NPQ) =Fm/Fm′- 1。以上公式均参考Schreiber等[26]。
PSⅡ吸收光能分配比例参照Demmig-Adams等[27]方法计算:光化学反应能量(P) = (Fv′/Fm′) ×qP、天线 色 素 耗散 能 量(D) = 1 - (Fv′/Fm′)、非 光 化 学 反应耗散能量(E) = (Fv′/Fm′) × (1 -qP)。
1.4 数据处理
采用SPSS 19.0软件分析数据,并用单因素方差分析(ANOVA)进行差异显著性分析(Duncan多重检验)。数据以平均值 ± 标准误的形式表示。
2 结果
2.1 不同K+水平下罗布麻幼苗叶片光合速率对盐胁迫的响应
对照条件下(未添加NaCl),低钾组植株Pn与正常钾组植株无明显差异(图1),表明低K+胁迫对罗布麻光合作用无影响。不论是低钾组还是正常钾组,与对照相比,两个NaCl处理,尤其是200 mmol·L-1NaCl处理,显著降低了Pn(P< 0.05),表明盐胁迫严重抑制了罗布麻的光合作用。50 mmol·L-1NaCl处理下,正常钾组Pn是低钾组的1.5倍以上,这表明轻度盐处理下介质中足量的K+有助于改善罗布麻的光合性能。

图1 低K+和正常K+处理下盐胁迫对罗布麻幼苗叶片净光合速率的影响Figure 1 Effect of salt stress on the net photosynthetic rate of Apocynum venetum seedlings under low and normal K+treatments
2.2 不同K + 水平下罗布麻叶片气体交换对盐胁迫的响应
对照条件下(未添加NaCl),正常钾组植株Gs和Ls均显著高于低钾组植株(P< 0.05) (表1),表明低K+供应水平抑制了罗布麻气孔开放过程。不论在低钾组还是在正常钾组,相比于对照,两个NaCl处理,尤其是200 mmol·L-1NaCl处理,大幅降低了Gs、Tr和Ci,而显著提高了Ls(P< 0.05),表明盐胁迫通过限制气孔开放从而影响了植株蒸腾作用及对光合作用原料CO2的获取;相反,不论是低钾组还是正常钾组,200 mmol·L-1NaCl处理后叶片WUE是对照条件下的3倍以上,说明盐胁迫虽然严重限制了蒸腾作用从而减少了水分向地上部的运输,但罗布麻能够通过提高水分在叶片中的利用效率以维持光合器官的生长。
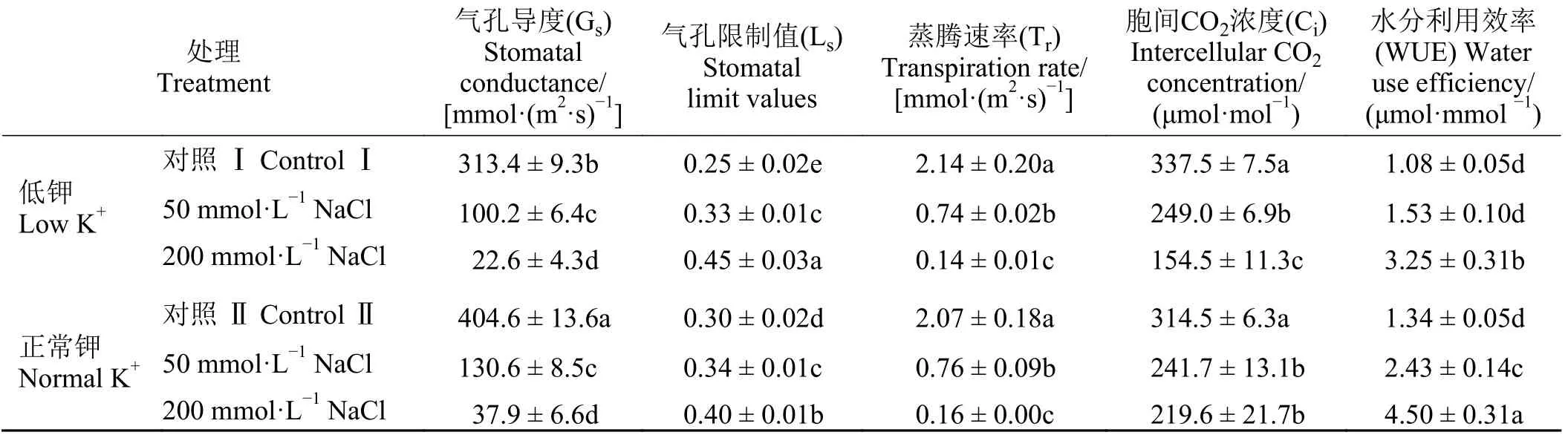
表1 低K + 和正常K + 处理下盐胁迫对罗布麻幼苗叶片气体交换参数和水分利用效率的影响Table 1 Effect of salt stress on the gas exchange parameters and water use efficiency of Apocynum venetumseedlings under low and normal K + treatments
2.3 不同K+水平下罗布麻叶片叶绿素荧光参数对盐胁迫的响应
对照条件下(未添加NaCl),低钾组Fv/Fm、Fv/Fo、ΦPSⅡ、Fv′/Fm′、qP及NPQ与正常钾组均无显著差异(P> 0.05) (图2),表明低K+供应水平对罗布麻PSⅡ的正常运行未产生明显影响。无论在低钾组还是正常钾组,相比于对照,50 mmol·L-1NaCl处理对上述参数均无影响,而200 mmol·L-1NaCl处理显著降低了除NPQ外的上述参数(P< 0.05),表明高盐胁迫还影响了罗布麻PSⅡ的结构和功能,从而进一步抑制了植株的光合作用。

图2 低K+和正常K+处理下盐胁迫对罗布麻叶片叶绿素荧光参数的影响Figure 2 Effect of salt stress on the chlorophyll fluorescence parameters of Apocynum venetum seedlings under low and normal K+treatments
2.4 不同K+水平下罗布麻叶片吸收光能分配对盐胁迫的响应
无论在对照还是NaCl处理下,罗布麻叶片吸收的光能中用于光化学反应的部分(P)、天线色素耗散能量(D)和非光化学反应耗散能量(E)的分配特征在两个供K+水平之间均无显著差异(P> 0.05) (图3),表明K+供应水平对正常条件和盐胁迫下罗布麻光能利用特征无影响。与对照相比,低盐胁迫对P、D、E无影响,高盐胁迫则显著(P< 0.05)降低了P而提高了D和E (图3)。
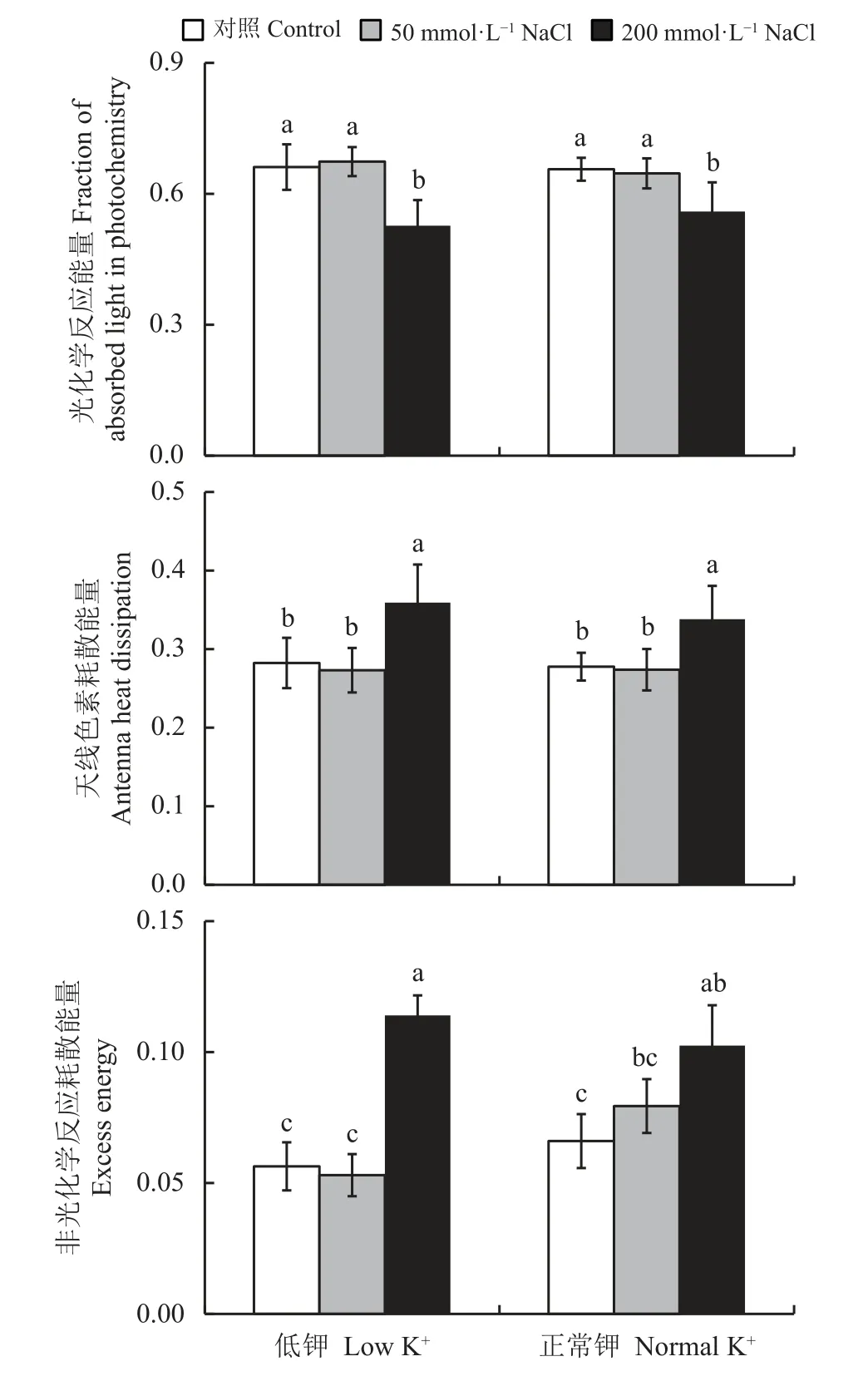
图3 低K+和正常K+处理下盐胁迫对罗布麻幼苗叶片吸收光能分配的影响Figure 3 Effect of salt stress on the light energy allocation of Apocynum venetum seedlings under low and normal K+ treatments
3 讨论与结论
光合作用是植物进行物质生产的基础生物学过程,在有机同化物的积累及能量的吸收、固定、分配与转化中起到关键作用[28]。本研究中,NaCl处理下罗布麻叶片Pn较对照条件下显著降低(图1),表明盐胁迫抑制了罗布麻的光合作用。同时,NaCl处理后罗布麻叶片Ci显著下降而Ls显著升高(表1),表明盐胁迫下植株叶片气孔扩散阻力增加,气孔收缩,阻碍了外界CO2进入叶肉细胞,导致光合碳固定底物减少,进而引起光合速率降低,因此气孔限制是盐胁迫下罗布麻幼苗光合速率降低的主要因素。
维持气孔的开放对植物的蒸腾作用至关重要[29-30]。气孔的开放依赖于保卫细胞体积的膨大,该过程主要通过将K+大量转运和积累至保卫细胞中完成[31-32]。本研究发现,正常条件下(未添加NaCl),低K+处理显著降低了Ci,而显著提高了Ls(表1),表明低K+条件导致罗布麻气孔开放受阻;但Pn、Tr和Ci在低K+和正常K+处理下均无显著差异(图1和表1),推测在低K+环境下罗布麻具特殊的机制以缓解气孔因素对光合和蒸腾作用的限制,从而维持植株的生长以及水分向地上部的转运。两种供K+水平下,添加NaCl显著降低了Pn和Ci,而显著提高了Ls(图1和表1),表明盐胁迫下气孔因素是限制罗布麻光合作用的主要原因,这可能是由于盐处理后植物对K+的吸收会受Na+吸收的竞争性抑制,使得植株叶中缺乏足够的K+用以调节保卫细胞体积所致。值得注意的是,盐处理下罗布麻叶片水分利用效率较对照大幅度升高(表1),这与另一种荒漠植物霸王(Zygophyllum xanthoxylum)叶片水分利用效率对盐胁迫的响应趋势类似[33],表明提高叶片水分利用效率可能是荒漠植物应对盐胁迫引起的气孔限制的重要生理机制之一。此外,50 mmol·L-1NaCl处理后,低K+组植株Pn显著(P< 0.05)低于正常K+组植株,但Ci在两个供K+水平下无明显差异(图1和表1),表明盐胁迫下低供K+水平对罗布麻光合作用的抑制可能主要由非气孔限制因素引起。
PSⅡ是环境胁迫下植物光合器官受损的原初位点之一,因此维持PSⅡ的正常运行在植物适应逆境中起着关键作用[26]。目前有关盐胁迫对植物PSⅡ活性影响的报道较多,有研究发现盐胁迫会抑制植物PSⅡ的功能[6],但也有研究表明盐胁迫对植物PSⅡ的活性无明显影响或有促进作用[34-35]。本研究中50 mmol·L-1NaCl处理对罗布麻PSⅡ功能无影响(图2);但200 mmol·L-1NaCl处理后,罗布麻叶绿素荧光参数Fv/Fm、Fv/Fo、ΦPSⅡ、Fv’/Fm’及qP均显著低于对照(图2),表明重度盐胁迫对罗布麻PSⅡ造成了严重损害,导致了Pn的进一步下降(图1)。
逆境胁迫下,植物体内的碳同化能力通常会减弱,导致光能利用率下降,因此植株会通过改变光能分配以缓解光能过剩的危害[36]。本研究中,低K+处理对罗布麻光能分配无明显影响(图3)。两个供K+水平下,50 mmol·L-1NaCl处理下罗布麻幼苗叶片吸收光能的分配模式与对照无显著差异(图3);但200 mmol·L-1NaCl处理后罗布麻通过降低光化学反应能量的份额并增加天线色素和非光化学反应耗散能量的份额来消耗过剩的光能(图3);NPQ表示植物热耗散过剩激发能的能力[37-38],本研究中200 mmol·L-1NaCl处理后NPQ较对照也明显升高(图2),表明高盐胁迫下罗布麻叶片通过提高热耗散消耗过多激发能并降低用于光反应的量来缓解过剩光能对光合系统的损伤。
综上,罗布麻可通过维持较高的叶片净光合速率以适应低K+环境;虽然高盐处理下罗布麻叶片净光合速率、光合气体交换和PSⅡ的活性均受到抑制,但其可通过提高叶片水分利用效率并增加热耗散以减轻光合系统受到的危害。有关罗布麻光合作用对低钾和盐胁迫的适应机制的进一步深入研究将有望挖掘其抗逆关键基因用于提高传统农作物和牧草在逆境条件下的光合性能。
