低浓度人参水提液对肺A549细胞癌性的影响及其机制研究
2022-05-22王武斌张彬彬罗志强闫聪史渊源
王武斌 张彬彬 罗志强 闫聪 史渊源
摘要 目的:探讨低浓度人参水提液(LWEG)对肺癌A549细胞癌性包括细胞增殖、迁移、侵袭等生物学行为的影响,以更加全面地了解人参对肺癌A549细胞的影响。方法:将细胞分为对照组、WEG组(1.25,2.5,5,10,20,40,80,160 mg/mL)。通过MTT法检测不同浓度WEG对A549细胞增殖的影响,进而筛选出LWEG的浓度范围,再通过划痕实验与Transwell小室侵袭实验分别检测LWEG(2.5,5,10 mg/mL)对A549细胞迁移、侵袭能力的影响。并运用网络药理学研究策略对其潜在的作用机制进行预测分析。结果:与对照组相比,LWEG组A549细胞增殖显著增加,细胞的迁移和侵袭能力均明显增强,差异有统计学意义(P<0.05)。网络药理学预测分析表明这一作用可能与ErbB信号通路及代谢和应激反应有较大关联。结论:LWEG直接作用于A549细胞,能够提高A549细胞的增殖、迁移和侵袭能力。
关键词 低浓度人参水提液;A549细胞;增殖;迁移;侵袭;机制;网络药理学
Effect and Mechanism of Low-concentration Water Extract of Ginseng on A549 Cells
WANG Wubin1,ZHANG Binbin1,LUO Zhiqiang1,YAN Cong1,SHI Yuanyuan1,2
( School of Life Sciences,Beijing University of Chinese Medicine,Beijing 100029,China; 2 Shenzhen Research Institute,Beijing University of Chinese Medicine,Shenzhen 518118,China)
Abstract Objective:To study the effects of low-concentration water extract of ginseng(LWEG) on the proliferation,migration and invasion capacity of lung cancer A549 cells,in order to fully understand the effects of ginseng on A549 cells.Methods:The cells were divided into blank control group and WEG groups(1.25,2.5,5,10,20,40,80,160 mg/mL).The effect of different concentrations of WEG on the proliferation of A549 cells was detected using MTT assay to screen out the concentration range of LWEG.Wound healing assay and Transwell migration assay were conducted to test the effects of LWEG(2.5,5,10 mg/mL) on migration and invasion capacity of A549 cells,respectively,and the potential mechanism was explored by network pharmacology.Results:Compared with the conditions in the blank control group,the proliferation,migration and invasion capacity of A549 cells in the LWEG group were increased(P<0.05),and the mechanism may be associated with the ErbB signaling pathway,metabolism and stress response based on network pharmacology.Conclusion:The study indicated that LWEG improved the proliferation,migration and invasion capacity of A549 cells in a direct way.
Keywords Low-concentration water extract of ginseng; A549 cells; Proliferation; Migration; Invasion; Mechanism; Network pharmacology
中圖分类号:R273;R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.05.016
肺癌是世界上发病率与病死率最高的恶性肿瘤之一,每年约有180万~800万人被诊断为肺癌,有160万~600万人死于肺癌[1]。而我国肺癌的发病率与病死率在恶性肿瘤中占首位[2]。肺癌的总体预后较差,由于分期和地域差异,其5年生存率为4%~17%[1]。
近年来,补充和替代医疗(Complementary and Alternative Medicine,CAM)在癌症治疗中的受欢迎程度迅速提高[3-4]。其中人参是最常用的产品,作为传统医药中著名的药材,人参被认为是大补元气之药,可增强人体免疫力等,从而被用于多种癌症包括肺癌的补充治疗,研究证明食用人参可以在癌症期间改善患者的健康状况[5]。而现代研究也表明人参所含的多种成分,如人参皂苷CK[6-8]、人参皂苷KG-135[9]、人参多糖[10]等,均具有抑制体外癌细胞增殖的作用,但这一作用多存在剂量效应,关于低浓度的人参成分对癌细胞的作用很少提及。故本研究探究了不同剂量低浓度人参水提液对肺腺癌A549细胞癌性的影响,从而对低浓度人参水提液对癌细胞癌性的影响进行初步探究,并对其作用机制进行基于网络药理学研究策略的分析预测,为临床应用人参治疗肺癌的剂量使用提供一定的参考。
材料与方法
1. 材料
1.1. 细胞 人肺腺癌A549细胞株购于中国医学科学院基础医学研究所细胞资源中心,A549细胞编号:1101HUM-PUMC000002。
1.1.2 药物 人参饮片(北京同仁堂公司,批号:190401)。
1.1.3 试剂与仪器 胎牛血清(GIBCO,美国,货号:10099141C);磷酸盐缓冲液干粉(北京索莱宝科技有限公司,货号:P1010);MTT噻唑蓝(北京索莱宝科技有限公司,货号:M8180);二甲基亚砜(Sigma,美国,货号:D2650);Matrigel基质胶(Corning,美国,货号:356234);人参皂苷Re(源叶,货号:B21055);人参总皂苷(源叶,货号:S25997);Transwell小室(Corning,美国,货号:3422);RPMI 1640培养基(Corning,美国,货号:10-040-CV);Penicillin-Streptomycin(GIBCO,美国,货号:15140122);CO 2恒温培养箱(Thermo,美国,型号:Steri-Cycle i160);生物安全柜(Thermo,美国,型号:1389-M);自动酶标仪(Molecular Devices,奥地利,SpectraMax i3X);台式冷冻离心机(Eppendorf,德国,型号:5810R);正倒置一体显微镜(ECHO,美国,型号:Revole);倒置显微镜(Olympus,日本,型号:CKX53);桌面摇床(欧诺,型号:HYC-200D)。
1.2 方法
1.2. 人参水提液制备 依据参考文献[11-12],采用传统水煎的方式进行人参水提液的制备。精确称定人参饮片50 g,加入8倍量水(即400 mL),浸泡30 min,85 ℃煎煮 h,过滤药液待用;向药渣中加入8倍量的水,同法煎煮 h过滤,合并2次滤液,浓缩至50 mL,得到 g/mL的人参水提液。将所得人参水提液以7 714×g离心15 min,取上清,过滤除菌后分装,保存至-20 ℃冰箱。经紫外分光光度法检测,所制备的人参水提液中人参总皂苷的含量以人参皂苷Re计可达84.2%。
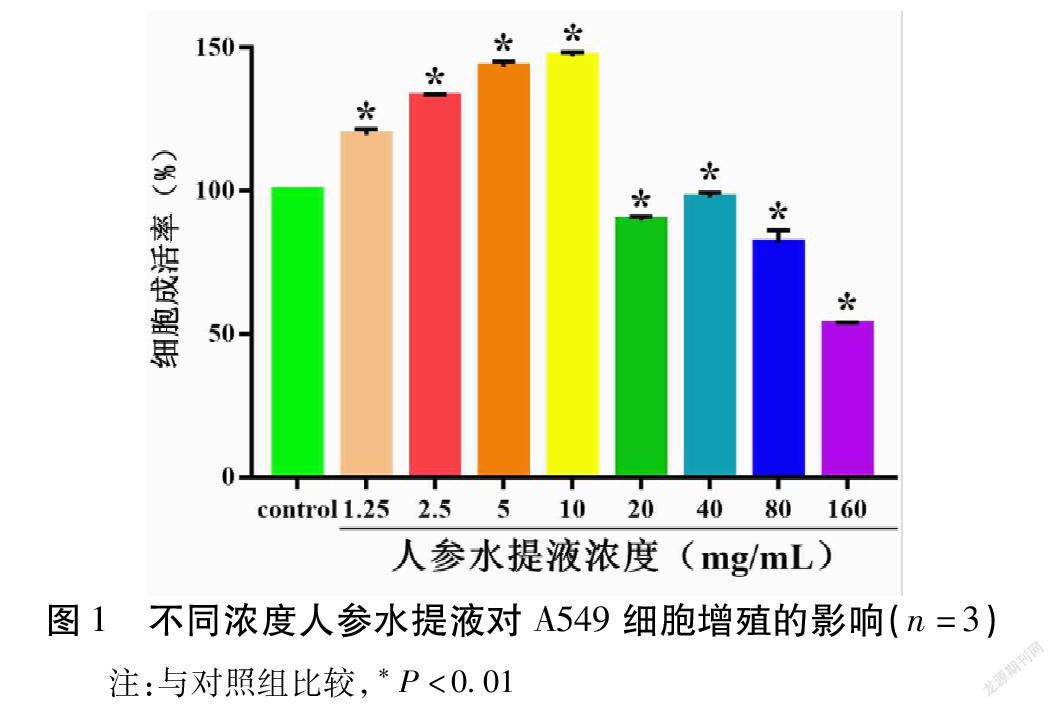
1.2.2 MTT检测细胞增殖并筛选低浓度人参水提液范围 取对数生长期A549细胞,0.25%胰酶消化细胞,终止消化后,调整细胞浓度至3×104 个/mL,将细胞悬液以每孔100 μL接种于96孔细胞培养板中,边缘孔以无菌磷酸盐缓冲液(PBS)填充。将96孔细胞培养板放入37 ℃、5% CO 2培养箱培养24 h至细胞贴壁。弃去各孔中的培养基,分别用含不同浓度人参水提液的1640培养基处理细胞,共设1.25,2.5,5,10,20,40,80,160 mg/mL,8個人参水提液浓度,其中空白对照组只添加1640培养基,每个组设3个平行对照。加药后将96孔细胞培养板放入CO 2培养箱中继续培养。继续培养24 h后取出相应96孔细胞培养板,每孔加入20 μL MTT溶液,放入CO 2培养箱中孵育4 h。小心弃去上清,向各孔加入150 μL DMSO,于摇床上低速振荡15 min,使结晶物充分溶解。用酶标仪测定各孔在490 nm处的吸光度(OD值),各组实验重复3次。根据公式计算各剂量组不同时间段的细胞相对成活率:细胞成活率=(观察组OD均值/对照组OD均值)×100%。其中各组抑制A549细胞增殖的人参水提液浓度与文献中的浓度相仿[13],由此确定低浓度人参水提液浓度范围应小于20 mg/mL,故选用2.5,5,10 mg/mL浓度进行后续实验。
1.2.3 划痕实验检测细胞迁移 取对数生长期A549细胞,0.25%胰酶消化细胞,终止消化后,调整细胞浓度至1×105 个/mL,将细胞悬液以每孔 mL接种于12孔细胞培养板中,将12孔细胞培养板放入37 ℃,5% CO 2培养箱培养24 h至细胞贴壁。用200 μL移液枪头于每孔中间垂直于细胞表面进行划痕。用PBS洗涤细胞3次,去除被划下的细胞,加入含不同浓度人参水提液(2.5,5,10 mg/mL)的无血清培养基。置于37 ℃,5% CO 2培养箱继续培养,于24 h后镜下观察各组划痕宽度变化,并拍照分析。每组实验重复3次。每条划痕各取3个固定位置的宽度并计算其平均值,最后根据公式计算各组细胞的划痕愈合率:划痕愈合率(%)=(初始划痕宽度-指定时间划痕宽度)/初始划痕宽度×100%。
1.2.4 Transwell小室检测细胞侵袭能力 对Transwell小室的上室进行Matrigel基质胶包被,将Matrigel基质胶稀释至250 μg/mL并充分吹打混匀后,往上室中加入100 μL Matrigel基质胶,37 ℃孵育2 h,去除未结合的Matrigel基质胶。取对数生长期A549细胞,0.25%胰酶消化细胞,分别用含不同浓度人参水提液(2.5,5,10 mg/mL)的无血清培养基调整细胞浓度至1×105 cells/mL。各组分别取200 μL细胞悬液加入到上室中(对照组中不含人参水提液),向下室中加入500 μL含10%胎牛血清的1640培养基,于CO 2培养箱中继续培养24 h。取出小室,用湿润的棉签轻轻擦去上室中未侵袭的细胞,用4%多聚甲醛固定20 min,用PBS清洗3次,用0.1%的结晶紫染液染色15 min,PBS清洗3次,待小室风干后,于显微镜下各组随机挑选5个视野,对上室下面的细胞进行计数,以此表示细胞的侵袭能力。各组实验重复3次。
1.2.5 网络药理学进行机制预测 利用BATMAN-TCM数据库对已知的人参成分与作用靶标进行收集与处理;利用DrugBank和OMIM数据库对已知的与肺癌相关的疾病靶标进行收集处理。使用STRING数据库和Cytoscape软件对收集到的数据进行“人参-靶标-通路”网络的构建及可视化处理,并通过基因本体(Gene Ontology,GO)通路富集分析对低浓度人参水提液对A549细胞潜在的作用机制进行阐释。
1.3 统计学方法
采用SPSS 21.0统计软件进行数据分析,其中计量资料以均数±标准差(±s)表示,两样本比较应用t检验,多个样本比较应用方差分析,以P<0.05为差异有统计学意义。
2 结果
2. 人参水提液对A549细胞增殖的影响及低浓度人参水提液浓度范围的确定 研究结果表明,不同浓度人参水提液对A549细胞的增殖作用效果表现不一。在药物处理24 h后,与对照组比较,1.25,2.5,5,10 mg/mL组人参水提液可促进A549细胞增殖,而20,40,80,160 mg/mL组人参水提液可抑制A549细胞增殖,且均表现出一定的剂量依赖性(P<0.01)。见图1。
2.2 低浓度人参水提液对A549细胞迁移能力的影响
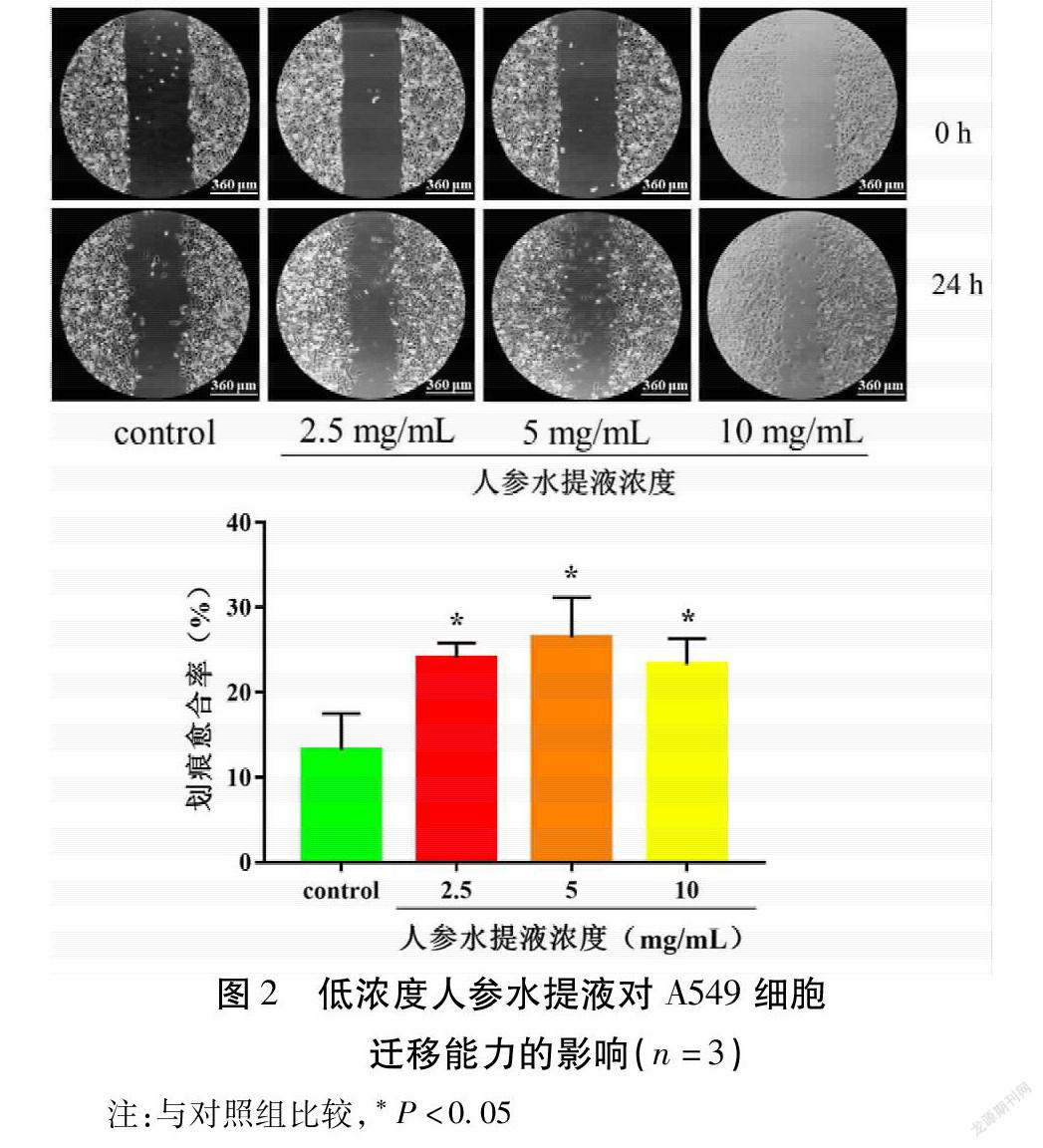
划痕实验结果表明,在给药24 h后,對照组、2.5,5,10 mg/mL观察组的划痕愈合率分别是(13.16±2.52)%,(24.05±1.00)%,(26.44±2.74)%,(23.24±1.77)%。与对照组比较,给药24 h,2.5,5,10 mg/mL观察组的划痕愈合率均明显升高,且以5 mg/mL组作用效果最强(P<0.05)。见图2。
2.3 低浓度人参水提液对A549细胞侵袭能力的影响
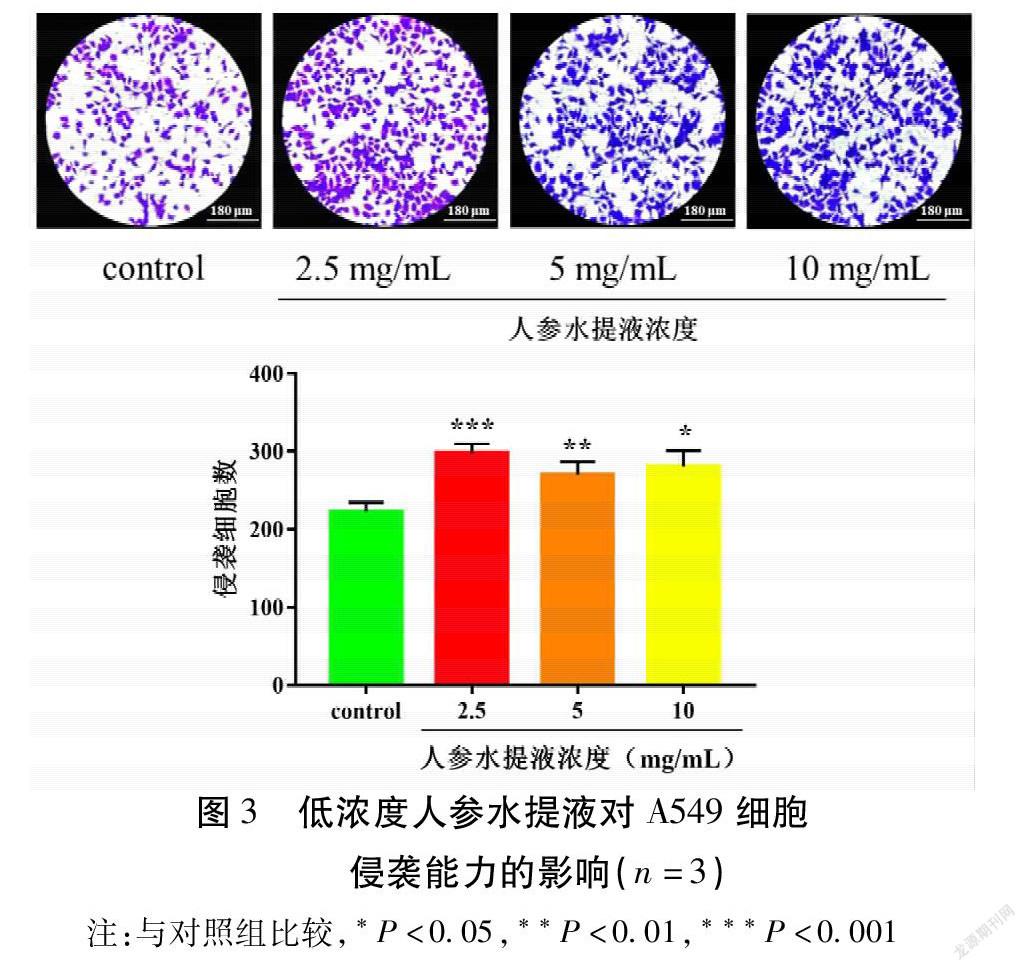
通过Transwell小室侵袭实验检测低浓度人参水提液对A549细胞侵袭能力的影响,实验结果表明,在低浓度人参水提液作用24 h后,观察组穿过Transwell小室微孔滤膜的细胞数目显著高于对照组(P<0.05)。见图3。
2.4 低浓度人参水提液对A549细胞癌性影响的机制预测
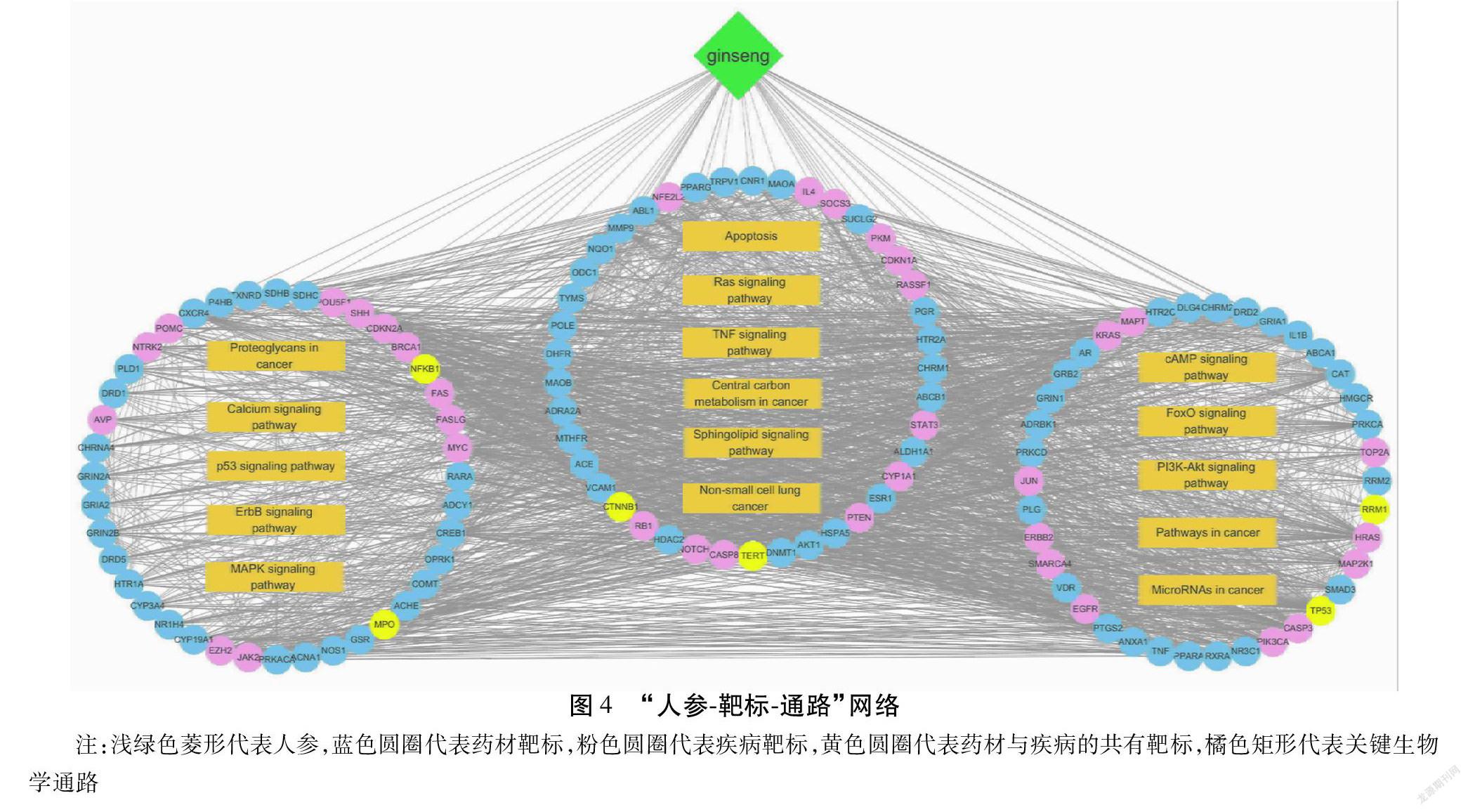
以预测得分≥40和P<0.05作为人参已知成分及其靶标的筛选临界值,共从BATMAN-TCM数据库中得到人参已知成分106个,相关潜在靶标515个。在DrugBank数据库中检索到与肺癌相关的疾病靶标共27个,通过OMIM数据库得到肺癌相关疾病靶标共302个。经去除重复靶标,共有325个与肺癌相关的疾病靶标被用于后续网络分析。
利用STRING数据库获得靶标蛋白之间的相互作用关系9 587对。运用Cytoscape 3.8.0软件构建蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络,计算得到靶标蛋白的拓扑结构特征值,包括degree、betweenness、closeness值。以degree值大于其中位数为筛选条件进行第一次筛选,再以degree、betweenness、closeness值均大于其中位数为筛选条件进行二次筛选,共得到119个关键靶标,其中84个为人参的成分靶标,41个为疾病靶标,6个为二者共有靶标。
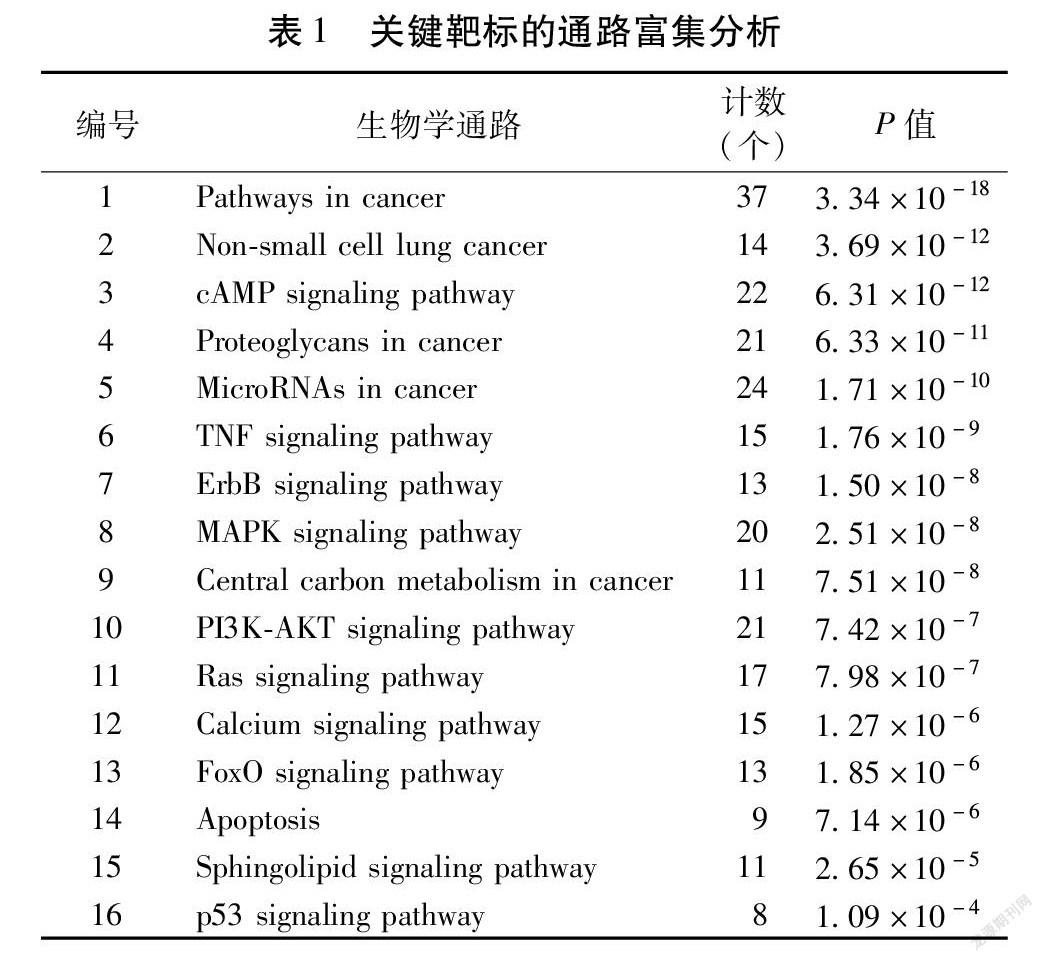
对筛选得到的119个关键靶标进行GO注释与通路富集分析,设定pathway富集的筛选标准为P<0.05和FDR<0.05,共有111条通路满足条件,进一步筛选得到与肺癌密切相关且有相关靶标分子参与的生物学通路16条。这些关键的生物学通路功能主要集中在肿瘤的发生发展、信号传递、应激反应等方面。见表1。
在16条相关生物学通路中,ErbB signaling pathway、p53 signaling pathway、Central carbon metabolism in cancer等通路可能在低浓度人参水提液促进A549细胞癌性的过程中起到了更重要的调控作用,其中ErbB家族蛋白可将细胞外的表皮生长因子信号转入细胞内,通过胞内的信号通路对多种生物反应进行调控,包括细胞增殖、分化、运动和生存。p53 signaling pathway与许多应激反应相关,p53可以被多种应激信号诱导激活,从而作为转录激活因子对细胞周期、衰老和凋亡等生物过程产生调控作用。Central carbon metabolism in cancer这一通路与癌细胞的中央代谢途径相关,不同于正常细胞,癌细胞需要消耗大量的葡萄糖用以维持其较高的糖酵解速率[14]。人参水提液或人参提取物中有较高的含糖量,其总的含糖量可以达到20%~40%[15-16]。大量的糖类可能为癌细胞的代谢提供了一定的物质基础。“人参-靶标-通路”网络见图4。
通过进一步的分析发现ErbB signaling pathway可能在低浓度人参水提液作用于A549细胞的过程中起到了关键的调控作用。这一通路参与到了细胞增殖、运动等多种生物功能的调控之中,并且在16条相关的生物学通路中,有多条信号通路直接或间接地与该通路相互影响,包括MAPK signaling pathway、p53 signaling pathway、PI3K-AKT signaling pathway、Calcium signaling pathway、Non-small cell lung cancer等。同时,在这一通路当中,与低浓度人参水提液作用于肺癌细胞的相关关键靶标共有13个,包括CDKN1A、MAP2K1、JUN、PRKCA、EGFR、PIK3CA、MYC、ERBB2、ABL1、AKT1、KRAS、GRB2、HRAS。这些靶标分子可能在低浓度人参水提液的作用过程起到了关键作用。
3 讨论
CDKN1A在细胞周期进程中发挥着核心作用,它能够在DNA损伤时短暂地募集到目标位点以促进其修复[17]。而CDKN1A的活性依赖于p53的状态,在p53功能缺失突变的情况下,CDKN1A的过表达能使细胞获得一种更具侵略性的表型,使其能够逃脱细胞阻滞、衰老和凋亡[18]。Fukazawa等[19]的研究发现SOX2的致瘤作用部分是通过抑制CDKN1A从而维持肺鳞状细胞癌细胞的生长而产生。
PRKCA、EGFR、PIK3CA、MYC、ERBB2、ABL1、KRAS等基因均被证明在部分肺癌患者中存在突变。其中PRKCA是一个与细胞调节和增殖相关的信号分子,且与肺癌有着密切的联系,在≤20%的非小细胞肺癌(Non Small Cell Lung Cancer,NSCLC)患者中存在着PRKCA的过表达[20]。有研究表明PRKCA与肺癌细胞的衰老过程以及迁移和侵袭力相关[21-23]。EGFR是一种具有胞质激酶活性的跨膜蛋白,能够将重要的生长因子信号从细胞外转导至细胞内[24],并通过对下游通路如MAPK、PI3K/AKT/mTOR、IL-6/JAK/STAT3等通路的调控,对细胞增殖、成活和迁移等生物学行为进行调节[25]。EGFR已被明确认为是NSCLC的驱动因子,在NSCLC的发生发展过程中起到了重要作用。EGFR的突变及其特异性的酪氨酸激酶抑制剂(TKIs)可以产生显著的肿瘤反应[26]。PIK3CA的突变可导致PI3Ks的催化活性增强,从而使得PI3K通路信号上调,导致细胞发生癌变。有较多的研究数据表明PIK3CA可能是肺癌的一个潜在治疗靶点[27]。如Wang等[28]在体内外的研究发现miR-142-5p可通过靶向作用于PIK3CA,达到抑制肺癌细胞增殖的作用。MYC作为癌症中最常见的癌基因之一,是一种能够与增强子序列结合的转录因子,可以激活多种促增殖基因的表达[29],同时也是糖酵解、谷氨酰胺代谢、核苷酸生物合成和其他代谢过程的主要调节因子[30]。已在41%的NSCLC中观察到了MYC的过表达[31],且MYC被认为与变异型小细胞肺癌相关[32]。ERBB2被证明是2%~6%肺癌的驱动因子,并与EGFR酪氨酸激酶抑制剂(TKI)的耐药性相关[33-34]。而Chuang等[35]的临床研究也发现,在9例ERBB2突变的转移性肺腺癌患者中有4例对靶向治疗有反应。ABL1的突变在约1.5%的NSCLC患者中和3%的SCLC患者的基因图谱中被发现,同时具有ABL1突变的NSCLC细胞对ABL抑制剂敏感[36]。在Gu等[37]的研究中则发现,ABL1耗尽会降低肺腺癌细胞向肺实质外渗的能力,机制研究表明ABL激酶可通过对β-catenin和Hippo通路的转录共激活因子TAZ的转录后调控促进NSCLC转移。KRAS突变是NSCLC中最常见的潜在靶向分子亚型。在亚洲,有10%~15%的肺腺癌患者存在KRAS的突变[38]。KRAS具有GTP酶活性,能够激活下游的一些信号通路,比如Raf-MEK-ERK、PI3K-AKT-mTOR、RalGDS-RalA/B和TIAM1-RAC1通路,从而对细胞增殖、凋亡、运动和成活等生物功能产生调控作用[39]。
PI3K-AKT信号通路在调节细胞运动、侵袭和转移中起到了重要的作用,研究表明AKT1的活性下调可能与A549细胞的转移潜能增加相关[40]。
MAPK通路被认为与许多癌症的发病机制相关,虽然MAP2K1突变在非小细胞肺癌很少见,但其被认为与一些已知的突变相互排斥,同时MAP2K1的级联反应被认为与靶向治疗的抵抗相关[41]。You等[42]在研究中发现,MiR-449a可通过抑制MAP2K1来抑制NSCLC细胞的侵袭。
JUN又称为活化蛋白-1(AP-1),是一种转录因子,在细胞增殖、分化和凋亡等方面起到了重要作用,Yu等[43]的研究發现抑制AP-1的激活将抑制BLIMP1的表达,从而减弱肺癌细胞的迁移。Mishra等[44]的研究也表明在体外4D肺癌模型中,抑制AP-1可以降低肿瘤转移病灶的形成。
GRB2是一种生长因子受体结合蛋白,在体内广泛表达,可通过对下游通路的调节而调控多种生物功能,如细胞增殖与生存等,同时也是多种致癌信号通路中的关键调控环节[45]。如在Yang等[46]的研究中发现,GRB2的过表达可以明显抑制NSCLC细胞在体外的增殖。此外,GRB2的过表达也可以上调A549细胞向间质细胞转化[47]。
HRAS也是人类RAS蛋白家族的一员。在大多数癌症当中,激活的HRAS可以通过调控细胞周期而促进细胞增殖[48-50]。Jeong等[51]的研究表明HRAS的下调可能是虫草(Cordyceps Militaris)抑制A549细胞增殖的关键调控节点。
这些关键靶标、生物学通路及相关的人参成分可能是低浓度人参水提液作用于肺癌A549细胞的潜在有效成分与作用机制。
近30年来,国内外学者对人参中具有抗癌活性的化合物如人参皂苷Rg3、Rh2等进行了大量研究[3]。研究结果表明,人参含有多种具有抗癌活性的成分,并通过不同的方式达到抗癌作用。肺癌是我国发病率与死亡较高的恶性肿瘤之一,人参也因此常作为补充与替代药物被应用于肺癌患者的治疗[52]。如王红等[8]通过MTT等方法证明人参皂苷CK在12.5~50 μg/mL的浓度范围内可以促进肺癌A549细胞的凋亡、减少细胞内源性VEGF的分泌,从而抑制肺癌A549细胞的生长增殖。
作为一味大补元气的中药,人参被认为可以扶正祛邪,即可通过提高人体的免疫系统功能等,从而起到改善癌症患者症状的作用[12,53]。而现代研究则表明人参本身也含有抗癌活性的成分,因此为更加全面地了解人参对肺癌A549细胞的影响,本研究对低浓度人参水提液对A549细胞癌性(包括增殖、迁移、侵袭等能力)的影响进行了初步探索,以期为临床应用人参治疗肺癌的剂量使用提供一定的参考。
本实验结果显示,高浓度的人参水提液可抑制A549细胞的增殖,这与大量现有研究的结果相一致。但低浓度的人参水提液则对A549细胞的增殖、迁移、侵袭等能力起到一定的促进作用。人参作为一种可能的抗癌药物,其对癌细胞而言是一种“有害物质”,因此这一现象可能与毒物兴奋效应有紧密联系。毒物兴奋效应通常指低剂量下产生兴奋作用而高剂量下产生抑制作用的双相剂量效应关系。这一效应广泛存在于不同的生物模型、不同的种属、不同结构的化学物和各种测定终点中[54],其在中医药研究中也非常常见,无论是单独用药还是联合用药[55]。因此依据毒物兴奋效应理论,导致本实验结果的可能机制如下:1)人参水提液的成分复杂,不同成分的含量也不尽相同,其中可以对A549细胞起到作用的成分可能相互之间具有拮抗作用。具有拮抗作用的成分由于水提液浓度不同、受体数量不同、受体亲和力不同等原因而分别在不同浓度水提液中起到主导作用,如人参皂苷Rg1与人参皂苷Rb1在血管生成方面即有着拮抗作用[56]。2)过度补偿机制,这一机制认为有毒物质对于生物体的抑制会破坏生物体的内环境的稳定,为了维持内环境的稳定,生物体会产生一个补偿过程,当有毒物质浓度较低时,这一补偿作用超过了有毒物质的抑制作用,从而表现出促进作用。这属于应激反应的一种,与应激相关。有研究表明人参皂苷在低浓度时,可促进人角质细胞与皮肤成纤维细胞内stress基因的表达及应激蛋白的合成[57]。
针对这一现象,我们运用网络药理学研究策略对其可能的机制进行了预测,预测结果表明,低浓度人参水提液作用于肺癌细胞的可能机制是通过作用于ErbB signaling pathway、p53 signaling pathway、Central carbon metabolism in cancer等重要的生物学通路及其相关靶标,从应激反应、生物代谢等方面对A549细胞的增殖、迁移、侵袭能力进行了调控。这一预测结果对毒物兴奋效应的2种可能机制均有所印证。
低浓度人参水提液对A549细胞癌性的影响可以帮助我们更全面地评估人参水提液在抑肺癌A549细胞方面的疗效。并为癌症患者对人参制剂的使用提供一定的参考信息。此外,关于低浓度人参水提液对A549细胞癌性影响的具体作用机制,如细胞周期、凋亡及相关通路、靶标方面的机制仍有待进一步深入探索。
参考文献
[1]Hirsch FR,Scagliotti GV,Mulshine JL,et al.Lung cancer:current therapies and new targeted treatments[J].Lancet,2017,389(10066):299-311.
[2]赵丽娜,李倩,王闻文,等.中药抑制肺癌血管生成的作用机制研究进展[J].中国实验方剂学杂志,2021,27(20):236-243.
[3]Wong AS,Che CM,Leung KW.Recent advances in ginseng as cancer therapeutics:a functional and mechanistic overview[J].Nat Prod Rep,2015,32(2):256-272.
[4]吉米麗汗·司马依,艾尼瓦尔·吾买尔,买买提明·努尔买买提,等.基于网络药理学预测新疆榅桲主要活性成分对非小细胞肺癌的治疗作用及作用靶点[J].中国新药杂志,2020,29(19):2214-2220.
[5]Yun TK,Choi SY.A case-control study of ginseng intake and cancer[J].Int J Epidemiol,1990,19(4):871-876.
[6]林廷文,杜金法,黄丽瑾,等.人参皂苷糖基转移酶基因研究概述[J].中国中药杂志,2020,45(19):4574-4581.
[7]骆云峰,刘可艺,冯嘉华,等.中药活性成分合成生物学研究进展[J].中国中药杂志,2021,46(22):5727-5735.
[8]王红,邓晶,刘珊,等.人参皂苷CK对人肺腺癌A549细胞株的增殖抑制作用及其机制[J].现代肿瘤医学,2016,24(4):534-537.
[9]Yoo JH,Kwon HC,Kim YJ,et al.KG-135,enriched with selected ginsenosides,inhibits the proliferation of human prostate cancer cells in culture and inhibits xenograft growth in athymic mice[J].Cancer Lett,2010,289(1):99-110.
[10]Li C,Tian ZN,Cai JP,et al.Panax ginseng polysaccharide induces apoptosis by targeting Twist/AKR1C2/NF- pathway in human gastric cancer[J].Carbohydr Polym,2014,102:103-109.
[11]王文娟,何枝华,陈艳琳,等.两种提取人参水煎液miRNA方法的比较[J].广东药科大学学报,2017,33(5):595-599.
[12]高静,毕蕾,江玉翠,等.人参水提液对TAMs与肿瘤细胞共培养体系肺癌A549细胞生物学行为的影响[J].中国中西医结合杂志,2017,37(3):345-350.
[13]刘畅.人参水提物对三种细胞体外增殖影响的探究[D].长春:长春理工大学,2014.
[14]Baenke F,Peck B,Miess H,et al.Hooked on fat:the role of lipid synthesis in cancer metabolism and tumour development[J].Dis Model Mech,2013,6(6):1353-1363.
[15]王庆喜.人参有效成分糖类、挥发油及无机元素的研究[D].长春:吉林大学,2016.
[16]张玉婷.人参提取物化学成分及质量研究[D].北京:中国食品药品检定研究院,2013.
[17]Zamagni A,Pasini A,Pirini F,et al.CDKN1A upregulation and cisplatin-pemetrexed resistance in non-small cell lung cancer cells[J].Int J Oncol,2020,56(6):1574-1584.
[18]Georgakilas AG,Martin OA,Bonner WM.p21:A Two-Faced Genome Guardian[J].Trends Mol Med,2017,23(4):310-319.
[19]Fukazawa T,Guo M,Ishida N,et al.SOX2 suppresses CDKN1A to sustain growth of lung squamous cell carcinoma[J].Sci Rep,2016,6:20113.
[20]Lahn M,Su C,Li S,et al.Expression levels of protein kinase C-alpha in non-small-cell lung cancer[J].Clin Lung Cancer,2004,6(3):184-189.
[21]Oliva JL,Caino MC,Senderowicz AM,et al.S-Phase-specific activation of PKC alpha induces senescence in non-small cell lung cancer cells[J].J Biol Chem,2008,283(9):5466-5476.
[22]Wang C,Wang X,Liang H,et al.miR-203 inhibits cell proliferation and migration of lung cancer cells by targeting PKCα[J].PLoS One,2013,8(9):e73985.
[23]Cheng X,Gu J,Zhang M,et al.Astragaloside Ⅳ inhibits migration and invasion in human lung cancer A549 cells via regulating PKC-α-ERK1/2-NF-κB pathway[J].Int Immunopharmacol,2014,23(1):304-313.
[24]da Cunha Santos G,Shepherd FA,Tsao MS.EGFR mutations and lung cancer[J].Annu Rev Pathol,2011,6:49-69.
[25]Hsu PC,Jablons DM,Yang CT,et al.Epidermal Growth Factor Receptor(EGFR) Pathway,Yes-Associated Protein(YAP) and the Regulation of Programmed Death-Ligand 1(PD-L1) in Non-Small Cell Lung Cancer(NSCLC)[J].Int J Mol Sci,2019,20(15):3821.
[26]Liu X,Wang P,Zhang C,et al.Epidermal growth factor receptor(EGFR):A rising star in the era of precision medicine of lung cancer[J].Oncotarget,2017,8(30):50209-50220.
[27]Meng F,Zhang L.miR-183-5p functions as a tumor suppressor in lung cancer through PIK3CA inhibition[J].Exp Cell Res,2019,374(2):315-322.
[28]Wang Z,Liu Z,Fang X,et al.MiR-142-5p Suppresses Tumorigenesis by Targeting PIK3CA in Non-Small Cell Lung Cancer[J].Cell Physiol Biochem,2017,43(6):2505-2515.
[29]Zhang L,Gao L,Shao M,et al.A MYC target long non-coding RNA GATA2-AS regulates non-small cell lung cancer growth[J].Neoplasma,2019,66(6):954-962.
[30]Stine ZE,Walton ZE,Altman BJ,et al.MYC,Metabolism,and Cancer[J].Cancer Discov,2015,5(10):1024-1039.
[31]Lorenz J,Friedberg T,Paulus R,et al.Oncogene overexpression in non-small-cell lung cancer tissue:prevalence and clinicopathological significance[J].Clin Investig,1994,72(2):156-163.
[32]Chalishazar MD,Wait SJ,Huang F,et al.MYC-Driven Small-Cell Lung Cancer is Metabolically Distinct and Vulnerable to Arginine Depletion[J].Clin Cancer Res,2019,25(16):5107-5121.
[33]Liu S,Li S,Hai J,et al.Targeting HER2 Aberrations in Non-Small Cell Lung Cancer with Osimertinib[J].Clin Cancer Res,2018,24(11):2594-2604.
[34]Stephens P,Hunter C,Bignell G,et al.Lung cancer:intragenic ERBB2 kinase mutations in tumours[J].Nature,2004,431(7008):525-526.
[35]Chuang JC,Stehr H,Liang Y,et al.ERBB2-Mutated Metastatic Non-Small Cell Lung Cancer:Response and Resistance to Targeted Therapies[J].J Thorac Oncol,2017,12(5):833-842.
[36]Testoni E,Stephenson NL,Torres-Ayuso P,et al.Somatically mutated ABL is an actionable and essential NSCLC survival gene[J].EMBO Mol Med,2016,8(2):105-116.
[37]Gu JJ,Rouse C,Xu X,et al.Inactivation of ABL kinases suppresses non-small cell lung cancer metastasis[J].JCI Insight,2016,1(21):e89647.
[38]Yoshizawa A,Sumiyoshi S,Sonobe M,et al.Validation of the IASLC/ATS/ERS lung adenocarcinoma classification for prognosis and association with EGFR and KRAS gene mutations:analysis of 440 Japanese patients[J].J Thorac Oncol,2013,8(1):52-61.
[39]Román M,Baraibar I,López I,et al.KRAS oncogene in non-small cell lung cancer:clinical perspectives on the treatment of an old target[J].Mol Cancer,2018,17(1):33.
[40]Rao G,Pierobon M,Kim IK,et al.Inhibition of AKT signaling promotes invasion and metastasis of non-small cell lung cancer cells with K-RAS or EGFR mutations[J].Sci Rep,2017,7(1):7066.
[41]Scheffler M,Holzem A,Kron A,et al.Co-occurrence of targetable mutations in Non-small cell lung cancer(NSCLC) patients harboring MAP2K mutations[J].Lung C,2020,144:40-48.
[42]You J,Zhang Y,Li Y,et al.MiR-449a suppresses cell invasion by inhibiting MAP2K in non-small cell lung cancer[J].Am J Cancer Res,2015,5(9):2730-2744.
[43]Yu Z,Sato S,Trackman PC,et al.Blimp activation by AP- in human lung cancer cells promotes a migratory phenotype and is inhibited by the lysyl oxidase propeptide[J].PLoS One,2012,7(3):e33287.
[44]Mishra DK,Kim MP.SR 11302,an AP- Inhibitor,Reduces Metastatic Lesion Formation in Ex Vivo 4D Lung Cancer Model[J].Cancer Microenviron,2017,10(1-3):95-103.
[45]Giubellino A,Burke TR,Bottaro DP.Grb2 signaling in cell motility and cancer[J].Expert Opin Ther Targets,2008,12(8):1021-1033.
[46]Yang L,Wen Y,Lv G,et al.α-Lipoic acid inhibits human lung cancer cell proliferation through Grb2-mediated EGFR downregulation[J].Biochem Biophys Res Commun,2017,494(1-2):325-331.
[47]Mitra P,Kalailingam P,Tan HB,et al.Overexpression of GRB2 Enhances Epithelial to Mesenchymal Transition of A549 Cells by Upregulating SNAIL Expression[J].Cells,2018,7(8):97.
[48]Wen X,Lin ZQ,Liu B,et al.Caspase-mediated programmed cell death pathways as potential therapeutic targets in cancer[J].Cell Proliferation,2012,45(3):217-224.
[49]Meng F,Cao B,Feng Z,et al.Knockdown of mutated H-Ras V12 expression induces chemosensitivity of hepatocellular carcinoma cells to cisplatin treatment in vitro and in nude mouse xenografts[J].Oncol Rep,2014,32(5):2023-2030.
[50]Liu R,Li B,Qiu M.Elevated superoxide production by active H-ras enhances human lung WI-38VA-13 cell proliferation,migration and resistance to TNF-alpha[J].Oncogene,2001,20(12):1486-1496.
[51]Jeong MK,Yoo HS,Kang IC.The Extract of Inhibited the Proliferation of Cisplatin-Resistant A549 Lung Cancer Cells by Downregulation of H-Ras[J].J Med Food,2019,22(8):823-832.
[52]郭玉明,姜淼,郑光,等.基于文本挖掘技术分析治疗肺癌的中医用药规律[J].中国实验方剂学杂志,2011,17(16):277-280.
[53]李红娟,祁红霞,张艳林.中西医结合治疗晚期癌症疼痛患者的临床观察及护理[J].实用临床医药杂志,2014,18(12):116-118.
[54]刘天天,靳洪涛,王爱平.毒物兴奋效应及其对毒理学和医药研究的影响[J].毒理学杂志,2016,30(1):78-83.
[55]Wang D,Calabrese EJ,Lian B,et al.Hormesis as a mechanistic approach to understanding herbal treatments in traditional Chinese medicine[J].Pharmacol Ther,2018,184:42-50.
[56]Sengupta S,Toh SA,Sellers LA,et al.Modulating angiogenesis:the yin and the yang in ginseng[J].Circulation,2004,110(10):1219-1225.
[57]Rattan SI,Kryzch V,Schnebert S,et al.Hormesis-based anti-aging products:a case study of a novel cosmetic[J].Dose Response,2013,11(1):99-108.
(2021-02-20收稿 本文編辑:吴珊)
