N-乙酰-L-半胱氨酸通过AMPK/mTOR 途径激活保护性自噬降低青蒿琥酯诱导的胰腺癌细胞死亡
2022-05-21任自敬徐红霞李星阅马佳佳周佩洋
任自敬,徐红霞,李星阅,王 越,马佳佳,周佩洋
(1. 湖北医药学院附属襄阳市第一人民医院;湖北襄阳 441000;2. 湖北医药学院,湖北十堰 442000)
胰腺癌(pancreatic carcinoma, PC)是一种高度恶性肿瘤,早期诊断困难,发展迅速,对多种放化疗药物不敏感,预后极差,5 年生存率不足10%[1]。目前PC是世界范围内癌症死亡的第三大主要原因,如果没有取得任何治疗进展,PC 预计到2030 年将位于第二位[1-3],因此迫切需要新的有效治疗策略。
青蒿琥酯(artesunate, ART)是从黄花蒿中提取的有效抗疟疾成分青蒿素的衍生物,广泛用于治疗严重疟疾,在推荐剂量下无明显不良反应。研究报道,除抗疟性外,青蒿素类物质还具有广谱抗肿瘤效应的潜能[4-7]。已有研究显示,ART 可在体内、外显著抑制PC 的增殖,是一种有希望的PC 治疗药物[8-9]。ART结构中包含一个内过氧化桥键,断裂后可促进胞内活性氧(reactive oxygen species, ROS)的产生。ROS介导的细胞凋亡被认为是ART 发挥效应的机制之一,但是,目前明确ART 抑制PC 的方式是非凋亡依赖性的[8,10],其他效应机制尚不明确。
自噬是在各种压力环境下对受损细胞器和细胞成分的分解代谢过程。自噬的激活水平对细胞的存活或死亡至关重要,不足或过量的自噬水平会破坏细胞内环境平衡,促进细胞死亡。CORDANI 等[11]报道,ROS 可以作为细胞信号分子启动自噬小体的形成和降解,反过来,自噬通过清除蛋白质聚集物和受损的细胞器降低氧化损伤和ROS 水平。如上所述,ROS可以参与自噬过程,同时也受到自噬的调控。前期研究发现,ART 诱导的PC 细胞死亡在NAC 的存在下受到抑制,但在PC 细胞中ART 诱导的ROS 与细胞自噬之间的关系尚不明确,需要做进一步检测。
1 材料与方法
1.1 材料
1.1.1 细胞 胰腺癌细胞CFPAC-1、Capan-2 及BxPC3 购自武汉普诺赛生命科技有限公司,用10%胎牛血清(FBS)+1%青/链霉素(P/S),在饱和湿度的50 mL/L CO2培养箱培养。
1.1.2 试剂 ART 购自上海阿拉丁生化科技股份有限公司,NAC(N-Acetyl-L-cysteine)、3-Methyladenine(3-MA)购自Selleck 公司,胎牛血清和高糖DMEM 购自GIBCO 公司,CCK8 购自Biosharp,ROS检测试剂盒购自北京普利莱基因技术有限公司,Hoechst 33342 购自上海碧云天生物技术有限公司,抗体E-cadherin、N-cadherin及Vimentin、LC3、GAPDH购自Proteintech Group 公司,腺苷酸活化蛋白激酶α(adenosine monophosphate activated protein kinase α,AMPKα)、p-AMPKα、哺 乳 动 物 雷 帕 霉 素 靶 蛋 白(mammalian target rapamycin,mTOR)、p-mTOR、p62购自美国Cell Signaling Technology 公司。
1.1.3 仪器设备 CO2细胞培养箱、超净工作台购自Thermo 公司,倒置显微镜购自Olympus 公司。
1.2 实验方法
1.2.1 CCK8 检测细胞活力 收集对数期生长的CFPAC-1、Capan-2 及BxPC3 细 胞,以3 000 个/100 μL/孔接种到96 孔细胞培养板,用不同浓度的ART 单独或联合NAC、3-MA 干预48 h,每孔加入10 μL CCK8 溶 液,2 h 后 酶 标 仪 检 测450 nm 波 长 处每孔的吸光度值(A 值)。
1.2.2 Transwell检测细胞迁移能力 收集血清饥饿12 h的CFPAC-1、Capan-2细胞,以50 000个/100 μL/孔接种到Transwell(8 μm,Corning)上室,下室是600 μL含20% FBS 的培养基,24 h 后取出上室进行固定及结晶紫染色,用棉签去除未迁移细胞后,荧光显微镜下观察拍照。
1.2.3 DCFH-DA 探针检测胞内 ROS 水平 经干预后的各组细胞依据ROS 检测试剂盒说明进行检测。首先更换各组培养液为无血清DMEM,之后加入胞内ROS 检测探针DCFH-DA (dichlorofluorescin diacetate)和Hoechst 33342 共 同 孵 育15 min,最 后PBS 清洗3 次后,荧光显微镜检测拍照。
1.2.4 细胞免疫荧光检测胞内LC3 表达 经干预后的各组细胞用40 g/L 多聚甲醛固定0.5 h,用免疫染色封闭液(碧云天)封闭2 h,然后将细胞和抗-LC3抗体(1∶500)4 ℃孵育过夜,PBS 清洗3 次,后给予荧光二抗Dylight549(1∶1 000)室温避光孵育2 h,PBS 清洗3 次,用DAPI 标记细胞核,在荧光显微镜下进行检测拍照。
1.2.5 Western blotting 检测细胞中相关蛋白的表达 经干预后的各组细胞用RIPA 蛋白裂解液进行冰上裂解,后经超声破碎及12 000 r/min 离心15 min 获得细胞总蛋白,用蛋白浓度检测试剂盒进行浓度检测,各组均按30 μg 蛋白总量进行Western blotting上样电泳→封闭→一抗(1∶1 000)4 ℃孵育→二抗(1∶2 000)室温孵育→ECL 显影拍照,ImageJ 进行结果定量。
1.3 统计学分析
每个实验重复进行3 次,结果以均值±标准差表示。使用GraphPad Prism 7 作图及统计分析。多组间采用单因素方差分析,所有数据呈正态分布,通过t检验分析组间差异。以P<0.05 为差异有统计学意义。
2 结 果
2.1 ART 抑 制PC 细 胞 的 生 长
为了评估ART 对PC 细胞的生长抑制作用,用6.25~400 μmol/L ART处理3种PC细胞株CFPAC-1、Capan-2及BxPC3。CCK8法检测,结果显示与对照细胞相比,ART以剂量和时间依赖性方式抑制CFPAC-1、Capan-2 细胞生长(图1A)。ART 处理CFPAC-1、Capan-2 及BxPC3 细胞72 h 半数最大抑制浓度(IC50)值分别为199 μmol/L、277 μmol/L、478 μmol/L(图1B)。与BxPC3 细 胞 相 比,CFPAC-1、Capan-2 对ART 的敏感度更高。选择200 μmol/L ART 干预PC 细胞48 h 进行后续实验。
2.2 ART 抑 制PC 细 胞 迁 移
Transwell 法检测,结果显示到ART 可以抑制CFPAC-1、Capan-2的迁移(图2A)。Western blotting检结果显示到ART 可以明显上调E-cadherin 的表达,下调N-cadherin及Vimentin的表达(图2B、图2C)。
2.3 ART 依 赖ROS 抗PC
DCFH-DA 探针测定胞内ROS 水平,通过荧光显微镜观察到ART 处理明显增加了CFPAC-1、Capan-2 细胞内ROS 的含量,并且NAC 可以逆转胞内ROS 的含量,但ART 处理BxPC3 细胞未能引起胞内ROS 明显变化(图3A、图3B、图3C)。为进一步分析ART 诱导的ROS 在其抗肿瘤过程中的作用,用NAC 联合200 μmol/L ART 处理CFPAC-1、Capan-2及BxPC3 细 胞,结 果 发 现,NAC 明 显 削 弱 了ART 对CFPAC-1、Capan-2 细胞活力的抑制(图3D)。因此,认 为ART 抑 制CFPAC-1、Capan-2 细 胞 呈ROS 依赖性。
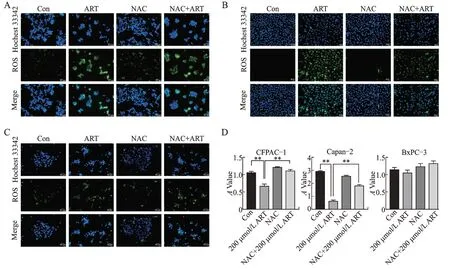
图3 ART 通过ROS 依赖性抑制胰腺癌细胞生长Fig.3 ART inhibited the growth of pancreatic cancer cells in a ROS-dependent manner
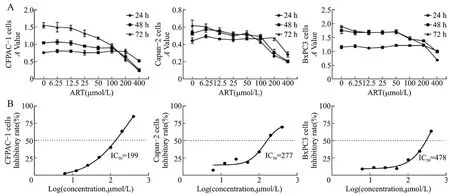
A:CFPAC-1、Capan-2 及BxPC3 细胞用0、6.25、12.5、25、50、100、200、400 μmol/L ART 分别处理24、48、72 h,用CCK-8 法测定细胞活力,以3 次独立实验的均值±标准差表示。B:ART 干预72 h 后各细胞系的IC50值。
2.4 NAC 增加ART 诱导的PC 胞内自噬水平
过量的ROS会损伤细胞,增加胞内的自噬水平。通过细胞免疫荧光检测到ART 可以促进CFPAC-1、Capan-2胞内自噬小体的形成,但意外的是在NAC联合ART的干预组中观察到更多的自噬小体(图4A、图4B)。为进一步分析ART诱导的自噬在其抗肿瘤过程中的作用,本研究使用自噬抑制剂3-MA 预处理,发现抑制自噬并不影响ART 对CFPAC-1 及Capan-2 细胞活力的抑制(图4C),结果提示,ART 单独处理诱导的自噬并非其抑制CFPAC-1及Capan-2细胞生长的机制。
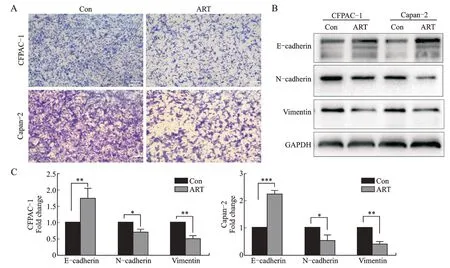
A:Transwell 检测200 μmol/L ART 处理抑制CFPAC-1、Capan-2 细胞的迁移;B:Western blotting 检 测CFPAC-1、Capan-2 细 胞 中E-cadherin、N-cadherin 及Vimentin 的表达;C:CFPAC-1 和Capan-2 细胞中E-cadherin、N-cadherin 和Vimentin 蛋 白表达的比较。*P<0.05,**P<0.01。
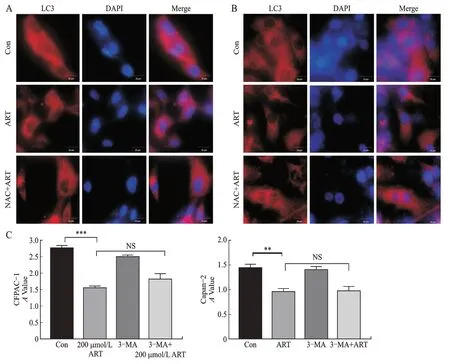
A、B:细胞免疫荧光检测CFPAC-1、Capan-2 细胞中LC3 的表达;C:给予3-MA 预处理2 h,之后ART 干预CFPAC-1、Capan-2 细胞48 h,通过CCK8 检测细胞活力变化,以3 次独立实验的均值±标准差表示。两组比较,**P<0.01,***P<0.001。
2.5 NAC 通过激活AMPK/mTOR 信号通路增强胞内自噬水平
ART 可能诱导PC 细胞发生自噬,经Western blotting 检测,结果显示,ART可以明显升高CFPAC-1、Capan-2 细 胞p62、LC3II/I,下 调p-mTOR/mTOR的表达,证实PC 细胞中自噬效应的激活,但对p-AMPKα/AMPKα 的表达无明显影响。而NAC 可以 通 过 升 高p-AMPK α/AMPK α,进 一 步 下 调p-mTOR/mTOR 的表达,升高p62、LC3II/I,增强细胞的自噬水平(图5)。
3 讨 论
胰腺癌对多种放化疗药物不敏感,迫切需要新的有效治疗方案。ART 对多种肿瘤具有显著抑制作用,且不良反应小。已有研究证明,ART 抑制胰腺癌[8],并呈现非caspase 依赖的凋亡途径,其抗癌机制需要进一步探究,以便了解ART 细胞毒性效应的性质和特征。与之前研究结果一致,本研究发现,ART可抑制PC 细胞增殖,但不同的PC 细胞敏感性差异较大。相对而言,ART 对CFPAC-1、Capan-2 抑制效应明显高于BxPC3 细胞。
上皮间质转化是肿瘤发生侵袭和转移的关键事件,其特征是上皮标志蛋白E-cadherin 下调,而间质标志蛋白N-cadherin 及Vimentin 上调。我们通过Transwell 及Western blotting 检测上皮间质转化相关蛋白的变化发现,ART 通过抑制CFPAC-1、Capan-2细胞的迁移,上调E-cadherin 的表达,下调N-cadherin及Vimentin 的表达发挥抑制迁移的效应。
裂解内过氧化桥键产生ROS 是ART 发挥抗癌或抗疟功能的关键[12-13]。氧化应激是ROS 产生与细胞抗氧化剂防御之间不平衡的结果。当ROS 过量产生,细胞抗氧化缓冲能力降低时,会导致细胞损伤。本研究使用ROS 荧光探针染料DCFDA 检测到ART处理后CFPAC-1、Capan-2 胞内ROS 的含量明显增高,而BxPC3 胞内ROS 的变化不明显,这可能是BxPC3 细胞对ART 不敏感的原因。NAC 可以逆转CFPAC-1、Capan-2胞内ROS的含量,且削弱了ART对CFPAC-1、Capan-2 细胞活力的抑制效果。基于上述结果,确认ART 依赖ROS 发挥抗胰腺癌的效应。
ROS 是诱导自噬的主要激活信号之一,而自噬是维持细胞稳态和氧化还原稳态的主要降解途径[14]。ROS 与自噬之间相互作用的后果可能表现在两个方面:细胞损伤或细胞存活。有研究报道,ART 通过下调HeLa 细胞的线粒体膜电位,改变细胞氧化还原状态,激活了依赖pink 的保护性自噬[15]。也有研究报道,ART 通过上调ROS,通过激活AMPK-mTORULK1 轴,诱导人膀胱癌细胞自噬依赖性凋亡[16]。然而,ART 处理PC 细胞后细胞氧化还原稳态和自噬之间的作用结果尚未清楚阐明。我们通过LC3 细胞免疫荧光及自噬相关蛋白的检测,证实ART 可以激活细胞自噬,而且自噬抑制剂3-MA 并不能削弱ART对PC 细胞的抑制效应,推测ART 诱导的自噬是细胞维持稳态的一种适应性反应。有趣的是,ART 联合NAC 处理可以促进PC 细胞形成更多的自噬小体。通过Western blotting 检测发现,NAC 联合ART处理可以激活AMPK,下调mTOR 的磷酸化,上调p62、LC3II/I、Beclin1,加剧细胞自噬水平,恢复细胞活力。AMPK 是细胞内的能量感受器,在能量缺乏时被激活,通过促进受损细胞的回收再利用维持能量稳态和细胞内环境平衡。鉴于ART 的作用靶标及ROS 主要来源都是线粒体[15],我们推测,ART 诱导ROS 可能导致PC 细胞线粒体受损,能量供给不足,进而激活AMPK,激活胞内的保护性自噬。因此,线粒体结构、功能及胞内抗氧化分子的变化后期需要做进一步验证。
综上所述,本研究检测到ART 依赖ROS 而非自噬发挥抑制胰腺癌细胞增殖的效果,是一种有希望的胰腺癌治疗药物。NAC 通过激活AMPK/mTOR 信号通路提高胞内保护性自噬,削弱ART 抗胰腺癌作用。
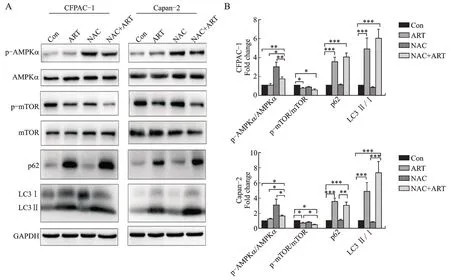
A:Western blotting 检测ART 联合NAC 处理48 h 后CFPAC-1、Capan-2 细胞中p-AMPK/AMPK、p-mTOR/mTOR、p62 及LC3 的表达;B:CFPAC-1和Capan-2细胞中p-AMPK/AMPK、p-mTOR/mTOR、p62和LC3II/I蛋白表达的定量结果。两组比较,*P<0.05,**P<0.01,***P<0.001。
