杂萘联苯聚芳醚酮的表面化学改性及成骨活性
2022-05-20柳承德张杨阳程习彤蹇锡高
柳承德,张杨阳,程习彤,蹇锡高
(1.大连理工大学化工学院高分子材料系,辽宁大连 116024; 2.大连理工大学辽宁省高性能树脂工程技术研究中心,辽宁大连 116024)
骨植入材料作为生物医用材料的一个重要分支,在骨修复、填充骨缺损和其他骨科手术中发挥着重要作用。聚醚醚酮(PEEK)是一种高性能工程塑料,由于其具有与人骨匹配的力学性能和化学稳定性等优点,已经广泛应用在骨植入材料领域[1–4]。然而PEEK作为一种结晶性聚合物,溶解性很差,因此在成型加工方面受到一定的限制。本课题组开发的杂萘联苯聚芳醚酮(PPEK)是一种新型聚芳醚酮热塑性树脂,通过引入扭曲非共平面的分子结构,赋予了聚合物良好的溶解性和更高的耐热性能。与PEEK相比,PPEK不仅加工性能更加优异,并且其成本仅为PEEK的一半,因此其在生物材料领域的应用具有相当的潜力。然而PPEK的表面为生物惰性,如何得到具有更好生物活性的PPEK仍是需要攻克的问题[5]。
植入体与体内环境接触后,细胞并不会与植入体材料表面发生直接相互作用。存在于生物体血液或其它体液中的蛋白质将率先到达植入体材料表面并与之发生相互作用。植入物材料的表面理化性质与其表面的蛋白吸附行为直接相关,而吸附在材料表面的蛋白又会进一步引发各种各样的细胞行为和生物化学反应[6]。通过改变材料表面的性质,改善材料表面对蛋白质的相互作用,从而解决PPEK的表面惰性问题具有重大的研究意义。有研究表明,羟基(—OH)[7]、磺酸基(—SO3H)[8–9]等化学基团的引入能增加材料表面蛋白质的吸附,并且能促进成骨细胞的分化,改善骨再生性能[10]。笔者采用强还原剂将PPEK分子链中的羰基还原成为羟基,使用硫酸(H2SO4)和氯磺酸(HClO3S)在PPEK分子链上引入磺酸基团,并通过溶液涂覆的方法将含有羟基、磺酸基的PPEK涂覆于可溶性的PPEK表面,形成牢固结合的表面层,期望改善PPEK材料的表面惰性以及材料与蛋白质的相互作用,进而改善其表面的成骨活性。
1 实验部分
1.1 主要原料
PPEK:0539,大连宝力摩新材料有限公司;
二甲基亚砜(DMSO) (99%)、硼氢化钠(NaBH4)(98%)及HClO3S (99%):阿拉丁试剂(上海)有限公司;
α-最低必需培养基(α-MEM)、胎牛血清(FBS)、链霉素-青霉素:美国Hyclone公司;
人体纤连蛋白(Fn)、磷酸盐缓冲溶液(PBS)、96孔细胞培养板(无菌)、6孔细胞培养板(无菌):索莱宝生物科技有限公司;
TRIZOL试剂、DAPI染色液、TRITC染色液:北京酷莱博科技有限公司;
细胞计数试剂盒(CCK-8)、全蛋白提取试剂盒、反转录试剂盒、荧光定量聚合酶链式反应(PCR)试剂盒、聚乙二醇辛基苯基醚(Triton X-100)、改良的聚氰基丙烯酸正丁酯(BCA)蛋白检测试剂盒、碱性磷酸酶(ALP)蛋白检测试剂盒:生工生物工程(上海)股份有限公司。
1.2 主要设备及仪器
傅里叶变换红外光谱(FTIR)仪:IS50型,美国Thermo Nicolet公司;
X射线光电子能谱(XPS)仪:ESCALAB 250Xi型,英国Thermo Fisher Scientific公司;
接触角测量仪:DSA30S型,德国KRUSS公司;
耗散型石英晶体微天平(QCM-D)分析仪:Q-SENSE ANALYZER型,瑞典Biolin Scientific AB公司;
单光子激光共聚焦显微镜:FV1000型,日本Olympus公司;
酶标仪:Epoch2T型,美国Bio Tek 公司;
荧光定量PCR仪:LightCycler480II-96well型,瑞士Roche公司。
1.3 PPEK表面改性
将PPEK粉料通过高温模压得到厚度为1 mm的PPEK薄板,并裁剪成1 cm×1 cm小片,打磨抛光后用丙酮、乙醇、去离子水依次超声清洗10 min,在真空烘箱中烘干备用。
表面羟基化PPEK样品(PPEK-OH)的制备:根据文献[11]报道的方法将PPEK主链的羰基还原为羟基。在带有回流冷凝装置的三口烧瓶中加入200 mL DMSO和0.45 g NaBH4,加热至120℃,待NaBH4完全溶解,将5 g PPEK粉料浸入反应溶液中。在氮气保护条件下120℃反应24 h,把反应溶液沉降在冰水混合物中,析出絮状的产物。用去离子水洗涤数次后在80℃鼓风烘箱中烘干备用。用上述烘干的产物配置成10 mg/mL的氯仿溶液,旋涂在1 cm×1 cm PPEK片的表面(1 000 r/min),每个样品重复旋涂5次,最后置于60℃鼓风烘箱中放置6 h烘干溶剂,标记为PPEK-OH。
表面磺化PPEK样品(PPEK-SO3H)的制备:根据文献[12]报道的方法对PPEK材料进行磺化改性。在带有冷凝回流装置的三口烧瓶中加入5.0 g的PPEK和70 mL的H2SO4,剧烈搅拌至聚合物完全溶解。用恒压滴液漏斗缓慢滴加10 mL的HClO3S,在90℃条件下反应8 h后,将反应溶液沉降在冰水混合物中,析出絮状的产物。用去离子水洗涤数次后在80℃鼓风烘箱中烘干备用。用上述烘干的产物配置成10 mg/mL的氯仿溶液,旋涂在1 cm×1 cm PPEK片的表面(1 000 r/min),每个样品重复旋涂5次,最后置于60℃鼓风烘箱中放置6 h烘干溶剂,标记为PPEK-SO3H。
PPEK两种化学改性(羟基化和磺化)流程如图1所示。
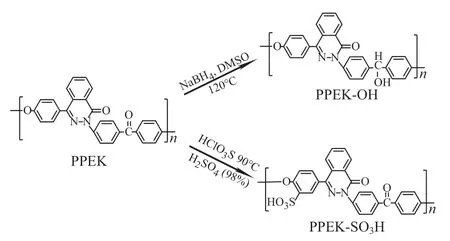
图1 PPEK的化学改性流程
1.4 细胞相容性和成骨分化活性测定
细胞培养:用α-MEM培养基在细胞培养箱(37℃,5% CO2)中培养MC3T3-E1成骨细胞,培养基中含10%的FBS和1%的链霉素-青霉素。细胞每三天传代一次,每天更新一次细胞培养基。
细胞毒性测定:采用培养细胞所用的培养基在37℃条件下对样品分别浸提24 h。将细胞悬液以每孔5×103个细胞的密度接种于96孔细胞培养板,培养4 h。然后,用不同浓度的浸提液更换培养基。孵育1,3 d后,每孔加10 μL 3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑(MTT)的PBS溶液(5 mg/mL)。在37°C孵育4 h后,移出溶液,加入100 μL DMSO溶解甲醛晶体。用酶标仪在570 nm波长下测吸光度,细胞活力与所测吸光度的值呈正比。
细胞增殖:将细胞悬液以每孔5×103个细胞的密度接种于96孔细胞培养板,并与样品一起培养。在预定的时间点,移出样品,向培养基中加入10 μL CCK-8溶液。用酶标仪在450 nm波长下测定吸光度。
细胞贴附:将1×104个细胞接种在样品表面,置于6孔细胞培养板中共培养24 h。经过4%多聚甲醛溶液固定20 min后,室温下TRITC染色30 min,DAPI染色2 min,用单光子激光共聚焦显微镜观察样品表面的细胞形态。
ALP活性测定:将1×104个细胞与样品共培养于6孔细胞培养板中,测定ALP活性以评估成骨分化的情况。在培养7,14 d后,取出样品,用1%的Triton X-100在4℃下裂解细胞。以14 000 r/min的速度离心之后,用改良的BCA蛋白检测试剂盒计算上清液总蛋白含量。ALP活性的测定是通过量化对硝基苯酚来确定的,对硝基苯酚是磷酸对硝基苯的最终产物,用ALP蛋白检测试剂盒对其进行定量。最后,对ALP活性与总蛋白的相应含量进行归一化。
实时荧光检测PCR (RT-PCR)检测成骨基因相关表达:MC3T3-E1细胞的成骨基因表达是通过RT-PCR测定的。将1×104个细胞接种在6孔细胞培养板中与样品共培养3,7,14 d,提取细胞的信使核糖核酸(mRNA)。此后,在金属浴中将其逆转录为互补脱氧核糖核酸(cDNA)。所选基因的正向和反向引物见表1。通过RT-PCR进行定量分析成骨相关基因[包括ALP,转录因子(Runx2)和I型胶原蛋白(COL-I)]的表达结果。每个基因的相对mRNA表达水平通过循环阈值与管家基因3-磷酸甘油酯脱氢酶(GAPDH)进行归一化确定。

表1 成骨相关基因引物序列[13]
1.5 性能测试与表征
FTIR测试:采用全反射的方法对样品表面进行测试,波数范围是400~4 000 cm-1。
XPS测试:激发源为Cu Kα,起飞角为20°,结合能用烷基碳C(1s)峰(284.8 eV)进行校正。
水接触角测试:以去离子水为检测液体,每次注射5 μL在样品表面,用接触角测量仪测试材料表面的接触角。
QCM-D测试:将样品用氯仿配置成10 mg/mL的溶液,旋涂在QCM-D金芯片表面(转速1 000 r/min),每个芯片重复旋涂五次,然后在80℃真空烘箱中烘干溶剂。QCM-D测试前先通入PBS溶液冲洗至少10 min,再通入20 μg/mL的Fn溶液,待吸附稳定后分别用PBS溶液和1%的十二烷基硫酸钠(SDS)溶液冲洗,进液流速为100 μL/min。
1.6 统计学分析
数据表示为平均值±标准偏差,使用Student′s t-test检测两个样品组之间有无显著性差异,P<0.05视为和PPEK相比有统计学差异,在后续柱状图中用*表示。
2 结果与讨论
2.1 PPEK化学改性分析
图2为PPEK,PPEK-OH和PPEK-SO3H的FTIR谱图。由图2可以看出,PPEK的红外吸收峰与本课题组[14]之前的研究结果一致,PPEK-OH在3 400 cm–1处出现羟基的特征吸收峰,而PPEKSO3H在1 500 cm–1和1 474 cm–1处出现了芳香取代吸收峰,结合1 020 cm–1和1 075 cm–1处磺酸基的对称和不对称伸缩振动峰,说明磺酸基已经成功引入到PPEK主链上[14]。

图2 PPEK,PPEK-OH和PPEK-SO3H的FTIR谱图
图3是PPEK,PPEK-OH和PPEK-SO3H的XPS全谱图。由图3可以看到,对比PPEK和PPEK-OH样品,PPEK-SO3H的表面除了C,N,O元素之外还检测到了S元素的信号。表2为根据XPS数据计算出的PPEK,PPEK-OH和PPEKSO3H表面各元素相对含量。表2显示,PPEKSO3H表面S元素的相对含量为1.2%。
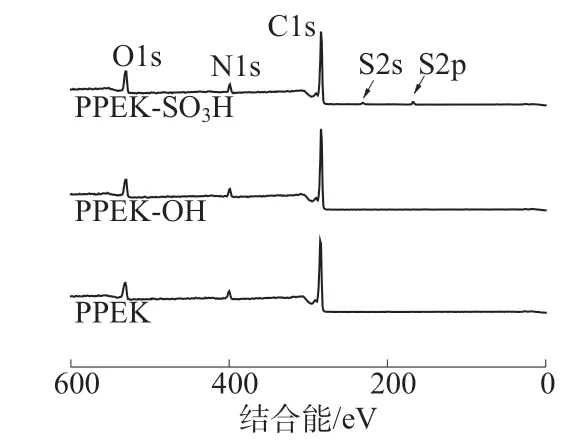
图3 PPEK,PPEK-OH和PPEK-SO3H的XPS谱图

表2 不同样品表面各元素相对含量 %
图4是PPEK,PPEK-OH和PPEK-SO3H的XPS高分辨O1s谱图。表3为不同试样表面O1s谱图中各成键相对含量。由图4可以看出PPEK的高分辨O1s谱图主要归为529.8 eV和531.8 eV处的C=O和C—O,伴随着PPEK表面的还原反应,一部分C=O转化为C—O,在高分辨O1s谱图这两处的强度也有相应的变化,并且在530.9 eV出现了归属于O—H的峰,同时表3显示O—H在PPEK-OH的O1s谱图中的成键相对含量达到9.2%。在PPEK-SO3H的高分辨O1s谱图中除了C=O和C—O之外,在530.7 eV处出现了归属于S=O和S—O的信号峰,同时表3显示S=O和S—O在PPEK-SO3H的O1s谱图中的成键相对含量达到26.2%。
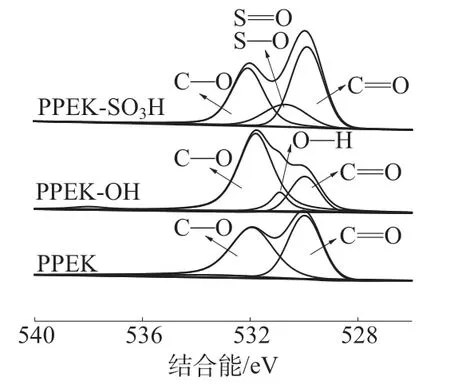
图4 PPEK,PPEK-OH和PPEK-SO3H的XPS高分辨O1s谱图
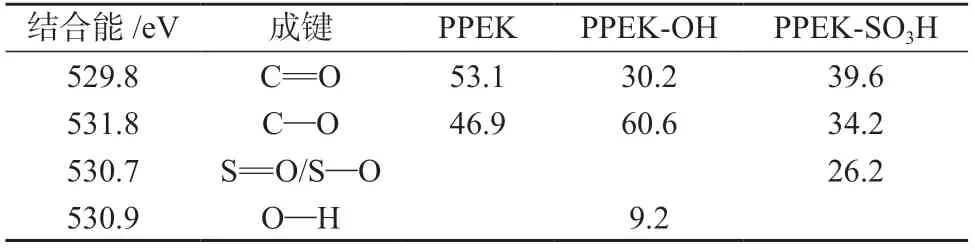
表3 不同样品表面O1s谱图中各成键相对含量%
为了对官能化改性的PPEK的表面性能进一步研究,对三种样品的表面水接触角进行了测试,结果如图5所示。从图5可以看出,对比未改性的PPEK,PPEK-OH的表面水接触角从86°下降到79°,PPEK-SO3H的表面水接触角下降到了61°。FTIR和XPS均证明了PPEK-OH和PPEK-SO3H的成功制备,并且接触角数据表面改性后材料的亲水性变好。
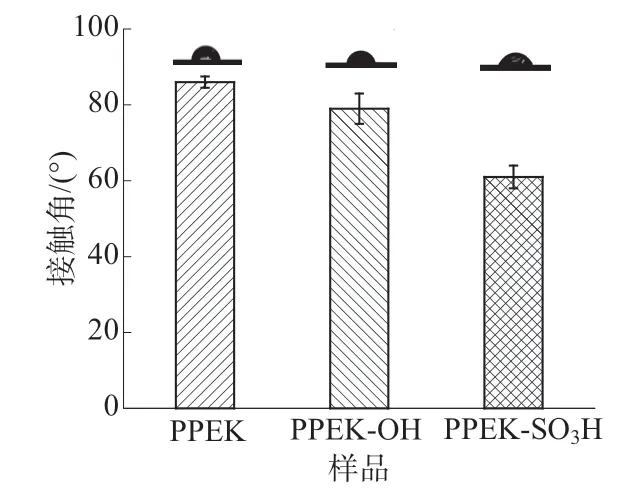
图5 PPEK,PPEK-OH和PPEK-SO3H的表面水接触角
2.2 表面蛋白吸附能力评价
植入体材料表面吸附的蛋白是组织细胞与植入体材料之间联系的纽带。通过QCM-D测定了不同样品表面的Fn吸附密度。根据式(1)[9]计算得到的三种样品表面最大Fn吸附密度如图6所示。图6显示,PPEK样品表面的Fn吸附密度为302 ng/cm2,PPEK-OH和PPEK-SO3H样品表面的Fn吸附密度分别达到364,404 ng/cm2,相较PPEK样品提高了20.5%和33.8%。
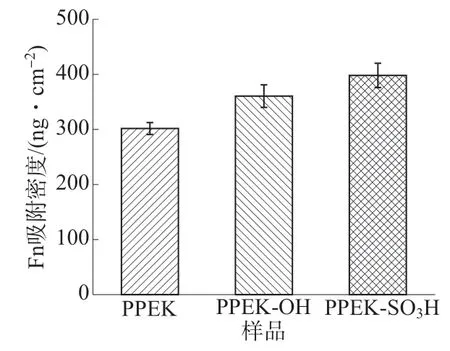
图6 PPEK,PPEK-OH和PPEK-SO3H样品表面Fn吸附密度
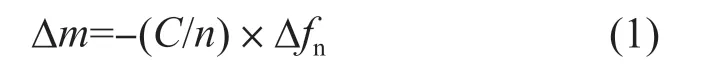
式中:∆m——Fn吸附密度,ng/cm2;
C——晶体的质量灵敏度常数,取C=17.7 ng/cm2;
n——频率倍数,取n=3;
Δfn——QCM-D芯片的频率变化。
QCM-D芯片振动频率下降的绝对值与吸附在芯片表面的蛋白质质量呈正比。图7分别是三种样品的QCM-D芯片的振动频率曲线(图7中纵坐标的标值负号表示频率下降)。由图7可以看到,在蛋白吸附稳定后通入PBS溶液,芯片振动频率曲线均没有明显的变化,说明其表面吸附的蛋白没有脱落。在通入SDS溶液后,三个样品的芯片振动频率曲线都经历了先下降又上升的过程,并且最终稳定。然而PPEK-OH和PPEK-SO3H样品振动频率相对于通入PBS前变化不大,而未经修饰的PPEK样品振动频率相对于通入PBS前明显上升。这说明PPEK-OH和PPEK-SO3H表面吸附的蛋白与基体材料之间的相互作用更强。

图7 不同样品表面吸附蛋白后QCM-D芯片频率变化
2.3 MC3T3-E1成骨细胞相容性及成骨活性评价
采用MTT法测定样品浸提液的细胞毒性。培养在PPEK,PPEK-OH和PPEK-SO3H样品上的MC3T3-E1成骨细胞孵育1,3 d后的细胞活力如图8所示。由图8可以看出,样品提取物对MC3T3-E1成骨细胞没有明显的细胞毒性,细胞存活率均大于85%。结果表明,三种样品都不会在浸提液中释放影响细胞生长的物质,不具有细胞毒性。

图8 培养在不同样品上的MC3T3-E1成骨细胞的细胞活力
通过CCK-8法定量分析可以快速、准确地检测细胞在不同样品表面的增殖活性情况,在固定波长(450 nm)处的吸光度与活细胞数量呈正比。图9展示了不同培养时间点MC3T3-E1成骨细胞在PPEK,PPEK-OH和PPEK-SO3H表面的增殖活性结果。从图9可以看出,MC3T3-E1成骨细胞在PPEK-OH和PPEK-SO3H表面的增殖情况显著优于其在未改性PPEK表面的增殖情况,并且PPEKSO3H表面的成骨细胞增殖活性最高。这说明PPEK-OH样品表面的羟基和PPEK-SO3H样品表面的磺酸基均促进了MC3T3-E1成骨细胞在材料表面的增殖生长,其中磺酸基的促进效果更好。
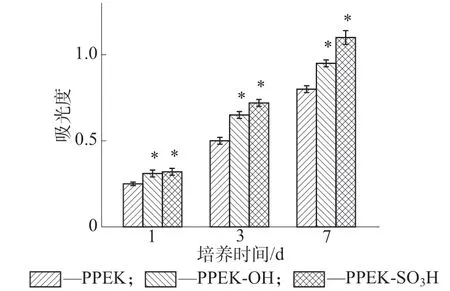
图9 培养在不同样品表面的MC3T3-E1成骨细胞在不同时期的增殖结果(*代表有统计学差异,P<0.05)
良好的生物相容性对细胞的贴附生长至关重要[15]。通过单光子激光共聚焦显微镜观察MC3T3-E1成骨细胞在PPEK,PPEK-OH和PPEKSO3H表面的生长贴附情况,结果如图10所示。由图10可以看出,细胞在三种样品表面贴附状态良好,细胞核呈球形或椭球型,细胞膜的铺展状态良好。PPEK样品表面贴附的细胞数量较少,PPEKSO3H样品表面的细胞数量最多,几乎铺满了整个表面。说明PPEK-SO3H样品为成骨细胞的贴附提供了更好的表面微环境,促进了细胞的铺展和生长。
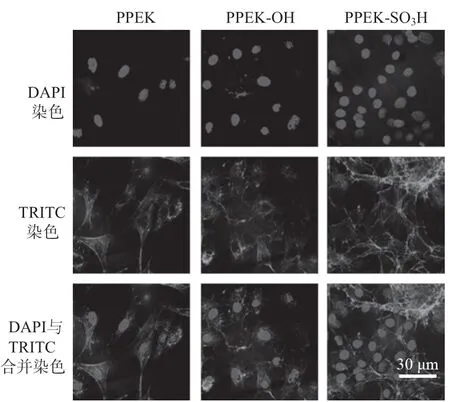
图10 MC3T3-E1成骨细胞贴附在不同样品表面的荧光共聚焦显微镜图像
ALP活性是衡量骨髓基质干细胞向成骨细胞分化程度和成骨细胞功能状态的重要指标,也是评价机体成骨活性和组织钙化能力的具体指标[16]。用MC3T3-E1成骨细胞的相对ALP活性作为衡量成骨活性的指标。图11是MC3T3-E1成骨细胞在PPEK,PPEK-OH和PPEK-SO3H表面生长7 d和14 d的相对ALP活性测试结果。由图11可以看出,成骨细胞在PPEK-OH和PPEK-SO3H表面生长7 d和14 d后,都表现出比PPEK更高的ALP活性,表明化学改性后的PPEK,尤其是PPEK-SO3H具有明显的促成骨效果。
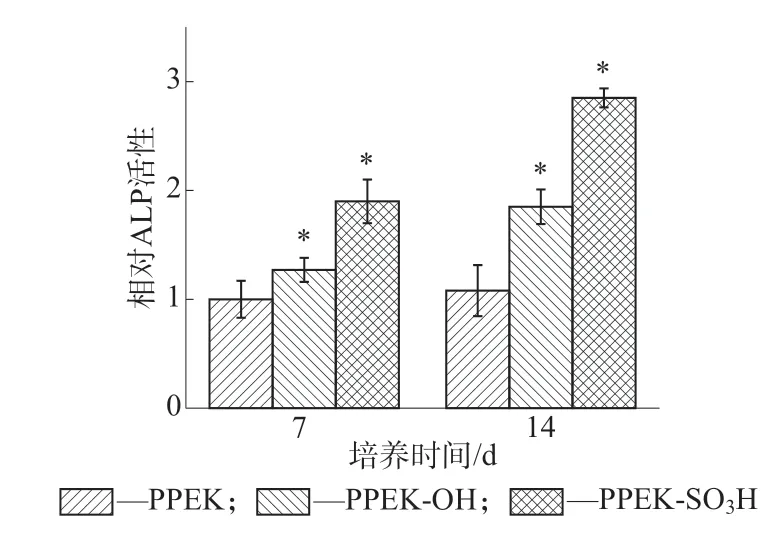
图11 MC3T3-E1成骨细胞在不同样品表面培养7,14 d的相对ALP活性(*代表有统计学差异,P<0.05)
图12是MC3T3-E1成骨细胞在PPEK,PPEKOH和PPEK-SO3H样 品 表 面 生 长3,7,14 d后ALP,COL-I和RUNx2基因的表达结果。由图12可以看出,与未改性的PPEK样品相比,PPEK-OH和PPEK-SO3H表面生长的细胞的成骨分化相关基因ALP,COL-I和RUNx2的表达水平显著提高。以上数据结果表明,PPEK-OH和PPEK-SO3H都可以促进MC3T3-E1细胞的成骨分化,其中PPEKSO3H的效果更好。
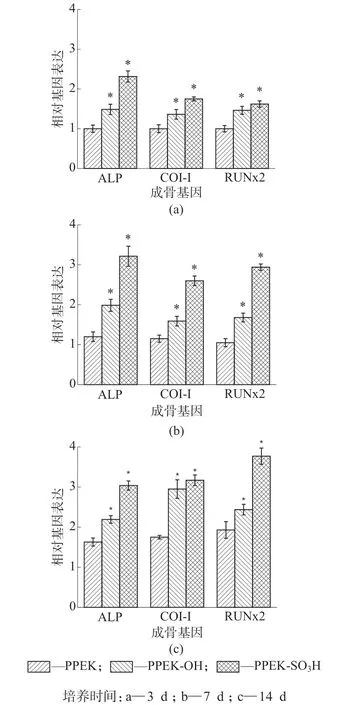
图12 MC3T3-E1成骨细胞在不同样品表面培养不同时间的成骨相关基因表达结果(*代表有统计学差异,P<0.05)
3 结论
(1)采用化学方法在PPEK主链上分别引入了羟基和磺酸基,通过模压和溶液涂覆的方法获得了表面羟基修饰的PPEK样品PPEK-OH和表面磺酸基修饰的PPEK样品PPEK-SO3H。研究了不同PPEK样品对Fn的吸附作用,发现PPEK-OH和PPEK-SO3H表面对Fn有较强的相互作用,其中PPEK-SO3H表面吸附量更多也更稳定。
(2)细胞实验结果表明,与未改性的PPEK相比,PPEK-OH和PPEK-SO3H表面能改善成骨细胞的增殖、贴附与成骨分化活性,并且PPEK-SO3H表面表现出更好的促成骨作用。
