蒙古马(斑点)胎儿期黑白毛色区域皮肤组织相关基因表达分析
2022-05-19白东义拉希玛图格琴赵若阳陶娜拉韩海格丁文淇贾紫洁刘慧莹王文兴黄博光
白东义 拉希玛 图格琴 赵若阳 陶娜拉 韩海格 丁文淇 贾紫洁 刘慧莹 王文兴 黄博光 芒 来*
(1.内蒙古农业大学 动物科学学院/内蒙古自治区马属动物遗传育种与繁殖重点实验室/农业农村部马属动物遗传育种与繁殖科学观测实验站/内蒙古农业大学马属动物研究中心,呼和浩特 010018;2.内蒙古中蕴马产业集团,锡林浩特 026000;3.锡盟镶黄旗农牧和科技局,013250)
内蒙古自治区具有深厚的蒙古族马文化底蕴,其传统马业在全国占有重要地位,被世人誉为马的故乡。目前内蒙古拥有蒙古马、阿巴嘎黑马、锡尼河马、鄂伦春马、三河马、锡林郭勒马和科尔沁马等多个优良品种[1-2]。蒙古马起源于西伯利亚东部草原,是世界上最古老的马品种之一。蒙古马经过漫长的自然选择和人工选育,形成了抗病力强、耐严寒、耐粗饲、合群性好等特征,毛色种类复杂,大多数以黑、骝、青色为主,还有很多稀有毛色,如海骝、鼠灰、兔褐、沙毛、花毛、斑点毛等。
毛色是研究生物遗传形成性状的重要因素之一,色原体和氧化酶是马匹毛色的相关物质,色原体可以分为黑色素和含铁色素,二者普遍存在于毛的皮质内或皮肤表皮的色素细胞中,黑色素在氧化酶的作用下形成黑色,黑色素的分布和比例决定动物毛色。斑点毛色的表型丰富多样,有均匀分布于全身的斑点,也有遍布全身的毯状分布的斑点,而且斑点的大小、形状各不相同[3-4]。毛色不仅是品种和个体识别的重要依据, 而且还可以作为某些疾病筛查的有力工具和手段。
马对人类具有巨大的经济价值,马的毛色一直是被忽视的重要领域。科学技术和马产业主导了家马进化过程中产生多样化的毛色,马的毛色和质地与其健康状况息息相关。目前国外马产业非常发达,进而科学研究也迅速发展,近些年我国马产业也不断壮大,但科学研究相对滞后。目前研究表明,小眼畸形关联转录因子(Microphthalmia associate transcription factor,MITF)、原癌(Proto-oncogenec-kit,KIT)和酪氨酸酶家族成员(TYR、TYRP1和TYRP2)等基因均参与动物毛色形成与调控[5]。马的斑点是一个稀有毛色,在距今25 000年左右的马DNA样品中检测到豹斑点表型是由LP(Leopard complex spotting)基因座所决定[6]。相关研究表明,一个等位基因Lp决定马匹是否会产生豹点毛表型,修饰基因决定斑点分布于马体的哪些部位或区域。至于马体上斑点的大小、形状以及颜色等也受另一些修饰基因的控制。Lp纯合子与杂合子具有不同表型,当等位基因型为LpLp的纯合子时马体上的斑点会变少,白色区域大。而等位基因型为Lplp的杂合子时马体上的斑点较多,白色区域小。豹斑点毛马多样的表型形成与主效基因和修饰基因的相互作用有关[7-8]。阿帕卢萨马TRPM1基因的基因型为LP/LP或LP/lp时,豹斑点毛色表型便会表现出来[9]。Pattern1型(或称PATN1型)是决定豹斑点毛色表型的重要修饰位点,PATN1称显性遗传,决定马匹出生时白色区域超过60%时起重要作用[10]。
毛囊是皮肤重要的附属器官,是可再生的,具 有复杂的形态和结构,由上皮组织和真皮组织组成,是毛发的加工厂。而毛发的大小和形状是由位于毛囊底部的特殊成纤维细胞组成的毛乳头决定的,而毛发的颜色则是由散布在基质细胞之间的黑色素细胞产生的色素所决定的。目前研究者们对猪、牛、羊、鼠等动物毛囊研究较多,而对于马的毛囊结构研究相对较少。内蒙古自治区马遗传资源丰富,并且蒙古马具有丰富的毛色类型,是研究马毛色形成机理的最佳模型。尤其近些年,马的观赏旅游业不断兴起,外观表型成为选育的一个焦点。因此,了解马的毛发生长、周期和色素合成,进一步解析蒙古斑点马毛色类型是如何被调控并能够维持各自相互独立的毛囊周期和形态发生,对进一步选育斑点马具有重要的科学意义。本研究以蒙古斑点马胎儿为研究对象,基于以往对马属动物毛色的研究基础上,将毛色表型与转录组表达谱进行关联分析,目的是明确候选基因在毛色形成过程中产生的差异机理,以及相互之间的关系。对多个与毛色可能相关的候选基因进行分子生物学和转录组学鉴定,为今后选育蒙古马(斑点)环节中对毛色的筛选具有重要意义。
1 材料与方法
1.1 试验材料
本研究选取3匹5~6月龄具有典型斑点表型的蒙古马胎儿,实验马匹来源于内蒙古自治区包头市达茂旗,分别采集蒙古马(斑点)胎儿体躯黑、白斑点区域皮肤组织样品。共采集两部分样品,一部分样品储存在-80 ℃冰箱,另一部分样品使用4%的多聚甲醛固定后经过乙醇梯度脱水,最后储存在100%无水乙醇中,在4 ℃冰箱中保存。
1.2 试验方法
1.2.1石蜡切片及HE染色
为观察蒙古马(斑点)胎儿黑毛色区域和白毛色区域皮肤组织的表型信息,将黑色和白色毛区域皮肤组织样品放入二甲苯使其透明,经石蜡过渡和包埋后,进行修整和冷却。使用切片机对皮肤毛囊组织进行纵切得到7 μm厚度的石蜡切片,经过烘干后得到黑色毛区域和白色毛区域的皮肤组织切片。接下来进行HE染色,将烘干后的组织切片放入二甲苯中进行脱蜡,经过乙醇梯度水化后,使用苏木素和伊红对皮肤组织切片进行染色,再经过乙醇梯度脱水、二甲苯清洗后,使用中性树胶封片,晾干后放在显微镜下进行观察。
1.2.2RNA提取及文库构建
使用Trizol提取法(Invitrogen, CA, USA)利用动物组织RNA纯化试剂盒TRK1002(LC Science, Houston, TX)对蒙古马(斑点)18个胎儿皮肤组织样品提取总RNA,使用Gen 5 CHS软件对RNA质量进行分析。从各样品中取3 μg总RNA用于构建cDNA文库。然后使用mRNA-Seq样品制备试剂盒(Illumina, San Diego, USA)生成测序文库,将构建好的文库使用Illumina NextSeq500进行测序。
1.2.3转录组表达谱数据分析
首先用Cutadapt软件对测序的原始数据进行去除接头污染、去除低质量、去除与核糖体RNA匹配和含N比例大于5%的Reads,并得到高质量的Reads。使用HiSAT2软件将高质量的Reads和马参考基因组(EquCab3.0)进行比对分析。接下来使用StringTie软件利用 RNA-Seq 比对结果组装转录本并得到胎儿期蒙古马皮肤组织表达谱[11]。利用DEseq2软件进行基因差异表达分析[12],差异显著标准:P<0.01和log2|Fold change|>1,得出与毛色差异相关基因。利用R语言的GOseq包对差异表达基因进行分析。使用DAVID (https:∥david.ncifcrf.gov/)在线软件对差异表达基因进行GO 和KEGG富集分析。
1.2.4实时荧光定量PCR验证
根据转录组数据结果筛选了3个(TYR、TYRPI和DCT)与毛囊发育及色素合成相关的差异表达基因,通过NCBI中GenBank检索马的TYR、TYRPI和DCT基因序列,利用NCBI在线引物设计功能设计特异性引物(表1)并选择GAPDH基因做为内参基因,然后将设计好的引物送Invitrogen公司合成。使用HiScript®II qRT SuperMix for qPCR (Vazyme)从总RNA中生成cDNA。然后用4条引物和SYBR®Premix Ex TaqTMII (TaKaRa)在CFX96 Real-Time PCR检测系统(Bio-Rad)上进行qPCR。

表1 马毛色相关基因引物信息Table 1 Primers of genes related to horse hair color
2 结果与分析
2.1 蒙古马(斑点)胎儿体躯皮肤黑白区域表型采集
蒙古马(斑点)胎儿皮肤组织HE染色结果显示:如图1(a)所示,蒙古马(斑点)胎儿皮肤毛囊结构完整,可以清晰地观察到毛囊的毛乳头、毛母质、毛干、内根鞘和外根鞘等。其中黑色素在胎儿黑色皮肤组织表皮里沉积很明显,毛乳头、毛母质部位均有黑色素沉积。相反如图1(b)所示,白色被毛对应的皮肤组织表皮处、毛囊毛乳头和毛母质部位均无黑色素沉积。另外,经过统计发现蒙古马(斑点)胎儿黑色被毛皮肤组织和白色被毛皮肤组织的毛囊长度、毛囊密度以及毛乳头宽度均无显著差异。

黑色箭头所指部位是表皮。The green arrow indicates the epidermis.图1 蒙古马(斑点)胎儿毛囊形态及色素分布Fig.1 The hair follicle morphology and pigment distribution in Mongolian spotted horse embryo
2.2 蒙古马(斑点)胎儿体躯黑白区域皮肤转录组分析
蒙古马(斑点)胎儿6个RNA测序文库总共获得约283 M(Million)原始读段(Raw reads)。其中,6个 RNA测序文库各获得53 327 604、46 708 144、44 016 494、48 127 492、45 391 060和46 040 764条原始下机Reads,去除低质量Reads 和接头污染以及其他污染,最终获得约275 M有效数据(Valid Data),分别为51 799 584、45 302 790、42 752 334、46 746 492、44 071 174和44 589 520 条高质量的Reads。从测序数据质量结果来看,总Q20的比例均在99.97%,总Q30的比例在97.79%~98.179%,总GC含量在50%~52%(表2),可以说明本研究中的测序数据碱基读取的准确率较高。

表2 蒙古马(斑点)胎儿RNA-seq数据质控Table 2 Summary of RNA-seq data
利用DEseq2软件对蒙古马(斑点)胎儿黑色和白色皮肤组织文库中所有 mRNA进行显著性差异分析,并对2个部位之间进行差异表达分析。使用Benjamini-Hochberg法校正P<0.05,log2|Fold change|>1作为有效差异表达的阈值。如图2所示,共鉴定出660个基因的表达量在黑白2个不同颜色皮肤组织中存在显著差异(P<0.05),其中197个基因在蒙古马(斑点)胎儿黑色皮肤组织表达量较高,59个基因在蒙古马(斑点)胎儿白色皮肤组织表达量较高。

图2 胎儿期蒙古马差异基因火山图Fig.2 Volcanic map of differential genes in Mongolian horse during fetus
利用R语言的GOseq包进行差异表达基因GO富集分析,选取P<0.05的GO条目。使用DAVID (https:∥david.ncifcrf.gov/)在线软件对差异表达基因进行GO 和KEGG富集分析。结果显示,差异表达的197个基因被注释到28条GO通路上,其中被注释到10条生物学途径通路,8条细胞组成通路,10条分子功能通路(图3)。差异表达基因及GO通路显著富集到的GO term分别为膜的组成部分(Integral component of membrane)、角蛋白丝(Keratin filament)、细胞(Cell)、胶原三聚体(Collagen trimer)、蛋白质细胞外基质(Proteinaceous extracellular matrix)、卫星细胞分化的负调控(Negative regulation of satellite cell differentiation)、肌管分化的调节(Regulation of myotube differentiation)、角质形成细胞分化的调节(Regulation of keratinocyte differentiation)、黑色素生物合成过程(Melanin biosynthetic process)、胶原原纤维组织(Collagen fibril organization),胎儿骨骼系统形态发生(Embryonic skeletal system morphogenesis)、蛋白聚糖代谢过程(Proteoglycan metabolic process)、前/后模式规范(Anterior/posterior pattern specification)、组织稳态(Tissue homeostasis)、序列特异性DNA结合(Sequence-specific DNA binding)、表皮的结构成分(Structural constituent of epidermis)、铜离子结合(Copper ion binding)、乙酰胆碱结合(Acetylcholine binding)、糖蛋白结合(Glycoprotein binding)、类固醇激素受体活性(Steroid hormone receptor activity)和细胞外基质结构成分(Extracellular matrix structural constituent)。
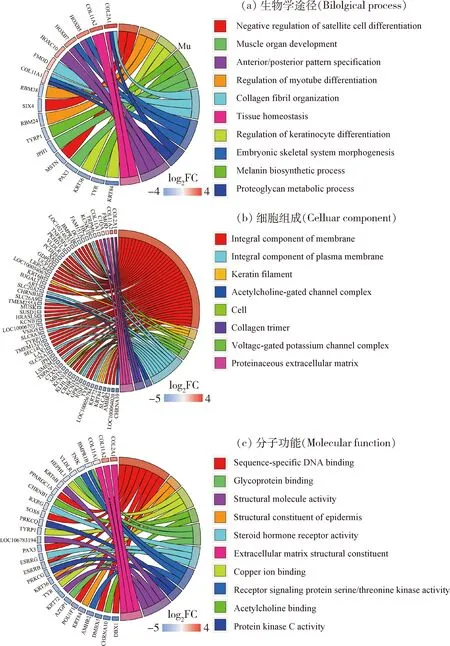
图3 差异表达基因的GO功能富集分析Fig.3 GO enrichment analysis of differentially expressed gene
为进一步了解差异表达基因,本研究对蒙古马(斑点)胎儿差异表达基因进行了KEGG分析。结果如图4所示,蒙古马(斑点)胎儿显著富集的通路有12个(P<0.05),这些通路分别为黑色素生成(Melanogenesis)、胃酸分泌(Gastric acid secretion)、酪氨酸代谢(TYRosine metabolism)、癌症中蛋白聚糖(Proteoglycans in cancer)、Wnt信号通路(Wnt signaling pathway)、非小细胞肺癌(Non-small cell lung cancer)、调节干细胞多能性的信号通路(Signaling pathways regulating pluripotency of stem cells)、蛋白质消化吸收(Protein digestion and absorption)、ECM-受体相互作用(ECM-receptor interaction)、阿米巴病(Amoebiasis)、血小板活化(Platelet activation)和粘着斑(Focal adhesion)。
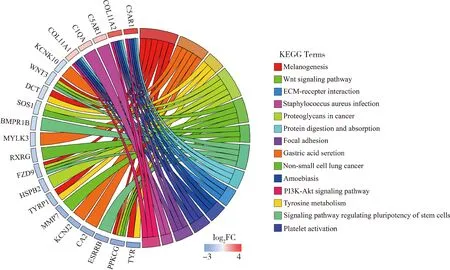
图4 蒙古马(斑点)胎儿差异表达基因KEGG富集分析Fig.4 KEGG analysis of differentially expressed gene in Mongolian spoted horse embryo
通过差异表达分析筛选得到的蒙古马(斑点)胎儿黑色、白色皮肤组织中的差异基因做出韦恩图,如图5所示,结果发现蒙古马(斑点)胎儿黑色皮肤组织中197个基因表达,59个基因在白色皮肤中表达,两者之间没有共表达基因。

图5 蒙古马(斑点)胎儿黑白皮肤组织mRNA差异表达韦恩图Fig.5 Differential expression of mRNA in black and white skin tissues of Mongolian spotted horse embryo by Venn diagram
2.3 实时荧光定量PCR验证
酪氨酸酶是黑色素合成过程中的关键酶,TYR、TYRP1和DCT是黑色素合成下游的关键基因,本研究对胎儿期蒙古马(斑点)黑色皮肤组织中显著表达的3个基因TYR、TYRP1和DCT利用RT-qPCR技术进行了 mRNA 定量表达验证,如图6所示,RT-qPCR结果与转录组测序结果表达趋势一致,表明转录组测序数据结果可信。

图6 mRNA-seq和qRT-PCR验证Fig.6 mRNA-seq and qRT-PCR validation
3 讨 论
由于胎儿皮肤组织与母体子宫直接接触,毛发较难清理干净,这会引起RNA污染并影响最终测序结果。为避免这种情况可在捕获去除过程中添加一部分原核的核糖体探针来减轻污染。另外还需重新采集一次样本,在取样时将表皮用生理盐水或使用PBS清洗之后再放入液氮冻存[13]。
毛囊是哺乳动物被毛皮肤附属器官,具有周期性再生功能,其性状和组织结构决定了动物被毛的品质和数量。毛囊形态发生产生的被毛可以抵御外界环境变化,被毛附着在皮肤最外层,具有防御、保护和信息交流功能[14]。蒙古马(斑点)毛囊结构与其他哺乳动物毛囊结构基本一致,主要由毛干和毛根两部分构成。李欢乐等[15]对双峰驼胎儿期皮肤毛囊及其附属结构发生发育的研究中提到双峰驼3月胎龄时,全身皮肤已具有完整的颗粒层和生发层结构,并且具有不同程度发育的毛囊原始体,从毛发生到毛遍布体表约需5个月。本研究中HE染色观察发现蒙古斑点马胚胎从5~6月胎龄,其毛囊结构基本完整,但6月胎龄的胎儿除了尾巴和睫毛外其他部位的毛发均未有发生到体表外的现象。蒙古马毛囊只有一个出口,其毛囊结构与刺猬等动物相似,属于非复合毛囊。
动物的被毛颜色由毛囊中的黑色素细胞决定。黑色素是在黑素小体发育过程中由各种蛋白质产生。黑素体是黑色素细胞中的细胞器,可以合成和运输黑色素[16]。人的黑白头发是由毛球是否有正常的黑色素生物合成以及黑色素细胞向角质形成层转移所决定[17]。蒙古马(斑点)胎儿体躯有大小分布不均的毯状斑点,可能由于缺乏TRP-2的表达影响了银位点的产物[18]。这可能是蒙古马(斑点)胎儿黑色斑点部位毛囊有色素沉积的原因。
转录组技术可以从细胞或者组织中获取所表达的全部转录本,这些转录本可以表现出机体各种细胞类型、生理状态、组织类型或不同生长阶段下所表达的全部基因。本研究通过转录组分析筛选得到109个基因在黑色皮肤组织中表达。包括TYR、TYRP1和DCT基因,蒙古马(斑点)胎儿的斑点表型可能与这3个基因有直接联系。在GO富集分析中TYR和TYRP1在生物途径过程中主要注释在黑色素生物合成过程(Melanin biosynthetic process)中,可能说明二者在蒙古马胎儿阶段就已经开始发挥作用产生黑色素使胎儿阶段的蒙古马皮肤发生改变,另外二者在分子功能上注释到铜离子结合(Copper ion binding),铜离子微量元素和黑色素的合成密切相关。铜元素是刺激酪氨酸酶活性的重要物质,能够促进黑色素功能的恢复和再生。在KEGG功能注释中发现TYR、TYRP1和DCT基因在酪氨酸新陈代谢(Tyrosine metabolism)过程中,调控黑色素生成的密切相关基因是酪氨酸酶基因家族(TYR,TYRP1,DCT)。TYR是调控黑色素生成的关键酶。TYR催化2个主要的反应:酪氨酸羟基化生成3,4-l-二羟基苯丙氨酸,和 dopa 氧化生成多巴醌。TYR、TYRP1和TYRP2均直接参与了黑色素的合成。三者都在黑素小体发育的III期发挥作用,黑素小体蛋白基因PMEL是控制毛色的主要候选基因之一[19]。多巴醌是一种高活性的中间体,通过一系列复杂的氧化还原反应最终形成黑色素[20]。当TYR活性高时,合成真黑色素。相反,活性不高时合成褐黑素[21]。
毛色主要由黑色素的合成和分布决定,黑色素是皮肤、毛球和眼睛颜色色素沉着的主要原因[22]。在细胞水平上,黑色素在黑色素细胞中合成,黑色素细胞有规律地散布在基底角质。黑色素细胞的发育和黑色素形成受多种基因调控。本研究中KEGG功能富集在Wnt/β-catenin信号通路,Wnt通路不仅仅可调控毛囊的生长发育并且对毛囊黑色素的生成也起到了重要作用。例如Wnt3a基因过表达后,可以通过促进MITF、TYR、TYRP1和PMEL基因表达的方式,来调控黑色素的表达[23]。并且过表达Wnt3a能够诱导神经嵴干细胞增殖,通过依赖Sox10和内皮素 3 (END3) 调控神经嵴干细胞向黑色素母细胞分化,最后生成黑色素细胞[24]。有研究表明SFRP5基因能够抑制PIG1细胞中酪氨酸酶活性和黑色素生成,并通过抑制Wnt/β-catenin信号通路下调小眼畸形相关转录因子(Microphthalmia-associated transcription factor, MITF)及其靶蛋白的表达[25]。小眼畸形转录因子是黑色素细胞发育和黑色素形成的主要调控因子[26-27]。MITF促进了TYR、TYRP1和DCT的表达[28]。MITF的表达和功能对于动物生产多种颜色的毛纤维具有关键作用。杨姗姗等[29]研究表明microRNA-5110通过靶向结合Wnt1和MLPH调控毛色基因MITF、TYR、TYRP1和TYRP2以及转运基因MyosinVa和Rab27a的表达而影响小鼠毛色表型变化。因此可以进一步表明在黑色素的合成中不仅仅是Wnt信号通路中的基因可以直接调控黑色素的合成,还有其他非Wnt信号的基因和非编码RNA通过Wnt通路来影响黑色素的合成。
本研究中通过HE染色对胎儿期蒙古马毛囊组织进行观察,发现黑色素在胎儿期已经发生沉积,经过筛选和分析胚胎白色和黑色皮肤组织中的差异基因,发现TYR、TYRP1和DCT基因对蒙古斑点马表型形成相关,这对于蒙古斑点马的育种环节和筛选毛色起到十分重要的作用。在后续的工作中,可对蒙古斑点马一年中不同月份不同部位皮肤毛囊进行研究,确定蒙古斑点马不同部位皮肤毛囊在各月份所处的毛囊周期,对参与蒙古斑点马被毛色素沉积的microRNA和LncRNA深入挖掘。
4 结 论
胎儿期蒙古马(斑点)黑色皮肤组织和白色皮肤组织中的色素分布有明显的差异,黑色素细胞主要分布于黑色皮肤组织表皮和毛囊毛球部位。经过转录组筛选出差异基因256个,其中197个基因在蒙古马胎儿黑色皮肤组织表达量较高,59个基因在蒙古马胎儿白色皮肤组织表达量较高。TYR、TYRP1和DCT等基因主要表达在胎儿期蒙古马(斑点)黑色皮肤组织中,黑色素生成和Wnt信号通路等信号通路都与毛色生成有关。