TGF-β1介导的Smad和ERK信号通路在肾纤维化中的研究进展
2022-05-18陈志强河北中医学院石家庄050000
郭 帅 方 敬 陈志强 (河北中医学院,石家庄 050000)
肾纤维化是慢性肾脏疾病的最终共同途径,以细胞外基质(extracellular matrix,ECM)的过度沉积为主要特征,与患者的长期预后密切相关。TGF-β1是目前公认的最强的致纤维化生长因子之一,可以通过增加ECM 合成,抑制ECM 降解,促进肾细胞与基质的黏附,引起炎症细胞的浸润,介导肾固有细胞的凋亡、肥大、脱离及表型转换等导致肾纤维化。TGF-β1 所介导的信号通路分为Smad 依赖途径及Smad 非依赖途径,其中Smad 非依赖途径以ERK 信号通路为主。TGF-β1/Smad 及 TGF-β1/ERK 信号通路相互交叉协作调控靶基因转录及蛋白表达,诱导肾纤维化。
1 TGF-β1
TGF-β1是TGF-β超家族的成员,其家族还包括骨形态发生蛋白、生长分化因子、米勒抑制物质、抑制素、活化素等[1]。TGF-β 是一种广谱生长因子,可调节许多基本的生物学过程,包括细胞生长、分化、黏附、增殖组织修复和凋亡。在哺乳动物中存在TGF-β1、TGF-β2 和TGF-β3 3 种亚型。TGF-β1 是与肾纤维化最相关的亚型,可由所有类型的肾细胞和浸润炎症细胞分泌。细胞分泌的TGF-β1 都是以无活性的潜活 TGF-β1 复合物(LTGF-β1)形式存在,这种复合物主要包括潜活相关蛋白(LAP)、成熟TGF-β1 多肽和TGF-β1 结合蛋白(LTBP),当暴露于各种刺激[包括pH值、活性氧、纤溶酶、组织蛋白酶、整联蛋白和血小板反应蛋白(TSP)-1等],TGF-β1从潜在复合物中释放出来,成为有活性的TGF-β1,与其细胞表面受体结合[2]。TGF-β1 受体属于跨膜蛋白丝氨酸/苏氨酸激酶家族,有3种类型,TGF-βⅠ型受体(TβRⅠ)、Ⅱ型受体(TβRⅡ)和Ⅲ型受体(TβRⅢ),其中TβRⅠ和TβRⅡ是TGF-β信号通路激活的必需分子。成熟的TGF-β1与TβRⅡ结合以募集TβRⅠ,启动Smad 依赖性和Smad 非依赖性信号途径,介导生物学效应[3]。
越来越多的证据表明,TGF-β1在实验性动物模型和人类肾纤维化中发挥重要作用,TGF-β1在纤维化肾脏中均显著上调,且与原发病无关。TGF-β1诱导肾脏纤维化的主要机制包括:①诱导Ⅰ型及Ⅳ型胶原、纤维连接蛋白(FN)等ECM 的合成[4-5];②减少金属蛋白酶(MMP)的合成和增加金属蛋白酶抑制剂的合成来抑制ECM 降解[6];③诱导肾系膜细胞、上皮细胞及内皮细胞肥大、增殖、凋亡、脱离等[7];④促进成纤维细胞、周细胞、上皮细胞、内皮细胞、巨噬细胞等向肌成纤维细胞转分化[8-9];⑤改变整联蛋白的表达并调节其在细胞表面的相对比例,促进细胞与ECM的黏附[10]。
2 TGF-β1/Smads信号通路与肾纤维化
Mad 蛋白和Sam 蛋白同处于丝氨酸/苏氨酸激酶受体下游,因此将Mad 蛋白和Sam 蛋白及其类似物统称为 Smad 蛋白。Smad 是 TGF-β1 信号转导过程中重要的胞内下游分子,将TGF-β1 信号由膜受体传导至细胞核,调控靶基因的转录。在哺乳动物中已发现8 种Smads,根据结构和功能可分为:①受体 激 活 Smads(R-Smads),包 括 Smad1、Smad2、Smad3、Smad5 和 Smad8;②普通 Smads(Co-Smads),包括 Smad4;③抑制性 Smads(Ⅰ-Smads),包括Smad6 和 Smad7。Smad2、Smad3、Smad4 和 Smad7 参与TGF-β1 信号通路。TGF-β1 与 TβRⅡ结合激活TβRⅠ,导致Smad2 和Smad3 磷酸化,激活的Smad2和Smad3与Smad4形成复合物,易位到细胞核中,调节靶基因的转录。Smad7 是Smads 家族中的抑制性蛋白,由TGF-β1诱导产生,在正常情况下,Smad7可以通过竞争TβRⅠ、阻止Smad2/3 磷酸化、招募E3连接酶Smurf1/2 或Nedd4-2 到TβRⅠ致TβRⅠ的泛素化降解等多种方式,阻止TGF-β1 信号通路的过度活化,从而起到负反馈的作用。
TGF-β1/Smad 信号通路与肾纤维化密切相关。TGF-β1/Smad信号的激活显著促进了肾小球硬化和肾小管间质纤维化[11]。Smad2 和 Smad3 在实验性动物模型和人类肾纤维化中均被过度激活[12-13]。多项研究表明,Smad2 和 Smad3 在 TGF-β1 介导的信号通路中具有相反的功能。在不同病因所引起的肾纤维化模型中,敲除Smad3 基因可以明显缓解肾纤维化程度[14]。Smad3 的过表达抑制成纤维细胞中MMP-1的活性[15]。Smad3可以直接结合到胶原蛋白的启动子区域以诱导其合成[16]。以上研究均表明Smad3 具有致病性。虽然Smad2 和Smad3 的结构具有90%以上的相似性,但Smad2 在肾纤维化中起保护作用。敲除Smad2 基因加重了UUO 小鼠的肾纤维化,而Smad2 的过表达减弱了肾小管上皮细胞中TGF-β1 诱导的Smad3 磷酸化和Ⅰ型胶原蛋白的表达[17]。Smad4 是将 Smad2/3 易位到细胞核中的关键分子。在小鼠及细胞实验中,敲除Smad4基因,均可减轻ECM 的积累。进一步的研究表明,敲除Smad4基因是通过降低Smad3 反应性启动子活性并抑制Smad3 与 Col1A2 启动子的结合而减弱肾纤维化[18]。Smad7是TGF-β1信号通路重要的负反馈调节因子,在纤维化肾脏中,Smad7 的水平明显降低[19]。体内外实验均表明,Smad7 基因过表达能抑制TGF-β 介导的肾纤维化,而Smad7 基因敲除加重肾纤维化[20-21]。以上研究结果表明,Smad2和Smad3既有共性又有其各自起作用的方式,在肾纤维化中的作用不尽相同,有待进一步研究。Smad4促进肾纤维化,Smad7 抗肾纤维化。总之,Smad 依赖的信号通路在传导TGF-β1信号介导肾纤维化中发挥重要作用。
3 TGF-β1/ERK信号通路与肾纤维化
细胞外信号调节激酶(ERK)属于丝裂原活化蛋白激酶家族(MAPK)。MAPK 是一个在真核生物中保守性很高的蛋白丝/苏氨酸激酶家族,调控着代谢、基因表达、增殖、运动等多种细胞活动。迄今为止,已在哺乳动物中鉴定出5 种不同的MAPK:细胞外信号调节激酶 1 和 2(ERK1/2)、c-Jun 氨基末端激酶 1、2 和3(JNK1/2/3)、p38、ERK3/4 及 ERK5。研究最广泛的是ERK1/2、JNK1/2/3和p38激酶。尽管每个MAPK 都有独有的特征,但有相同的信号传导模式,每个MAPK 家族都由一组3 个顺序起作用的激酶组成:MAPKK 激酶(MAPKKK)、MAPK 激酶(MAPKK)和MAPK。MAPKKK 是丝氨酸/苏氨酸激酶,活化的MAPKKK 可磷酸化MAPKK 而将其激活,活化的MAPKK 将 MAPK 磷酸化而激活,活化的 MAPK 可以转位至细胞核内,通过磷酸化作用激活多种关键酶、转录因子等,使细胞对外来信号产生生物学应答。
ERK 是较大的丝裂原活化蛋白激酶家族的成员。ERK1 和ERK2 的结构有84%相同,因此,常使用ERK1/2 进行指代。ERK1/2 调节细胞周期进程、增殖、胞质分裂、转录、分化、衰老、死亡、迁移、GAP连接形成、肌动蛋白、微管网络、神经突延伸和细胞黏附等。ERK1/2 信号的畸变已被广泛用于多种疾病,包括多种癌症、糖尿病、病毒感染和心血管疾病等。MAPK 可以被生长因子、细胞因子、激素、高渗、压力及理化刺激等激活,但一般来说,ERK1 和ERK2 会优先响应生长因子被激活[22]。细胞外生长因子(如表皮生长因子EGF、血小板衍生因子PDGF等)与其各自的跨膜受体酪氨酸激酶(RTK)结合后形成二聚体,激活受体酪氨酸激酶活性,受体自身络氨酸残基磷酸化,形成SH2 结合位点,结合含有SH2 结构域的接头蛋白 Grb2,Grb2 的 2 个 SH3 结构域与SOS 分子中的脯氨酸序列结合,SOS 活化之后SOS 结合 Ras 蛋白,促进 Ras 释放 GDP、结合 GTP,Ras-GTP 可引起 Raf(MAPKKK)、MEK(MAPKK)和ERK(MAPK)的顺序募集和激活。Raf 的激活机制非常复杂,需要Ras 的结合、多次磷酸化/去磷酸化事件及Raf 二聚体的形成,至今尚未完全阐明[23]。Raf是一组丝氨酸/苏氨酸激酶(A-Raf、B-Raf、C-Raf),其中C-Raf 是研究最广泛也是功能最多的激酶,其调节作用复杂且仍待阐明[24]。活化的Raf 与双特异性激酶MEK(MEK1、MEK2)结合并使其磷酸化,继而在其活化环保守的Thr-Glu-Tyr(T183-E-Y185)基序内使ERK 磷酸化。尽管MEK1和MEK2具有广泛的同源性,但研究表明,MEK1 激活的ERK2 优先聚集在细胞核中[25]。然后,活性 ERK1/2 从 MEK1/2 中释放出来,可以易位进入细胞核或在细胞质中磷酸化100多种具有多种功能的底物[26]。
ERK 信号通路是TGF-β 介导肾纤维化的另一重要信号通路。与前文所介绍的RTK 类似,被活化的TβRⅡ-TGF-β1-TβRⅠ三聚体在Tyr和Ser上募集并直接磷酸化ShcA,触发了与Grb2 和SOS 的缔合,从而激活了Ras-ERK 途径。然而,有研究表明,在成纤维细胞中,TGF-b 激活Erk 途径与经典的Ras/Raf/ERK 途径并不同,Ras 可能仍参与其中,但起次要作用,C-Raf 激活主要通过 Pak2 发生[27]。大量研究表明,ERK 信号通路在不同原因所致的肾纤维化动物模型及人类中呈激活状态,抑制该通路可以缓解肾纤维化[28-29]。ERK 途径可通过抑制肾小管EMT改善肾间质纤维化[30]。TGF-β1 通过 ERK1/2 途径,导致肾小管细胞胶原沉积和肾纤维化。TGF-β1 可激活体外培养的足细胞ERK1/2,并诱导间质MMP-9的表达和活化,导致基底膜的损伤,最终引起肾小球硬化[31]。ERK1/2 抑制剂 PD98059 可以抑制鼠肾小球系膜细胞结缔组织生长因子的表达,从而减轻肾纤维化[32]。以上研究结果表明,TGF-β1通过活化ERK 信号通路介导肾小管上皮细胞EMT,增加ECM的分泌,抑制ECM 的降解,促进肾纤维化。总之,TGF-β1/ERK 信号通路在肾纤维化中作用不容忽视。
4 TGF-β1 介导的 Smads 和 ERK 信号通路在肾纤维化中的相互关系
TGF-β1 既能诱导经典的 Smad2/3 信号,又能诱导非经典的C-Raf-MEK1/2-ERK1/2信号,2条信号通路相互作用产生细胞增殖、分化、迁移、生长停滞、凋亡和上皮间质转分化等多种生物学反应[33-34]。已有大量研究表明,Smad 与ERK 信号转导之间的存在串扰。有研究发现,TGF-β 诱导的ERK 信号通路可促进Smad2/3磷酸化[35]。另外,TGF-β诱导的Ras/ERK MAPK 信号诱导 TGF-β1,并放大 TGF-β 反应。Ras-ERK途径与TGF-β协同诱导Smad依赖的Snail1表达,这是EMT 通过抑制E-钙黏着蛋白表达所必需的[36]。进一步研究表明,在 Smad2 和 Smad3 的连接子区域内,有几个潜在的ERK 磷酸化位点,ERK 介导的接头区域磷酸化增加了受体磷酸化的Smad2和Smad3 的半衰期,而且还增加了Smad 转录活性的持续时间[27]。Smad2/3 的快速磷酸化,可被 ERK1/2 或p38MAPK抑制剂阻断[37]。以上结果均表明,TGF-β1介导的ERK 信号和Smad 信号之间是相互协同的。但也有一些研究有相反的意见,表型正常的间充质细胞中发现了TGF-β 诱导的ERK 激活,但在正常的上皮细胞中没有发现[27]。ERK 会磷酸化Smad2/3的接头区域,该区域被TGF-β 激活,从而抑制了Smad2/3 的核转运和 Smad 的依赖性转录[38]。在原代培养的肺泡上皮细胞及其细胞系中,Ras-ERK 通路会干扰 TGF-β1 诱导的 Smad 信号介导的 EMT[39]。磷酸化的连接子区域,还显示出抑制Smad核易位和信号传导[40]。以上研究引起本课题组进一步思考,可能 TGF-β1/ERK 途径对 TGF-β1/Smad 的正负调控作用因细胞类型而产生差异,但具体的分子机制仍需深入研究。
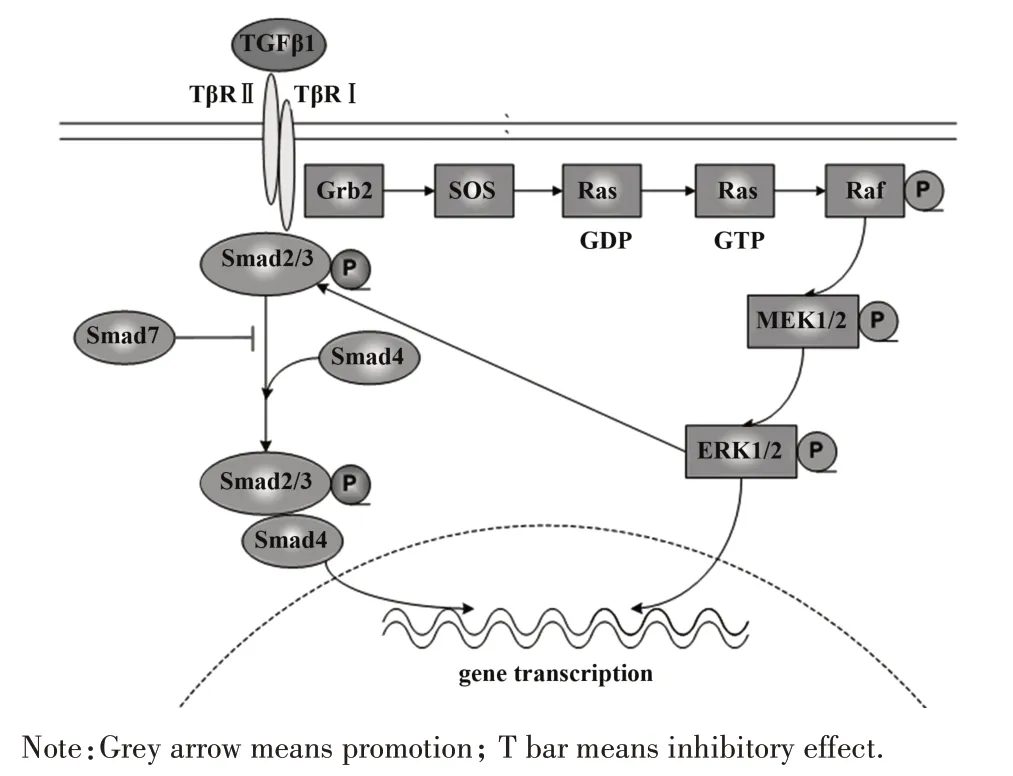
图1 TGF-β1介导的Smad和ERK信号通路在肾纤维化中的作用Fig.1 Role of Smad and ERK signaling pathway mediated by TGF-β1 in renal fibrosis
5 结语
综上所述,TGF-β1 所介导的 Smad 信号和 ERK信号从多个方面参与了肾纤维化的形成。2 条通路并不是简单的线性传导,而是受到多种蛋白的调控,且通路之间相互作用,使机制变的更为复杂。虽然目前已经开发了TGF-β1、Ras、Raf、MEK和一些下游靶标的抑制剂,但许多抑制剂仍在临床试验中。因此应对TGF-β1 信号深入研究,揭示TGF-β1/Smads和TGF-β1/ERK信号通路间的本质联系,认识到机制的关键,开发特定的抑制剂,造福于肾纤维化患者。
