柴参解郁汤对腹泻型肠易激综合征小鼠粪便胆汁酸代谢轮廓的影响
2022-05-18王艳天顾欣王帆朱梦婷徐坠成徐艺
王艳天,顾欣,王帆,朱梦婷,徐坠成,徐艺
(1.南京中医药大学附属医院,江苏 南京 210029;2.南京中医药大学第一临床医学院,江苏 南京 210023;3.南京中医药大学药学院,江苏 南京 210023)
肠易激综合征(Irritable bowel syndrome,IBS)是一种以反复发作的腹痛、排便习惯改变和粪便性状异常等为临床表现的胃肠道疾病,根据临床表现分为4种亚型,分别为便秘型、腹泻型、混合型及未定型。IBS的患病率高,病程迁延难愈,严重影响患者的生活质量。IBS的病理生理学机制尚不明确,近年来的研究发现,肠道菌群紊乱及其引起的内源性物质代谢紊乱,尤其是胆汁酸、短链脂肪酸等,与其病程迁延密切相关[1],其中在腹泻型肠易激综合征(Diarrhea-predominant irritable bowel syndrome,IBS-D)患者中,其胃肠道还会伴随着局部的低度炎症以及胃肠道通透性增加、紧密连接蛋白或mRNA表达减少。
胆汁酸(BAs)作为体内内源性的信号分子,它的合成和代谢主要发生在肠道菌群-肠-肝轴。许多疾病都与胆汁酸代谢失调相关,当胆汁酸合成的严格反馈调节受到破坏时,胆汁酸可以影响免疫细胞、肠上皮细胞以及肝实质细胞的正常生理功能[2]。胆汁酸成分可通过在肠上皮细胞中激活法尼酯X受体(FXR),诱导成纤维细胞生长因子-19(FGF-19)的转录,发挥其对脂质代谢、炎症、免疫调节等方面的调控作用。近期的一项临床研究发现[3],约20%的IBS-D患者具有特发性胆汁酸腹泻型的临床表现。提示胆汁酸与IBS,尤其是IBS-D的发病机制密切相关,因此,从胆汁酸代谢轮廓角度评价相关药物的药效、探讨其潜在作用机制[4],已成为目前的研究热点。
在中医理论中,IBS-D相当于中医“泄泻”[5]范畴,病位在于肝脾,久则损及于心。全国名老中医单兆伟在治疗IBS-D方面临床经验颇丰,认为IBS-D当从肝脾心论治,采用疏肝理气、健脾止泄等方法,自拟柴参解郁汤治疗IBS-D患者。药用柴胡10 g,党参15 g,炒白术15 g,炒白芍15 g,防风10 g,茯苓12 g,炒薏苡仁15 g,莲子10 g,合欢皮12 g,炙甘草4 g。诸药合用可补其虚,除其湿,行其滞,调其气和脾胃,则诸症自除。因此,本研究前期研究基础之上[6],采用靶向代谢组学的方法,进一步探究柴参解郁汤对IBS-D模型小鼠粪便胆汁酸代谢轮廓改变的作用,在此基础上探讨柴参解郁汤治疗IBS-D的作用机制。
1 材料
1.1 仪器
SPARK 10M多功能酶标仪(瑞士Tecan公司),AB SCIEX Triple TOFTM 5500质谱仪(美国AB Sciex公司),5200全自动化学发光成像分析系统(瑞士Tecan公司),Micro21R高速冷冻离心机(美国Thermo Fisher公司),CFX Connect实时荧光定量PCR系统(美国Bio-Rad公司)。
1.2 试药
石胆酸(LCA,货号:HE28)、牛磺熊去氧胆酸(TUDCA,货号:FH26)购自上海旭硕生物科技有限公司;甘氨鹅去氧胆酸(GCDCA,货号:Y29M9K57235)、牛磺脱氧胆酸 (TDCA,货号:B26J9J53831)、甘氨猪去氧胆酸(GHDCA,货号:Y23N9K75826)、甘氨熊去氧胆酸(GUDCA,货号:B03D9K76539)购自上海源叶生物科技有限公司;脱氧胆酸(DCA,货号:D1928157)、甘氨胆酸(GCA,货号:J1808126)、熊去氧胆酸(UDCA,货号:E1715044)购自上海阿拉丁生化科技股份有限公司;脱氢胆(Dehydro-CA,货号:C10389731)、猪去氧胆酸(HDCA,货号:C0026119),牛磺胆酸(TCA,货号:C10452445)购自上海麦克林生化科技有限公司,胆酸 CA,货号:MK710311)、鹅去氧胆酸(CDCA,货号:YC711136)购自上海思域化工科技有限公司;甘氨酸脱氧胆酸(GDCA,货号:HW19E1507-2)购于北京华威锐科化工有限公司,α-鼠胆酸 (α-MCA,货号:M732750)、β-鼠胆酸(β-MCA,货号:C1895-000)、牛黄α鼠胆酸(T-α-MCA,货号:HJS-20002)购自Isoreag公司;猪胆酸(HCA,货号:AB0197)购自成都埃尔法生物科技有限公司;牛磺鹅去氧胆酸(TCDCA,货号:B20919)、甘氨石胆酸(GLCA,货号:S27511)、牛磺猪胆酸(THCA,货号:B27364)购自上海源叶生物科技有限公司;熊胆酸(UCA,货号:qy-r002654)购自上海古朵生物科技有限公司;甘氨猪胆酸(GHCA,货号:CY14994)购自上海凯梅根生物科技有限公司。RNA isolater(诺维赞,货号:7E480F0);HiScript®Ⅱ Q RT SuperMix for qPCR (货号:7E451A0)、ChamQTM SYBR®qPCR Master Mix (货号:7E471B0)购自南京诺维赞生物科技股份有限公司;ZO-1(货号:EPR19945-296)购自艾博抗(上海)贸易有限公司;OCCLUDIN(货号:66378-1-lg)购自Proteintech公司。
1.3 动物
健康SPF级C57BL/6小鼠,雌性,36只,体质量18~22 g,由南京市江宁区青龙山动物繁殖场提供,合格证号:SCXK(苏)2019-0002。实验经南京中医药大学动物伦理中心批准(伦理号:202006A034)。
2 方法
2.1 柴参解郁汤的制备
柴参解郁汤中药饮片制备:取柴胡10 g,党参15 g,炒白术15 g,炒白芍15 g,防风10 g,茯苓12 g,炒薏苡仁15 g,莲子10 g,合欢皮12 g,炙甘草4 g,加10倍量蒸馏水浸泡30 min,煎煮1 h,合计2次滤液,采用旋转蒸发仪浓缩至浓度合生药量1 g·mL-1的药液。
2.2 动物模型与分组
为了探究柴参解郁汤对小鼠粪便胆汁酸的影响,我们将36只小鼠适应性喂养1周,随机分为3组:正常组、模型组、柴参解郁汤组,每组12只。建立IBS-D小鼠模型[7],采用束缚性应激(每天2 h,8:00~10:00)2周后,从第3周开始在束缚性应激的基础上复合番泻叶(3 g·kg-1)灌胃诱导IBS-D小鼠模型。同时,从第3周开始,柴参解郁汤组每天灌胃给予柴参解郁汤,给药剂量按人和动物体表面积折算的等效计量计算,换算成小鼠的剂量为15 g·kg-1,正常组和模型组分别饲以等体积的去离子水。
2.3 苏木素-伊红(HE)染色观察空肠组织病理学变化
小鼠造模结束后处死,取空肠部位,在10%中性甲醛固定,石蜡包埋,组织切片后进行HE染色,显微镜下观察空肠组织结构是否完整和组织充血水肿情况,是否有肠道上皮细胞排列紊乱、隐窝损伤、肠道上皮完整性等病理学改变情况。
2.4 Western blot分析空肠中COX-2和iNOS蛋白的表达
取空肠组织约30 mg,加入裂解液,提取蛋白,经变性后,在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上进行分析并转移至PVDP膜中。经封闭后,分别加入iNOS一抗(稀释比例1∶5 000,Abcam)和COX-2一抗(稀释比例1∶2 000,Proteintech),孵育过夜后,加入二抗、洗涤3次后,加入ECL发光液,在化学发光成像系统中进行分析。
2.5 实时荧光定量PCR技术测定紧密连接蛋白的mRNA
取50 mg小鼠空肠组织,按试剂盒说明书提取总RNA,逆转录后用实时荧光定量PCR仪进行检测,具体程序如下:第一步,预变性,1个循环,95 ℃ 30 s;第二步,PCR反应,40个循环,95 ℃ 10 s,58 ℃ 30 s,转录水平通过公式2-ΔΔCt计算。引物序列如表1所示。

表1 引物序列Table 1 The sequences of the primers
2.6 小鼠胃肠道通透性研究
随机从上述各组小鼠中取4只动物进行胃肠道通透性实验,小鼠禁食12 h后,灌胃给予FITC标记的右旋糖苷(分子量4 000,50 mg·kg-1),给药2 h后,取血,3 000 r·min-1离心5 min后,取50 μL上清与PBS溶液1∶1混合后,在酶标仪下检测(激发波长和发射波长分别为485 nm和533 nm)。
2.7 小鼠粪便胆汁酸靶向代谢组学分析
最后一次给药24 h后,取各组小鼠的新鲜粪便,将小鼠粪便冷冻干燥后,研磨均匀,精密称取20 mg,加入380 μL的50%的乙腈,涡旋震荡5 min并在4 ℃下以12 000×g离心10 min。吸取上清40 μL加80 μL含同位素内标的乙腈溶液,涡旋震荡5 min并在4 ℃下以12 000×g离心10 min,吸取上清液进样[8]。色谱条件如下:色谱柱为BDS Hypersil C18(50 mm×2.1 mm,2.4 μm);流动相为乙腈和1 mmol·L-1的甲酸铵水溶液,采用梯度洗脱方式进行,流速为0.30 mL·min-1;柱温:40 ℃,进样量2 μL。质谱条件如下:离子源为ESI源;检测方式:负离子检测;电子能量:70 eV;ESI源温度:255 ℃;色谱质谱接口温度:300 ℃;碰撞气氩气压力:1.5 mTorr(1 mTorr=0.133 Pa)。
2.8 统计学方法
3 结果
3.1 柴参解郁汤对IBS-D模型小鼠的药效评价
3.1.1 对小鼠粪便含水量的影响 与空白组相比,模型组小鼠粪便含水量升高(P<0.01);与模型组比较,柴参解郁汤组能明显降低粪便含水量(P<0.01)。结果见图1。
3.1.2 小鼠空肠组织病理学的改变 与空白组相比,模型组和柴参解郁汤组小鼠的空肠黏膜组织都有不同程度的损伤,其中模型组小鼠损伤最为严重,空肠绒毛大部分脱落坏死,绒毛的固有层细胞溶解,绒毛结构模糊不清;经过柴参解郁汤中药治疗后的小鼠空肠绒毛结构比较完整,排列整齐,层次分明。由图1C可知,IBS-D型小鼠空肠绒毛长度显著低于对照组小鼠空肠绒毛长度(P<0.05)。
3.2 柴参解郁汤对IBS-D模型小鼠胃肠道通透性的影响
3.2.1 柴参解郁汤对FITC-标记的右旋糖苷的影响 检测结果发现,与对照组相比,IBS-D模型小鼠血清中FITC-右旋糖酐含量明显增加(P<0.01),说明该模型小鼠结肠通透性增加,肠上皮黏膜遭到破坏,而给予柴参解郁汤后的小鼠血清中FITC-右旋糖酐含量明显下降(P<0.01)。结果见图2。
3.2.2 柴参解郁汤对2个紧密连接蛋白mRNA的影响 与空白组相比,模型组小鼠中2个紧密连接蛋白ZO-1、OCCLUDIN mRNA表达量明显降低(P<0.01),给予柴参解郁汤治疗后的小鼠结肠中这2种紧密连接蛋白的mRNA含量有所上升(P<0.05,P<0.01),均具有统计学意义。结果见图2。
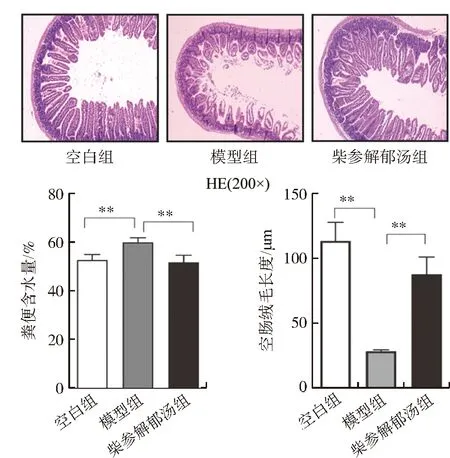
注:与模型组比较,图1 柴参解郁汤对IBS-D小鼠空肠病理损伤、粪便含水量及空肠绒毛长度的影响Fig.1 The effects of Chaishen Jieyu Decoction on pathological changes of mouse jejunum segment,fecal water content and villi length of jejunum
3.2.3 柴参解郁汤对COX-2和iNOS蛋白表达量的影响 与对照组相比,模型组小鼠空肠中COX-2和iNOS的蛋白表达量均明显升高(P<0.05,P<0.01),给予柴参解郁汤治疗后,iNOS的蛋白表达量有所下降,并具有显著性差异(P<0.01)。结果见图3。
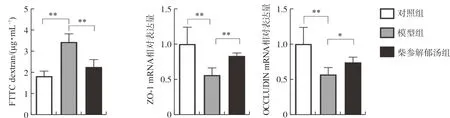
注:与模型组比较,图2 柴参解郁汤对IBS-D小鼠胃肠道通透性及紧密连接蛋白ZO-1、OCCLUDIN mRNA表达的影响Fig.2 The effects of Chaishen Jieyu Decoction on the intestinal permeability and the relative mRNA expressions of main tight junctions proteins ZO-1,OCCLUDIN in mice
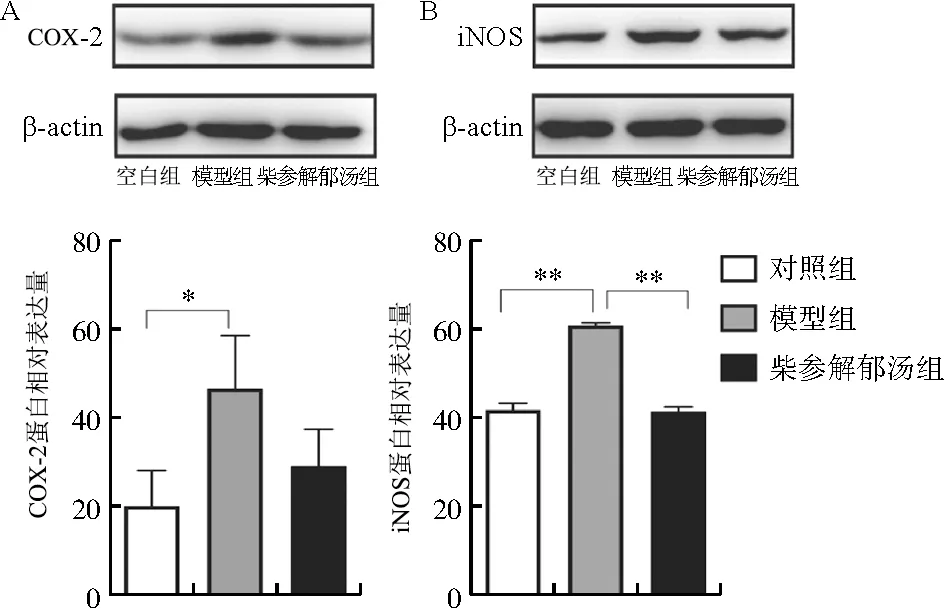
注:与模型组比较,图3 各组小鼠空肠中COX-2、iNOS蛋白的表达情况Fig.3 The relative protein expressions of COX-2 and iNOS in each group
3.3 柴参解郁汤对IBS-D模型小鼠粪便胆汁酸的影响
如图4所示,OPLS-DA和聚类热图主要表示胆汁酸的总体变化,聚类热图显示空白组、模型组和柴参解郁汤组相比,粪便胆汁酸总体成分具有明显差异。OPLS-DA可以从检测到的若干变量值中寻找潜在差异物。如图所示,模型组粪便代谢物与对照组存在显著差异。再通过VIP来筛选代谢物差异性变量。如图所示,空白组、模型组与柴参解郁汤组分别处于不同象限内,呈现明显的聚类特征,表明3组小鼠在代谢物水平上具有一定的差异性。空白组与模型组分离度良好,与模型组相比,柴参解郁汤组体内小分子代谢物发生了显著改变且显示出恢复正常水平的趋势。
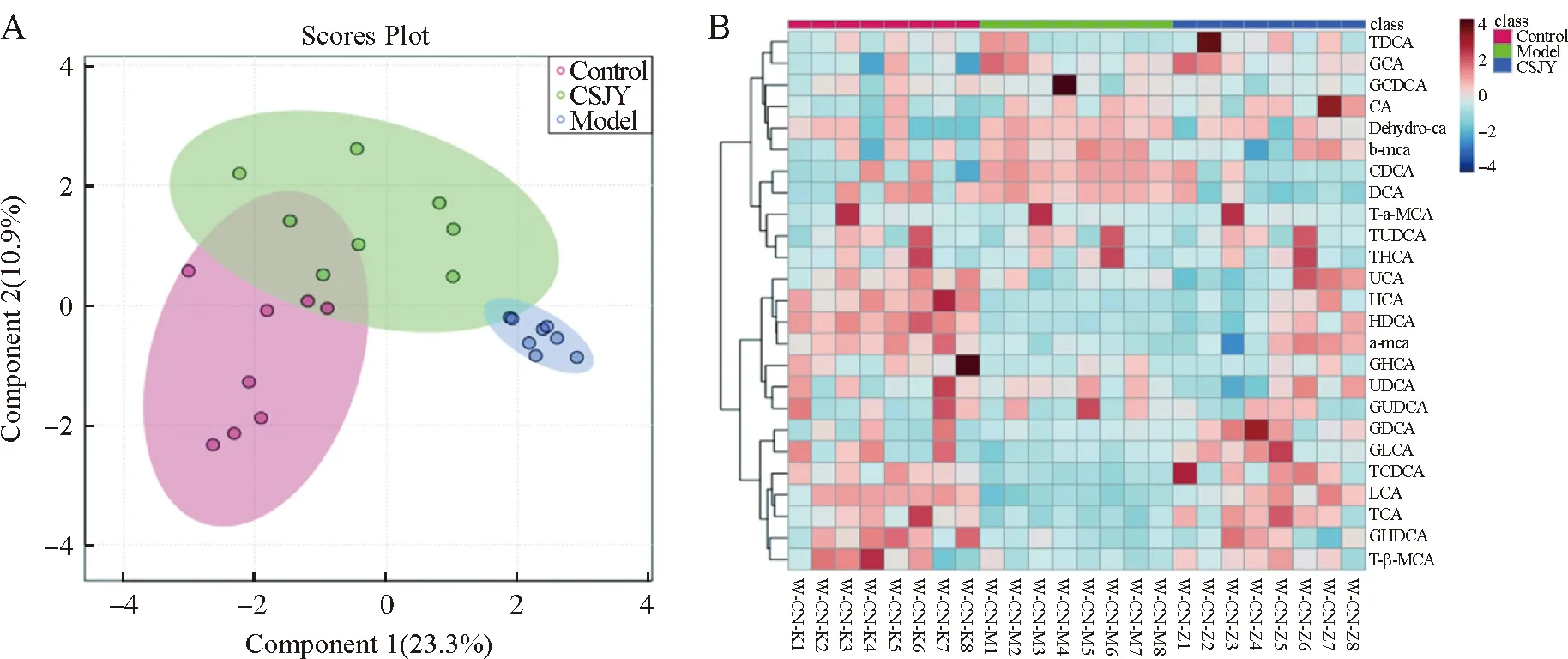
图4 各组小鼠粪便中胆汁酸的的OPLS-DA(A)和聚类热图(B)Fig.4 OPLS-DA score scatter plot (A)and the heatmap (B)of fecal bile acid in different groups
3组小鼠粪便中共检测出25种胆汁酸,对这25种胆汁酸进行单因素方差分析和Tukey'sMultipleComparisonTest检验,筛选不同组间的差异代谢物,具体结果见图5。与空白组相比,模型组中共有13种胆汁酸含量下降,胆汁酸DCA、GHDCA、HDCA、GLCA、GHCA、TCA、TCDCA、α-MCA、T-α-MCA、UCA、THCA、LCA、HCA含量降低,且有统计学差异(P<0.05);与空白组相比,模型组有3种胆汁酸(CDCA、dehydeo-CA、β-MCA)含量上升,有统计学差异(P<0.01)。而柴参解郁汤可以显著下调IBS-D模型小鼠粪便中CDCA、dehydeo-CA、β-MCA胆汁酸的含量(P<0.05,P<0.01),显著增加IBS-D模型组小鼠粪便中DCA、GHDCA、HDCA、GLCA、GHCA、TCA、TCDCA、α-MCA、T-α-MCA、UCA、THCA、LCA、HCA的含量(P<0.05,P<0.01)。
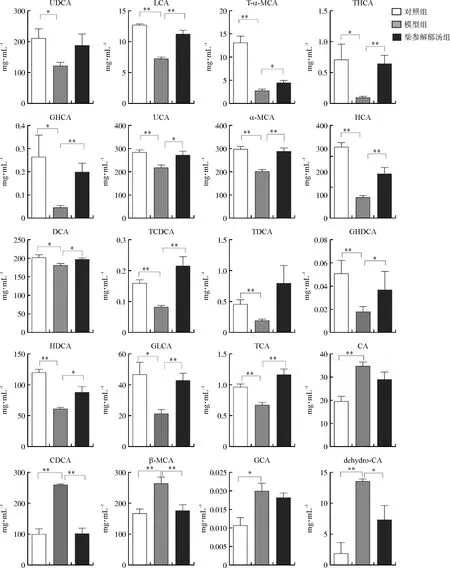
注:与模型组比较,图5 各组小鼠粪便中的差异胆汁酸的绝对定量结果Fig.5 The absolute quantitative results of the changed fecal bile acids in different groups
4 讨论
本实验在束缚性应激的基础上复合番泻叶灌胃2周诱导IBS-D模型,该模型可以很好地模拟小鼠的腹泻及肠道菌群紊乱。研究结果表明,柴参解郁汤可显著降低小鼠腹泻症状,调节肠道通透性,降低小鼠空肠损伤程度。同时基于胆汁酸在IBS-D的疾病迁延进程中的重要作用[9],在小鼠IBS-D模型中,也可以看到模型小鼠出现明显的胆汁酸代谢紊乱,而给予柴参解郁汤后小鼠粪便中的胆汁酸的变化又有一定程度的恢复。
通过对粪便胆汁酸总量或不同类型胆汁酸的分析,发现许多慢性功能性腹泻和IBS-D患者的粪便胆汁酸组成和含量有明显的改变[10]。另有研究表明,IBS患者肠道菌群代谢组与非IBS患者,具有明显的差异,通过粪便代谢组学分析,可以区分患有胆汁酸吸收不良综合征和不患有胆汁酸吸收不良综合征的IBS患者[11]。因为在肠肝循环中,大多胆汁酸经过吸收循环,最终回到肝脏,其中5%的胆汁酸为肠道中细菌生物转化底物,而从初级胆汁酸经肠道微生物代谢形成次级胆汁酸[12]。所以,肠道菌群生态失衡一定程度影响了次级胆汁酸的合成。又因为上皮细胞在结肠内的主要生理作用之一是充当天然屏障抵抗管腔内毒素和病原体,而UDCA和LCA在结肠中发挥着抗炎的作用[4],所以在肠炎小鼠模型中,可以通过补给次级胆汁酸中LCA、DCA、UDCA的含量从而有效减少肠道炎症的发生[4,13]。本次研究结果表明,IBS-D模型小鼠中,UDCA、LCA和UDCA含量明显下降,而经过柴参解郁汤治疗后,3种胆汁酸含量均得到明显上升,故本次实验结果与前期的相关研究结果相吻合。CA和CDCA是小鼠体内的两种初级胆汁酸,而结合型胆汁酸MCA源于CDCA[10],在本次研究结果中,模型小鼠的MCA含量明显下降,而CDCA含量则明显上升,通过这一现象我们可以推测,在IBS-D发病过程中,胆汁酸的转化途径受阻,同时又进一步使得模型小鼠的结合型胆汁酸明显上升。这一研究结果与临床上IBS-D患者粪便中CA和CDCA含量升高相似[14]。
先前的研究表明血清中C4补体升高和FGF19表达的降低是导致胆汁酸排泄过量的主要原因[15],而过量排泄游离胆汁酸则会加重IBS-D患者的腹泻症状[16]。本次实验通过柴参解郁汤的药物治疗后,不仅可以明显缓解模型组中游离性CDCA、DCA含量的升高,还可以缓解结合型胆汁酸TDCA含量的降低,起到保护肠道细胞的作用。与此同时,GCA的含量在给予中药治疗后在一定程度上得到了回升,表明胆汁酸的转化和合成途径趋于正常。
尽管本文报道了柴参解郁汤对IBS-D动物粪便胆汁酸代谢轮廓的调节作用,但有关调控机制尚不明确。胆汁酸是FXR的天然配体,被认为是肠道和肝脏中调节胆汁酸合成和分泌的主要调节器[16]。FXR活化抑制胆汁酸合成,在动脉粥样硬化、炎性肠病和实验性胆汁淤积中具有抗炎作用。在肠道中,胆汁酸的代谢很大程度上又受到肠道菌群的影响,肠道菌群在调控次级胆汁酸方面发挥着重要作用。所以,肠道菌群在通过改变胆汁酸的组成而调节宿主的代谢的过程中具有十分重要的意义[17]。本研究中,柴参解郁汤表现较好的治疗效果,这可能与柴参解郁汤中某些药物成分是FXR的天然激动剂,并涉及多靶点的调控有关。另一方面,柴参解郁汤可能通过恢复模型小鼠的肠道菌群稳态,从而使胆汁酸代谢紊乱得到一定程度的恢复。
本研究用束缚性应激复合番泻叶灌胃诱导IBS-D小鼠模型,在给予小鼠柴参解郁汤灌胃治疗后,小鼠的空肠病理损伤有所改善,肠上皮细胞形态趋于正常。采用靶向代谢组学技术分析给予柴参解郁汤后,IBS-D小鼠粪便胆汁酸代谢轮廓趋于正常小鼠。从单独胆汁酸成分来看,柴参解郁汤可以使小鼠游离型胆汁酸含量降低,从而降低小鼠的腹泻症状[16]。而胆汁酸的稳态可以缓解腹泻这一临床表现,进而修复肠细胞形态和功能,减轻IBS-D症状。在后续的研究中,可采用代谢流分析技术进一步探讨柴参解郁汤对粪便中特定胆汁酸的作用,为柴参解郁汤治疗IBS-D提供更好的理论支持。
