低浓度硝态氮促进微囊藻累积多聚磷酸盐*
2022-05-17郑超群王梦梦杨顺清杨柳燕
陈 成,郑超群,王梦梦,杨顺清,杨柳燕
(南京大学环境学院,污染控制与资源化研究国家重点实验室,南京 210023)
2016年以来太湖水体总磷浓度高位波动而总氮浓度持续下降[1],且伴随着蓝藻水华的大面积暴发[2-4]. 研究显示,自2014年起太湖水体总氮浓度已低于2 mg/L[5-7],尤其在夏季,由于水华蓝藻介导的反硝化作用的存在[8-9],水体总氮浓度最高下降了40.02%[9],蓝藻生长受到氮限制[10],而总磷浓度则在0.08 mg/L左右波动[11],导致全湖水体氮磷比持续下降[12]. 关于2016年后太湖总磷浓度升高的原因,研究人员提出了多种假设,其中内源性磷释放被认为是最重要的磷来源. 水华蓝藻从沉积物中泵吸磷[13],使太湖水体中水华蓝藻密度与湖体总磷[4]、颗粒态磷[11]和溶解态磷浓度[3]均呈现正相关. 蓝藻衰亡后将吸收的磷释放到湖水中,这一过程是太湖总磷浓度维持较高水平的原因所在[13].
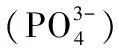
通常而言,生物细胞中PolyP含量维持在较低水平[16],而当细胞处于各种不利环境时,PolyP出现累积现象,使生物能适应应激环境. 目前已明确的胁迫条件包括:1)营养元素匮乏. Aksoy等[24]对莱茵衣藻(Chlamydomonasreinhardtii)的研究发现,在硫缺乏条件下,莱茵衣藻胞内酸性钙体含量明显增多,同时负责编码多聚磷酸盐聚合酶(polyphosphate polymerase)的相关基因表达显著上调,表明PolyP在细胞适应不利环境中发挥重要作用. 2)氧化应激. 次氯酸钠和双氧水处理使大肠杆菌在短时间内合成大量PolyP,研究者认为PolyP作为一种分子伴侣与细胞内具有重要功能的蛋白质结合,防止其变性[16]. 3) 藻类生长处于稳定期. 研究发现处于稳定期的莱茵衣藻细胞内有PolyP增多的现象[25-26],但目前仍不清楚PolyP增多的原因是与营养元素缺乏有关,还是与细胞受到其他胁迫有关. 4)重金属离子中毒. 当生物处于重金属离子或过量微量元素离子环境中时,其体内将合成大量PolyP,作为螯合剂与金属离子结合,以降低重金属离子毒性,PolyP含量与细胞对阳离子毒性的耐受程度存在显著正相关[27],在重金属离子中毒的莱茵衣藻体内就能观测到大量与重金属离子结合的PolyP储存在酸性钙体内[28]. 藻类通过吸收磷酸盐在胞内合成PolyP,提高了藻类细胞内磷含量,而当藻类衰亡时,大量磷被释放到水体中,导致水体总磷浓度提升.
湖泊水体蓝藻生长主要胁迫因子包括营养盐缺乏、氧化胁迫以及藻类生长处于稳定期等. 研究显示,在浅水湖泊中由于氮素自净作用的增强,蓝藻生长受到氮限制[29]. 同时,湖泊水体总氮中一般以硝态氮为主,由于反硝化作用使硝态氮被大量还原为氮气[30],水华蓝藻的生长进一步受到低氮浓度的限制. 低硝态氮作为一种胁迫因子对蓝藻吸收磷和合成多聚磷酸盐的影响以及其生理机制有待深入研究. 因此,本研究采用太湖野外水华蓝藻和纯铜绿微囊藻(Microcystisaeruginosa)进行低硝态氮浓度室内培养,测定其细胞内各种形态磷含量和生理生化指标,探索其累积多聚磷酸盐的过程和机制,有助于探明太湖近期总磷浓度高位波动的原因.
1 材料与方法
1.1 蓝藻及其培养
野外水华蓝藻采自太湖,于24 h内送至实验室进行试验,水华蓝藻中微囊藻占藻类总细胞量的80%以上;铜绿微囊藻来自本实验室,在(25±1)℃、光照强度30 μmol photons/(m2·s)、光照周期10 L∶14 D的条件下,采用BG-11培养基培养[31].
所有试验藻液先在无氮磷的BG-11培养基中进行3 d的饥饿培养. 随后以不同硝态氮浓度的BG-11培养基(硝态氮浓度分别为0、2、10、60和120 mg/L)培养野外水华蓝藻或铜绿微囊藻,作为实验组;使用完全营养的BG-11培养基(含硝态氮250 mg/L)培养野外水华蓝藻或铜绿微囊藻作为对照组. 实验组和对照组均设置3个平行. 在实验处理30 h后,取实验组及对照组藻液,测定各项指标.
1.2 藻细胞生物量测定
野外水华蓝藻及铜绿微囊藻生物量分别采用每升藻液中藻细胞干重表征[32].
1.3 蓝藻中各形态磷含量测定
取1 mL水华蓝藻或铜绿微囊藻藻液,加0.8 mL 5%过硫酸钾溶液于121℃消解,消解液采用钼锑抗分光光度法测定磷含量[33],并计算藻细胞胞内总磷(CTP)含量. 取3 mL藻液,使用1.5 mL 10%的三氯乙酸溶液抽提藻细胞内磷酸盐,提取液采用钼锑抗分光光度法测定磷含量,并计算藻中磷酸盐磷(Pi-P)含量.
目前广泛使用DAPI染色法定量测定细胞内PolyP含量[34],然而该方法应用于光合生物中具有一定的局限性[35]. 因此,本研究采用碱性次氯酸钠溶液抽提胞内PolyP,水解后采用钼锑抗分光光度法测定多聚磷酸盐磷(PolyP-P)含量[32].
1.4 铜绿微囊藻多聚磷酸盐颗粒电镜观察
取10 mL铜绿微囊藻培养液离心浓缩,重悬于1 mL 电镜固定液中,室温放置2 h后于4℃固定保存及运输,送至武汉塞维尔生物科技有限公司(武汉,中国)进行电镜观察. 采用透射电镜观察铜绿微囊藻胞内多聚磷酸盐颗粒位点及数量特征[26].
1.5 铜绿微囊藻生理生化活性测定
通过叶绿素荧光变化表征铜绿微囊藻的光合活性[36],用Water-PAM Ⅱ 藻类叶绿素荧光仪(WALZ,Germany)测定其叶绿素荧光参数. 超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、总蛋白(total protein)含量和热休克蛋白(HSP)含量均使用商业试剂盒(南京建成生物工程研究所,南京,中国)测定,操作方法分别见其说明书.
2 结果
2.1 低浓度硝态氮对水华蓝藻吸收磷的影响
在不同硝态氮浓度下培养太湖野外水华蓝藻,测定水华蓝藻各形态磷含量变化趋势. 结果显示,在不同硝态氮浓度下培养30 h后,水华蓝藻生物量并未发生显著变化(图1A),仍与初始生物量(0.40 g/L)相当,表明在此期间水华蓝藻并无显著的生长或衰亡,处于迟滞期. 但与对照组相比,当培养基中硝态氮浓度低于2 mg/L时,单位干重水华蓝藻中磷含量显著增加(P<0.05). 其中,当培养基中硝态氮浓度下降为2 mg/L,水华蓝藻细胞内CTP和PolyP-P含量分别为(0.35 ± 0.08)和(0.07 ± 0.02) mg/g,显著高于对照组水华蓝藻细胞内相应形态磷含量(P<0.05,图1B、D). 同时,处于缺氮培养(硝态氮浓度为0 mg/L)时水华蓝藻CTP、Pi-P以及PolyP-P含量分别为(0.35±0.02)、(0.23±0.03)和(0.09±0.003) mg/g,也显著高于对照组水华蓝藻相应形态磷含量(P<0.05,图1B、C、D). 综上可知,在低硝态氮浓度下,水华蓝藻过量吸收磷并累积PolyP.
2.2 低浓度硝态氮对铜绿微囊藻吸收磷的影响
从太湖采集的水华蓝藻以微囊藻属为主,因此,以铜绿微囊藻为模式生物进行研究,测定了不同硝态氮浓度下铜绿微囊藻细胞内CTP、Pi-P以及PolyP-P含量,结果如图2所示. 低硝态氮浓度(0及2 mg/L硝态氮)下,铜绿微囊藻生物量与初始接种量相比(50 mg/L)无显著差异;而与对照组相比,当氮浓度降至10、2及0 mg/L时,微囊藻生物量显著低于250 mg/L硝态氮浓度下(P<0.05),分别为对照组的77.4%、53.1%和42.3%,低硝态氮培养液中铜绿微囊藻生长受到抑制. 同时,随着培养液中初始硝态氮浓度下降,铜绿微囊藻细胞内CTP和Pi-P含量均显著升高(P<0.05),特别是当硝态氮浓度低于2 mg/L时,铜绿微囊藻细胞内PolyP-P含量较对照组显著累积(P<0.05),其结果与太湖水华蓝藻吸收磷的趋势一致. 比较图1和图2可看出,在低浓度硝态氮条件下,铜绿微囊藻和太湖水华蓝藻细胞内CTP、Pi-P及PolyP-P的绝对含量存在较大的差异,太湖水华蓝藻各种形态磷含量可达到纯铜绿微囊藻的20~50倍.
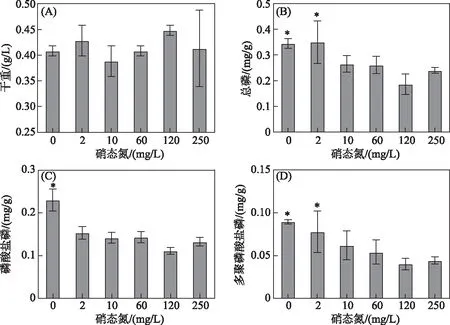
图1 不同硝态氮浓度对水华蓝藻干重(A)以及胞内总磷(B)、磷酸盐磷(C)和多聚磷酸盐磷(D) 含量的影响(平均值±标准差,n=3. *表示实验组与对照组间存在显著差异(P<0.05))Fig.1 Effect of different nitrate-nitrogen concentrations on the dry weight (A) and the total phosphorus (B), phosphate-phosphorus (C) and polyphosphate-phosphorus (D) contents in cells of blooming cyanobacteria (mean ± standard deviation,n=3. * indicates a significant difference with P<0.05 between the experimental and control groups)
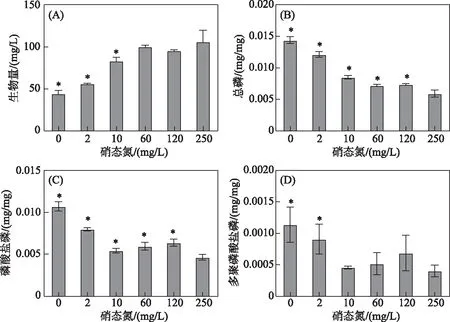
图2 不同硝态氮浓度对铜绿微囊藻生物量(A)以及胞内总磷(B)、磷酸盐磷(C)和多聚磷酸盐磷(D) 含量的影响(平均值±标准差,n=3. *表示实验组与对照组间存在显著差异(P<0.05))Fig.2 Effect of different nitrate-nitrogen concentrations on the biomass (A)and the total phosphorus (B), phosphate-phosphorus (C) and polyphosphate-phosphorus (D) contents in cells of Microcystis aeruginosa (mean ± standard deviation, n=3. * indicates a significant difference with P<0.05 between the experimental and control groups)
不同生长状态的铜绿微囊藻细胞超微结构电镜观察结果显示,缺氮条件(硝态氮浓度为0 mg/L)培养的铜绿微囊藻细胞内酸性钙体数量高于对照组(图3). 而酸性钙体是单细胞生物储存PolyP的主要场所[37],因此,低硝态氮时铜绿微囊藻细胞倾向于累积PolyP.

图3 缺氮培养条件下铜绿微囊藻细胞内酸性钙体透射电镜图片 (图中箭头指示黑色颗粒为酸性钙体. A:缺氮培养组(硝态氮浓度为0 mg/L);B:对照组 (硝态氮浓度为250 mg/L). 1:分裂细胞;2:完整细胞;3:凋亡细胞. 放大倍率为10000倍)Fig.3 Acidocalcisomes in Microcystis aeruginosa under no nitrate nitrogen condition (The black particles are acidocalcisomes. A: the nitrogen-deficient culture group (nitrate-nitrogen concentration is 0 mg/L); B: the control group (nitrate-nitrogen concentration is 250 mg/L). 1: a dividing cell; 2: an intact cell; 3: an apoptotic cell. Magnification was 10000×)
2.3 不同硝态氮浓度下铜绿微囊藻生理生化响应
为了探究低硝态氮浓度下蓝藻吸磷并累积PolyP的生理机制,采用纯铜绿微囊藻为实验对象,测定不同硝态氮浓度下其光合活性及抗氧化酶系统活性.
2.3.1 低浓度硝态氮对微囊藻光合作用活性的影响 叶绿素荧光分析技术广泛应用于蓝藻光合系统生理状态的研究[36]. 如图4所示,铜绿微囊藻在低硝态氮浓度(硝态氮浓度为2 mg/L)或无氮素环境中生长时,其PSⅡ最大光化学量子产量(Fv/Fm)、PSⅡ实际光合量子产量(Yield)以及PSⅡ最大电子传递速率(ERT)均显著低于对照组(P<0.05). 然而,即使培养基缺氮(即硝态氮浓度为0 mg/L),铜绿微囊藻的光合荧光参数(Fv/Fm、Yield和ERT)仍能够达到对照组的88.7%、87.1%和75.1%,因此,在低氮环境培养初期,铜绿微囊藻仍然维持着较高的光合作用强度[31,38-39].

图4 不同硝态氮浓度下铜绿微囊藻的光合作用活性:(A) PSⅡ最大光化学量子产量(Fv/Fm); (B) PSⅡ实际光合量子产量(Yield);(C) PSⅡ最大电子传递速率(ERT) (平均值±标准差,n=3. *表示实验组与对照组间存在显著差异(P<0.05))Fig.4 Photosynthetic activity of Microcystis aeruginosa under different nitrate-nitrogen concentrations: (A) Maximum photochemical quantum yield of PSⅡ (Fv/Fm); (B) Actual photosynthetic quantum yield of PSⅡ (Yield); (C) Maximum electron transfer rate (ERT) of PS II (mean ± standard deviation, n = 3. * indicates a significant difference with P<0.05 between the experimental and control groups)
2.3.2 低浓度硝态氮对微囊藻总蛋白含量及抗氧化酶活性的影响 营养盐缺乏会影响生物合成蛋白质,如图5A所示,当铜绿微囊藻胞外硝态氮浓度降低到60 mg/L时,藻细胞内总蛋白含量为0.6 mg/mg,仅为对照组的50%,含量显著下降(P<0.05). 在低浓度硝态氮条件下细胞中总蛋白含量下降导致铜绿微囊藻生长受阻,培养液中藻类生物量就低(图2A). 由于氮元素是构成蛋白质分子的主要成分,因此,当培养液中氮素浓度下降时,藻细胞内合成的蛋白含量必将减少.
当铜绿微囊藻细胞未受到氧化胁迫时,其SOD、CAT活性及HSP含量均处于较低水平,当铜绿微囊藻处于低氮胁迫时,其胞内氧化应激酶系统被激活(图5B、C、D). 处于缺氮条件下藻细胞体内SOD和CAT活性分别为对照组的4.9和3.6倍,酶活性显著增强(P<0.05). 同时,在高硝态氮浓度实验组藻细胞体内未检出HSP,而当培养液中硝态氮浓度降低到10 mg/L以下时,细胞内HSP含量急剧增加,微囊藻细胞内HSP含量从硝态氮浓度为2 mg/L时的0.19 ng/μg上升到无硝态氮培养中的0.80 ng/μg. 因此,低硝态氮浓度导致微囊藻处于氧化胁迫状态.

图5 不同硝态氮浓度对铜绿微囊藻总蛋白含量、抗氧化酶活性及热休克蛋白含量的影响: (A) 总蛋白;(B) 超氧化物歧化酶(SOD);(C) 过氧化氢酶(CAT);(D) 热休克蛋白(HSP) (平均值±标准差,n=3. *表示实验组与对照组间存在显著差异(P<0.05))Fig.5 Effects of different nitrate-nitrogen concentrations on the total protein content, antioxidant enzyme activity and HSP content in Microcystis aeruginosa: (A) total protein; (B) superoxide dismutase (SOD); (C) catalase (CAT); (D) heat shock protein (HSP)(mean ± standard deviation, n=3. * indicates a significant difference with P<0.05 between the experimental and control groups)
3 讨论
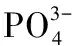
那么铜绿微囊藻在低硝态氮条件下累积PolyP的原因是什么?实验结果显示,虽然不利的环境条件会在一定程度上抑制铜绿微囊藻光合作用的活性[42-44],但在培养初期铜绿微囊藻仍维持着较高的光合活性,其各叶绿素荧光参数仍能够达到对照组的75.1%~88.7%(图4),表明蓝藻光合电子传递速率、光合量子产量还保持在较高水平[38]. 碳、氮的同化是光反应产生还原力的重要去向,然而在低浓度硝态氮培养液中,铜绿微囊藻的碳、氮同化速率均显著降低[38-39],因此,还原力更多流向O2,从而产生大量活性氧(ROS)[38-39],使细胞处于氧化应激状态. 已有研究发现,当藻类处于不利环境中,藻细胞就会累积大量ROS,并作为调控信号,以改变藻细胞的生物学过程,使其适应胁迫环境[45]. 本研究发现,在低硝态氮浓度下,铜绿微囊藻体内SOD和CAT活性显著上升(图5B、C),用于清除细胞内过量的ROS,减轻细胞损伤[46],有利于细胞生存. 同时,含量增加的HSP被认为是细胞受到氧化胁迫的生物标志物[47],在本研究中,当铜绿微囊藻胞外硝态氮浓度降低到2 mg/L以下时,铜绿微囊藻细胞内可检测到HSP的存在(图5D),进一步表明铜绿微囊藻在该条件下已受到氧化胁迫. 研究表明,在氧化胁迫条件下大肠杆菌细胞内合成大量PolyP以防止其胞内蛋白质受损[16]. 由此推测低浓度硝态氮引起的氧化应激反应促进了铜绿微囊藻细胞内PolyP累积.
蓝藻细胞内蛋白质中氮含量平均可达16%,随着培养基中可利用氮浓度下降,蛋白质合成原料减少,导致铜绿微囊藻细胞内总蛋白含量显著降低(图5A),因此,此时微囊藻胞内蛋白数量少,又出现氧化损伤,从而对铜绿微囊藻的生长产生不利影响. 我们发现,缺氮条件下培养的铜绿微囊藻胞内大量的PolyP颗粒在细胞光合片层周围累积(图3),其原因可能是光合片层周边ROS浓度更高,导致原生质中该区域蛋白质受氧化损伤更严重,因此PolyP在该区域聚集以防止蛋白质失活. 早在1974年Jensen等[48]就观测到蓝藻细胞中PolyP与核糖体、类囊体等细胞结构结合,其原因可能与蛋白质的合成有关. 大量研究发现,在蛋白质折叠及氧化应激反应中PolyP起到了类似分子伴侣的作用,PolyP可作为蛋白质稳定支架,结合蛋白质解折叠中间体并将其稳定在富含可溶性β- 折叠的构象中,从而防止蛋白质因氧化胁迫、高温等条件造成的失活[49];当外界不利条件消失时,与PolyP结合的蛋白质又可在折叠酶的作用下恢复其原有结构及活性[50]. 在本研究中,低浓度硝态氮一方面导致铜绿微囊藻缺少合成蛋白质的原料,另一方面诱导细胞产生氧化损伤而造成蛋白质面临失活的风险,故其细胞内累积PolyP以减轻蛋白质的损伤,是一种对胞内蛋白质的保护机制.
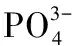
低硝态氮条件下,水华蓝藻生物量并未发生显著变化,藻类生长处于迟滞期,但胞内总磷、磷酸盐及PolyP含量均显著上升(图1),当细胞内含有大量磷的蓝藻进入衰亡期后,其“奢侈”吸收的磷被释放到水体中,从而造成水体总磷浓度上升. 研究发现,水华藻团发生堆积腐解后,其体内营养盐释放将导致上覆水中总磷浓度升高,磷释放量随藻密度的增加而增大,且黑暗等环境条件会加速这一过程[32,53]. 同时,太湖水华蓝藻的磷释放潜能具有季节差异性,夏季蓝藻具有最高的磷吸收潜能,而秋、冬季蓝藻具有最高的磷释放潜能[54],本研究能很好地解释这一现象,夏季由于高温反硝化作用增强导致太湖水体总氮浓度下降,从而促使水华蓝藻过量吸收磷酸盐并储存在细胞内,而到秋、冬季,水华蓝藻衰亡,导致大量的磷酸盐释放到湖体中. 因此,在低氮条件下蓝藻“奢侈”吸磷,并在其衰亡后将过量磷释放到水体中,从而导致太湖水体总氮下降时总磷浓度仍然处于高位波动状态.
4 结论
1)当胞外硝态氮浓度为2 mg/L及以下时,水华蓝藻及纯铜绿微囊藻能过量吸收磷酸盐,并在细胞内累积PolyP.
2)在低硝态氮培养液中,铜绿微囊藻碳、氮同化速率降低的同时,仍具有较高的光活性,导致其胞内ROS大量累积,使细胞处于氧化应激状态. 一方面,铜绿微囊藻通过增强细胞抗氧化酶系统活性抵御氧化损伤;另一方面,作为氧化胁迫的应答,合成PolyP,保护细胞内蛋白质等免受损伤,从而导致蓝藻“奢侈”吸磷.
