食管鳞癌组织MTA1、TAK1和TRAF6的表达水平与患者临床病理特征及预后的关系
2022-05-16高雪峰张锐余旭辉余力
高雪峰 张锐 余旭辉 余力
由于不良饮食和生活习惯等因素,导致我国食管癌发病率逐年升高,根据2019年国家癌症中心数据显示食管癌发病率位居恶性肿瘤第六位,而死亡率则位居第五位[1]。我国食管癌多为食管鳞癌,其早期症状不明显致使许多患者病情延误,而晚期食管鳞癌由于无法手术切除、远处转移等因素导致患者生存质量和5年存活率均较低[2]。目前除传统放、化疗外靶向治疗和生物免疫治疗在食管鳞癌的治疗中发挥重要作用,但患者存活率并无明显提高[3]。近年来研究发现肿瘤转移相关因子1(metastasis associated protein 1,MTA1)的高表达能够促进肿瘤血管生成,增强肿瘤细胞侵袭能力,在许多肿瘤中表达异常增高[4];转化生子因子激活激酶1(transforming growth factor-activated kinase 1,TAK1)属于蛋白激酶MAP3Ks家族成员,能够被多种炎性细胞因子激活参与NF-κB通路的调节,发挥促进肿瘤生长的作用[5];而肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)通过调控JAK2/STAT3通路和NF-κB通路发挥促肿瘤的作用[6]。但MTA1、TAK1和TRAF6在食管鳞癌中的表达水平及意义尚不完全明确,因此本研究通过检测三者在食管鳞癌中的表达水平并分析其与患者临床病理特征和预后的关系,旨在为食管鳞癌的诊断、治疗和预后评估提供相关依据。
1 资料与方法
1.1 一般资料 筛选2016年3月至2018年3月于我院普外科行食管癌切除术的107例食管鳞癌患者肿瘤组织及癌旁组织(肿瘤组织边缘>2 cm的组织),其中男77例,女30例,平均年龄(58.19±8.33)岁;TNM分期Ⅰ/Ⅱ期患者61例,Ⅲ/Ⅳ期患者46例;未合并淋巴结转移患者58例,合并淋巴结转移患者49例。患者及家属均签署对研究知情同意书,本研究经医院伦理委员会审核并批准。
1.2 纳排与排除标准
1.2.1 纳入标准:①患者均为初诊食管鳞癌,术前未接受放、化疗,靶向治疗及生物免疫治疗;②患者术中病理及细胞学检查明确诊断为食管鳞癌,诊断依据《食管癌诊疗规范(2018版)》[7];③患者临床资料完整,无丢失或遗漏;④患者未合并其他恶性肿瘤、自身免疫性疾病和精神神经疾病等。
1.2.2 排除标准:①患者术前接受过放、化疗,靶向治疗及生物免疫治疗;②患者术中病理诊断非食管鳞癌或食管良性病变;③患者临床病理资料缺失或遗漏。
1.3 方法
1.3.1 试剂与耗材:MTA1、TAK1、TRAF6兔抗人单克隆抗体均购自美国CST公司,免疫组织化学法试剂盒及苏木精染色液、二氨基联苯胺(Diaminobenzidine,DBA)、磷酸盐缓冲液(phosphate buffer salin,PBS)、免疫组化抗原修复液等均购自美国Thermo Fisher公司,复合光学显微镜购自德国徕卡公司。
1.3.2 免疫组织化学法检测MTA1、TAK1、TRAF6表达情况:MTA1、TAK1、TRAF6抗体均按照1∶100比例进行稀释,患者肿瘤组织及癌旁组织标本采用4%多聚甲醛固定,脱水包埋获取石蜡标本,组织切片机切片后经烤片、脱蜡、水化等步骤,滴加抗原修复液微波15 min 修复抗原,严格按照试剂盒中说明书所示步骤进行操作。参照染色强度记分:无染色记0分、浅黄色记1分、棕黄色记2分、深棕色记3分。再参照阳性细胞密度打分:高表达细胞≤25%记 1分,26%~50% 记2分,>50% 记3分。依据文献描述[8-10]将上述两项评分相乘获得结果,结果≤3分为阴性表达,>4分为阳性表达。
1.4 统计学分析 应用SPSS 22.0统计软件,Graphpad Prism 7.0软件制作图表。计数资料采用χ2检验,采用Kaplan-Meier生存曲线比较患者36个月生存情况,P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤及癌旁组织中MTA1、TAK1、TRAF6表达情况 免疫组化结果显示MTA1、TAK1、TRAF6在肿瘤组织中阳性率为74.77%、79.44%、68.22%,而癌旁组织中阳性率为29.91%、24.29%、34.58%,差异有统计学意义(P<0.01)。见表1。
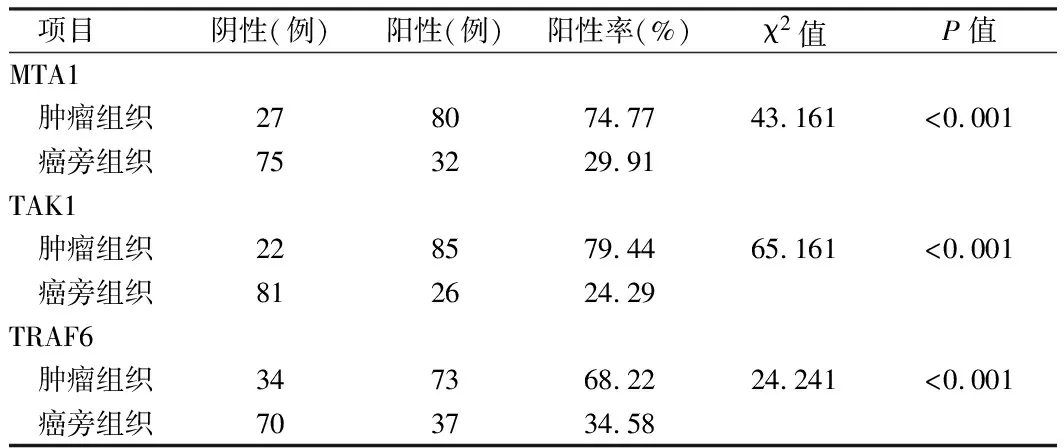
表1 肿瘤及癌旁组织MTA1、TAK1、TRAF6表达情况 n=107
2.2 肿瘤组织MTA1、TAK1、TRAF6表达情况与患者临床病理特征的关系 将肿瘤组织MTA1、TAK1、TRAF6表达与患者临床病理特征比较,MTA1、TAK1、TRAF6与患者性别、年龄无关(P>0.05),但与肿瘤临床分期、肿瘤分化程度、肿瘤浸润深度、是否合并淋巴结转移及肿瘤大小相关(P<0.05)。见表2~4。

表2 组织MTA1与患者临床病理特征的关系 例
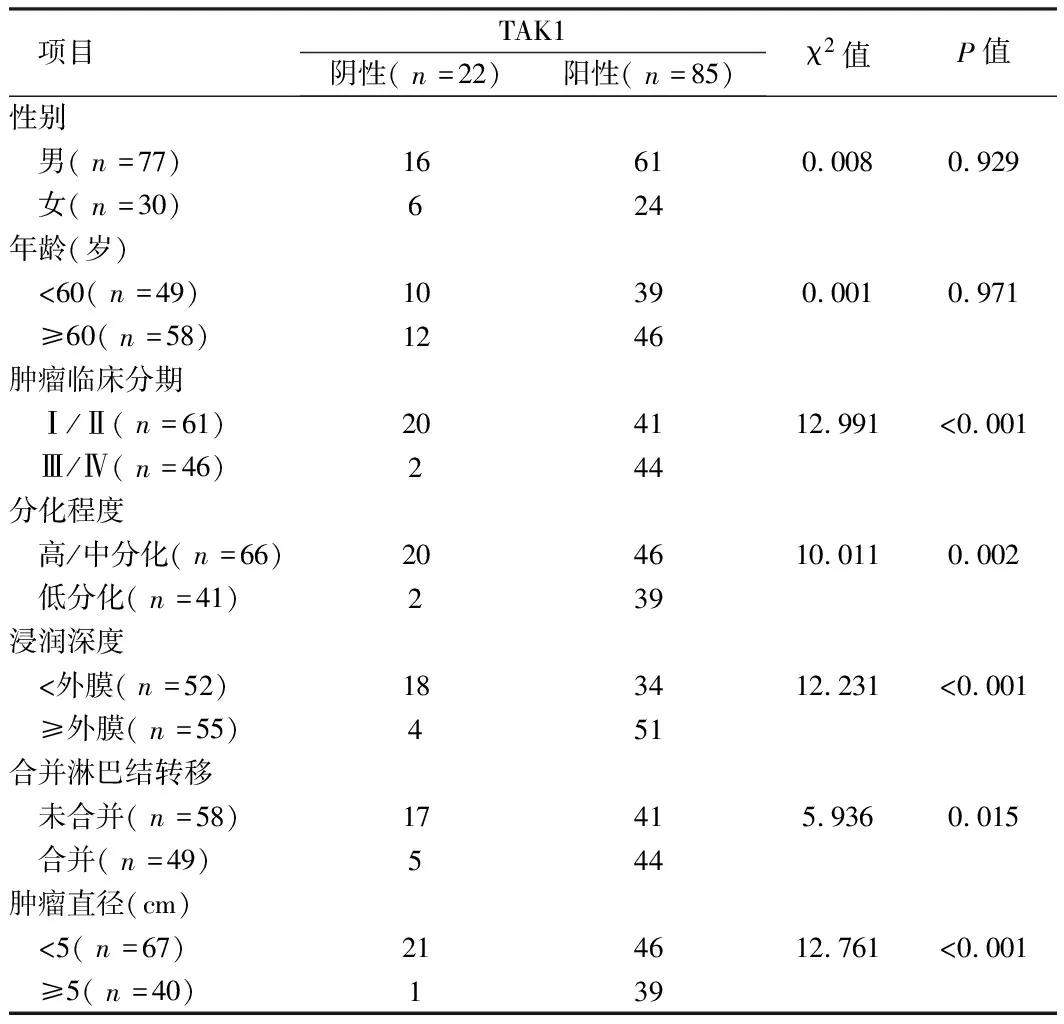
表3 组织TAK1与患者临床病理特征的关系 例
2.3 组织MTA1、TAK1、TRAF6表达情况与患者预后的关系 对患者采用微信、电话、门诊复查等方式进行随访,随访间隔3个月,随访患者死亡或随访时间截至2021年3月,共36个月。107例食管鳞癌患者存活60例,死亡45例,失访2例,死亡患者均死于食管鳞癌复发、进展或相关并发症,未发现死于其他疾病的案例。Kaplan-Meier生存曲线分析结果显示,食管鳞癌组织中MTA1、TAK1、TRAF6阳性表达患者3年生存率明显低于阴性表达患者,差异有统计学意义(P<0.05)。见图1。
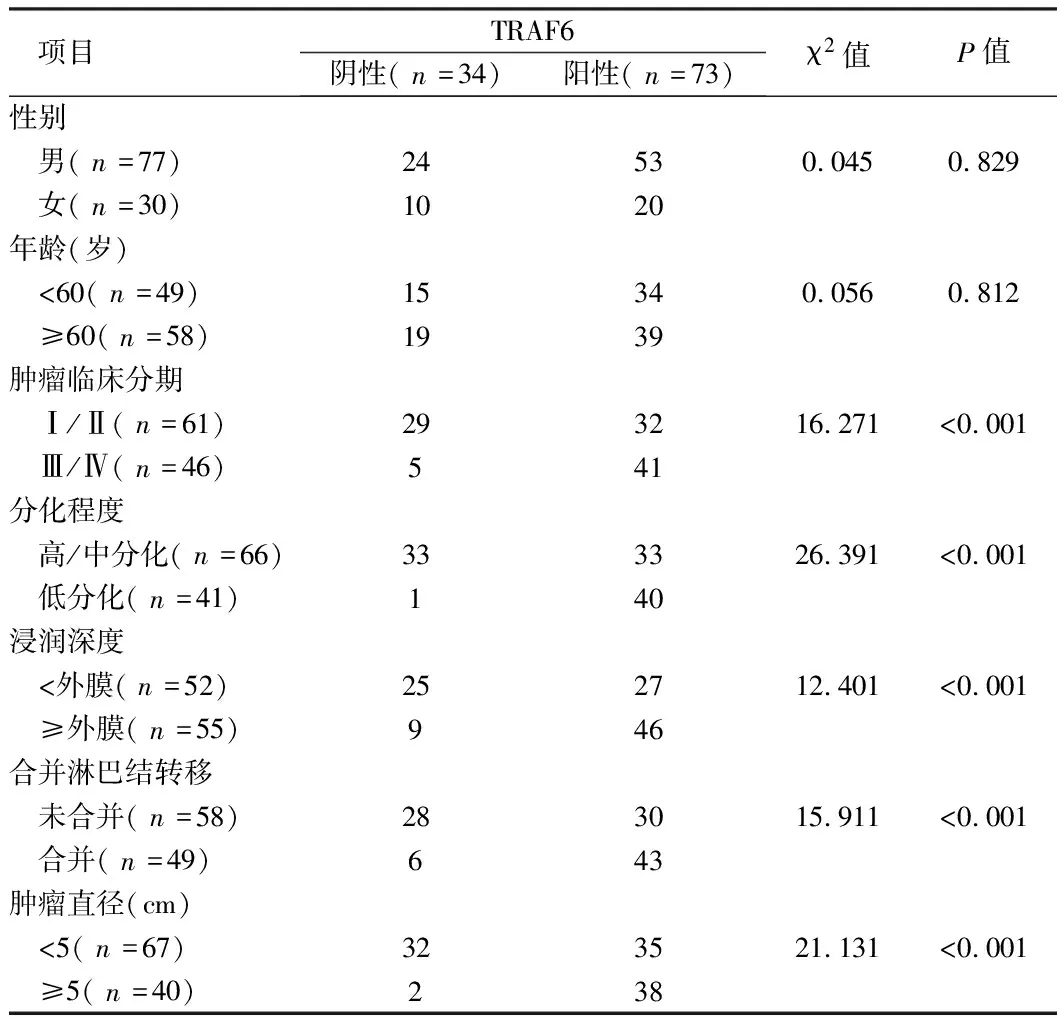
表4 组织TRAF6与患者临床病理特征的关系 例
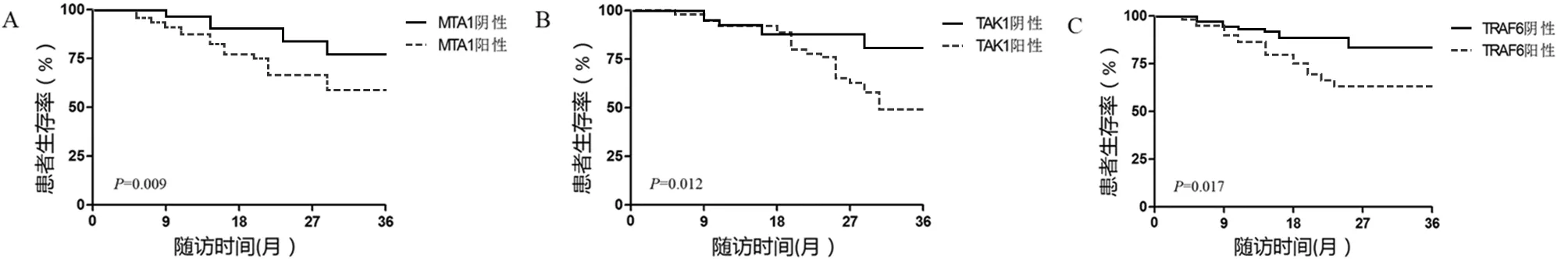
图1 食管鳞癌组织中MTA1、TAK1、TRAF6表达情况与患者生存率的关系;A 食管鳞癌组织中MTA1与患者生存率的关系;B 食管鳞癌组织中TAK1与患者生存率的关系;C 食管鳞癌组织中TRAF6与患者生存率的关系
3 讨论
食管鳞癌是我国食管癌最常见的病理学类型,由于其早期诊断较为困难常导致患者预后不良的发生,研究表明我国食管鳞癌患者5年生存率低于40%[11]。研究表明食管鳞癌是一种多基因、多环节、多因素共同作用形成的恶性肿瘤,改善食管鳞癌患者预后、延长患者生存时间、提高患者生活质量是目前急需解决的重要问题[12],故需要寻找与食管癌预后相关的分子靶点在食管鳞癌的诊断及治疗中具有重大意义。
本研究采用免疫组化法检测食管鳞癌组织中MTA1、TAK1、TRAF6表达情况,发现三者在肿瘤组织中阳性表达率明显高于癌旁组织,且MTA1、TAK1、TRAF6阳性表达均与患者肿瘤临床分期、肿瘤分化程度、肿瘤浸润深度、是否合并淋巴结转移及肿瘤大小相关,提示MTA1、TAK1、TRAF6促进了食管鳞癌的发生发展,并为肿瘤的淋巴结转移创造了条件。肿瘤组织中MTA1、TAK1、TRAF6阳性表达的患者3年生存率低于阴性表达患者,提示三者在组织中表达情况能够作为反映食管鳞癌患者预后的相关指标发挥作用。
MTA1得名于其基因表达水平能够促进乳腺癌细胞侵袭和转移,其也在肝癌、喉癌、前列腺癌等肿瘤中表达异常升高,常预示患者预后不良的发生。王海清等[13]研究表明MTA1在子宫颈鳞癌组织中的表达水平明显高于正常组织和上皮内病变组织,且与肿瘤浸润深度和肿瘤分期相关,MTA1高表达的宫颈癌患者常伴随预后不佳。研究发现MTA1能够通过Wnt通路和Akt通路调控肿瘤的生长,促进肿瘤细胞增殖和肿瘤微血管形成,还能够通过调控CDK8水平加速肿瘤细胞周期的运行,增强肿瘤细胞的侵袭能力[14],与本研究结果一致。TAK1是MAP3K家族成员之一,能够被炎性因子激活参与肿瘤生长的调控,TAK1能够激活NF-kB通路和MAPK通路介导多种肿瘤的发生发展[15]。研究发现食管癌患者组织中TAK1及其下游蛋白TAB1水平异常升高,且高表达患者5年生存率明显降低[16]。TAK1与TAB家族蛋白结合后能够抑制细胞凋亡的作用,同时促进细胞周期的进行,促进肿瘤细胞增殖和转移,特异性敲低TAK1表达水平后发现肿瘤凋亡增加,且肿瘤细胞发生G1/S期阻滞[17],提示TAK1可能成为肿瘤治疗的心靶点发挥作用。TRAF6/TAK1通路在机体免疫过程中发挥重要作用,通过激活NF-kB和MAPK通路介导白介素6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎性因子的表达,促进肿瘤的发生[18]。TRAF6还能够促进AKT蛋白磷酸化和调控致癌基因Ras的表达促进肿瘤发生发展,Ras作为TRAF6的下游靶点增强了肿瘤细胞的侵袭能力和生长能力,体外实验敲除TRAF6后能够阻止肿瘤细胞的生长和增殖[19],但动物实验表明完全抑制TRAF6的表达会导致胸腺萎缩和石骨症的发生[20],骨抑制TRAF6治疗肿瘤疾病仍需进一步研究。
综上所述,食管鳞癌组织中MTA1、TAK1、TRAF6阳性表达率高于癌旁组织,且三者表达情况与患者临床病理特征和预后相关,可能作为食管鳞癌治疗及预后评估的相关靶点发挥临床作用。
