miR-181a调控sirt1对缺氧条件下大鼠脑微血管内皮细胞增殖和凋亡的影响
2022-05-16陆明佳王成凤景燕仲婷李红燕
陆明佳 王成凤 景燕 仲婷 李红燕
缺血性中风是由大脑血流供应减少导致氧气和营养供应不足,引起血脑屏障(blood brain barrier,BBB)破坏,从而导致脑组织坏死的一类疾病,具有高发病率、高致残率和高死亡率,且预后较差,给家庭和社会带来沉重负担[1]。尽管在医学和血管内再通方面取得了进展,但缺血性中风的治疗选择仍然非常有限[2]。因此,迫切需要深入了解其发病机制,寻找新颖有效的治疗方法。已知许多机制与缺血性中风的发病机制有关。而由缺血/再灌注损伤引起的脑微血管内皮细胞(brain microvascular endothelial cells,BMECs)死亡是BBB破坏的初始阶段,可导致缺血性中风患者的不良预后[3]。miRNA已被证明在许多中枢神经系统疾病(如中风和脑外伤)中起作用[4,5]。miR-181a是miR-181家族中的一个成员,神经系统中存在表达,与海突触可塑性[6]、血管生成[7]、肿瘤转移[8]等有密切关系。近年来研究发现miR-181a在脑缺血组织中过表达,可以促进脑组织细胞凋亡和炎症的发生,加重神经损伤[9,10]。Qi等[11]发现在缺血缺氧诱导的心肌细胞损伤中,下调miR-181a的表达,可上调沉默信息调节因子1(silence information regulator 1,SIRT1)的表达,促进细胞活力,抑制细胞凋亡,并增加SOD水平。但是,在缺氧诱导的BMEC中,miR-181a的作用仍然未知。SIRT1在抑制细胞氧化应激反应、炎症和细胞凋亡中起关键作用,并且是miR-181a的靶基因[12,13]。因此,本研究以缺氧诱导的大鼠脑微血管内皮细胞(rBMECs)为对象,探究miR-181a对rBMECs增殖、凋亡的影响及其可能的作用机制。
1 材料与方法
1.1 实验材料 大鼠脑微血管内皮细胞(rBMECs)由上海晅科生物科技有限公司从大鼠脑中分离、培养并提供;胎牛血清、DMEM培养基、IMEM(无酚红)培养基、胰蛋白酶均购自美国Gbico公司;异硫氰酸荧光素标记的葡聚糖(FITC-Dextran)购自美国Sigma-Aldrich;Lipofectamine 2000购自美国Invitrogen公司;miR-181a inhibitor和miR-181a inhibitor阴性对照(NC inhibitor)、si-SIRT1和si-NC以及PCR引物序列由上海GenePharma公司设计合成;MTT试剂盒(C0009S)、Annexin V-FITC细胞凋亡检测试剂盒(C1062L)、RIPA裂解液(P0013B)、BCA试剂盒(P0010)均购自碧云天生物科技公司;2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)活性氧(ROS)检测试剂盒(CA1410-500)购自北京索莱宝科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)(WST-1法)(A001-3-2)、丙二醛(malondialdehyde,MDA)(TBA法)(A003-1-2)、还原型谷胱甘肽(glutathione,GSH)测定试剂盒(微板法)(A006-2-1)试剂盒均购自南京建成生物工程研究所;Transwell小室(美国Corning公司,批号3413);TRIzol RNA分离试剂、SYBR®Premix Ex TaqTM试剂盒均购自日本TaKaRa公司;cDNA反转录试剂盒购自美国Thermo Fisher Scientific;兔抗血管内皮钙粘蛋白(VE-cadherin)(ab231227)、SIRT1(ab189494)、Bcl-2(ab196495)、Bax(ab32503)、Caspase-3(ab184787)、β-actin(ab8227)、山羊抗兔IgG H&L(HRP)(ab205718)均购自英国abcam公司。细胞培养箱(美国Thermo Fisher Scientific公司);ABI Prism 7300型荧光定量PCR系统(美国);倒置荧光显微镜(IX73,购自日本Olympus公司);iMark680多功能酶标仪、蛋白转膜装置、流式细胞仪(BD FACSCanto II)购自美国Bio-Rad公司。
1.2 实验方法
1.2.1 细胞培养与模型制备:将rBMECs接种于含有10%胎牛血清和1%青霉素-链霉素的DMEM培养基,在37℃、5%CO2的细胞培养箱中进行培养,隔天换液,在细胞达到指数增长期时开始实验。
1.2.2 细胞分组与转染:将对数生长期的rBMECs分为6个处理组:①对照组:正常培养的rBMECs;②模型组:将rBMECs于厌氧培养箱(95%N2、5%CO2)中培养12 h[14,15];③NC inhibitor组:用Lipofectamine 2000将50 nmol/L miR-181a inhibitor阴性对照(NC)转染rBMECs,转染24 h后,于厌氧培养箱中培养12 h;④miR-181a inhibitor组:用Lipofectamine 2000将50 nmol/L miR-181a inhibitor转染rBMECs,转染24 h后,于厌氧培养箱中培养12 h;⑤miR-181a inhibitor+si-NC组:将miR-181a inhibitor和si-NC共转染rBMECs,再于厌氧培养箱中培养12 h;⑥miR-181a inhibitor+si-SIRT1组:将miR-181a inhibitor和si-SIRT1共转染rBMECs,再于厌氧培养箱中培养12 h。随后在37℃的5%CO2培养箱中继续培养48 h。
1.2.3 RT-qPCR检测细胞中miR-181a和SIRT1 mRNA的表达:培养48 h后,使用TRIzol从培养的rBMECs细胞中提取总RNA,按照试剂盒说明书将RNA反转录为cDNA,进行PCR扩增。反应体系(20 μl):cDNA(200 ng/μl)2 μl,SYBR®Premix Ex TaqTM(2×)10 μl,上下游引物各0.4 μl,ddH2O 7.2 μl。反应条件:94℃预变性10min,95℃变性15 s,60℃退火20 s,75℃延伸20 s,进行40个循环。用U6或β-actin作为对照,相对miR-181a和SIRT1 mRNA的表达量采用2-ΔΔCt方法计算。见表1。

表1 RT-PCR引物序列
1.2.4 MTT法检测细胞增殖活力:取对数期生长的rBMECs,以1×104细胞/孔的浓度接种到96孔板中,将细胞按照1.2.2项下步骤进行分组及处理,培养48 h 后,每孔中加入20 μl的MTT溶液(5 mg/ml),于培养箱中孵育4 h,吸去上层清液后加入150 μl的DMSO,490 nm波长处测定各孔吸光度(OD),计算细胞增殖率。以培养基为空白孔调零。细胞增殖率=(实验组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)×100%。
1.2.5 流式细胞术检测细胞凋亡:取对数期生长的rBMECs,按照1.2.2项下步骤进行分组及处理,培养48 h后,将rBMECs用0.25%胰蛋白酶进行消化处理,离心,去除上清液,PBS洗涤后将细胞以1×106/ml的密度重悬,加入5 μl Annexin V-FITC、5 μl PI避光孵育15 min,按照FITC-Annexin V/PI凋亡检测试剂盒说明书步骤,使用流式细胞仪分析细胞凋亡率。
1.2.6 细胞屏障功能检测:将1.2.2中6组rBMECs以1×105细胞/cm2的密度和37℃的温度接种到培养箱中的Transwell小室中。进行低氧处理后,除去原始培养基,将100 μl含有FITC-Dextran(1 mg/ml)的无胎牛血清的DMEM培养基添加到上室中,下室加入500 μl 不含胎牛血清的DMEM培养基。在37℃的培养箱中培养1 h后,从下室中取出100 μl液体,酶标仪在494 nm激发波长、520 nm发射波长下检测荧光强度。用无胎牛血清的DMEM培养液配置不同浓度的FITC-dextran,制作标准曲线,根据荧光强度计算透过Transwell小室的FITC-Dextran的浓度(μg/ml);FITC-Dextran浓度越大,表示rBMECs屏障功能越弱。
1.2.7 荧光探针检测细胞内ROS水平:取对数期生长的rBMECs,按照1.2.2项下步骤进行分组及处理,rBMECs用PBS洗涤3次,与10 mmol/L的DCFH-DA于37℃避光孵育30 min。然后使用酶标仪分别在488和525 nm的激发和发射波长下检测二氯荧光素(DCF)荧光。ROS的水平通过检测DCF的荧光强度来确定。
1.2.8 生化法检测SOD活性、MDA和GSH水平:按照1.2.2项下步骤进行分组和处理rBMECs,收集细胞培养上清液,按照试剂盒说明书的操作检测SOD活性、MDA和GSH水平。
1.2.9 Western blot检测SIRT1和凋亡相关蛋白的表达:使用RIPA裂解液提取rBMECs中蛋白质,BCA法测定蛋白浓度后取等量蛋白质样品上样(30 μg/泳道),SDS-PAGE凝胶电泳,湿转法转膜,5%脱脂奶粉封闭,加入一抗(VE-cadherin、SIRT1、Bcl-2、Bax、Caspase-3、β-actin按1∶1 000的比例稀释),4℃下孵育过夜,加入二抗(1∶5 000)室温孵育1 h,ECL显色,以β-actin为内参,计算目的条带的相对表达水平。

2 结果
2.1 6组rBMECs中miR-181a和SIRT1 mRNA的表达 与对照组相比,模型组rBMECs中miR-181a的表达显著升高,SIRT1 mRNA表达显著降低(P<0.05);与模型组比较,miR-181a inhibitor组和miR-181a inhibitor+si-NC组细胞中miR-181a的表达明显降低,SIRT1 mRNA表达明显升高(P<0.05);与miR-181a inhibitor组相比,miR-181a inhibitor+si-SIRT1组细胞中SIRT1 mRNA表达明显降低(P<0.05)。见表2。
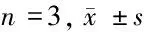
表2 6组细胞中miR-181a和SIRT1 mRNA的表达
2.2 6组rBMECs增殖能力比较 与对照组比较,模型组rBMECs增殖率显著降低(P<0.05);与模型组比较,miR-181a inhibitor组和miR-181a inhibitor+si-NC组细胞增殖率明显升高(P<0.05);与miR-181a inhibitor组比较,miR-181a inhibitor+si-SIRT1组细胞增殖率明显降低(P<0.05)。见表3。
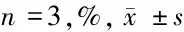
表3 6组rBMECs的增殖率比较
2.3 6组rBMECs凋亡比较 与对照组比较,模型组rBMECs凋亡率显著升高(P<0.05);与模型组比较,miR-181a inhibitor组和miR-181a inhibitor+si-NC组细胞凋亡率明显降低(P<0.05);与miR-181a inhibitor组比较,miR-181a inhibitor+si-SIRT1组细胞凋亡率明显升高(P<0.05)。见表4,图1。
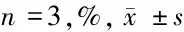
表4 6组rBMECs的凋亡率比较
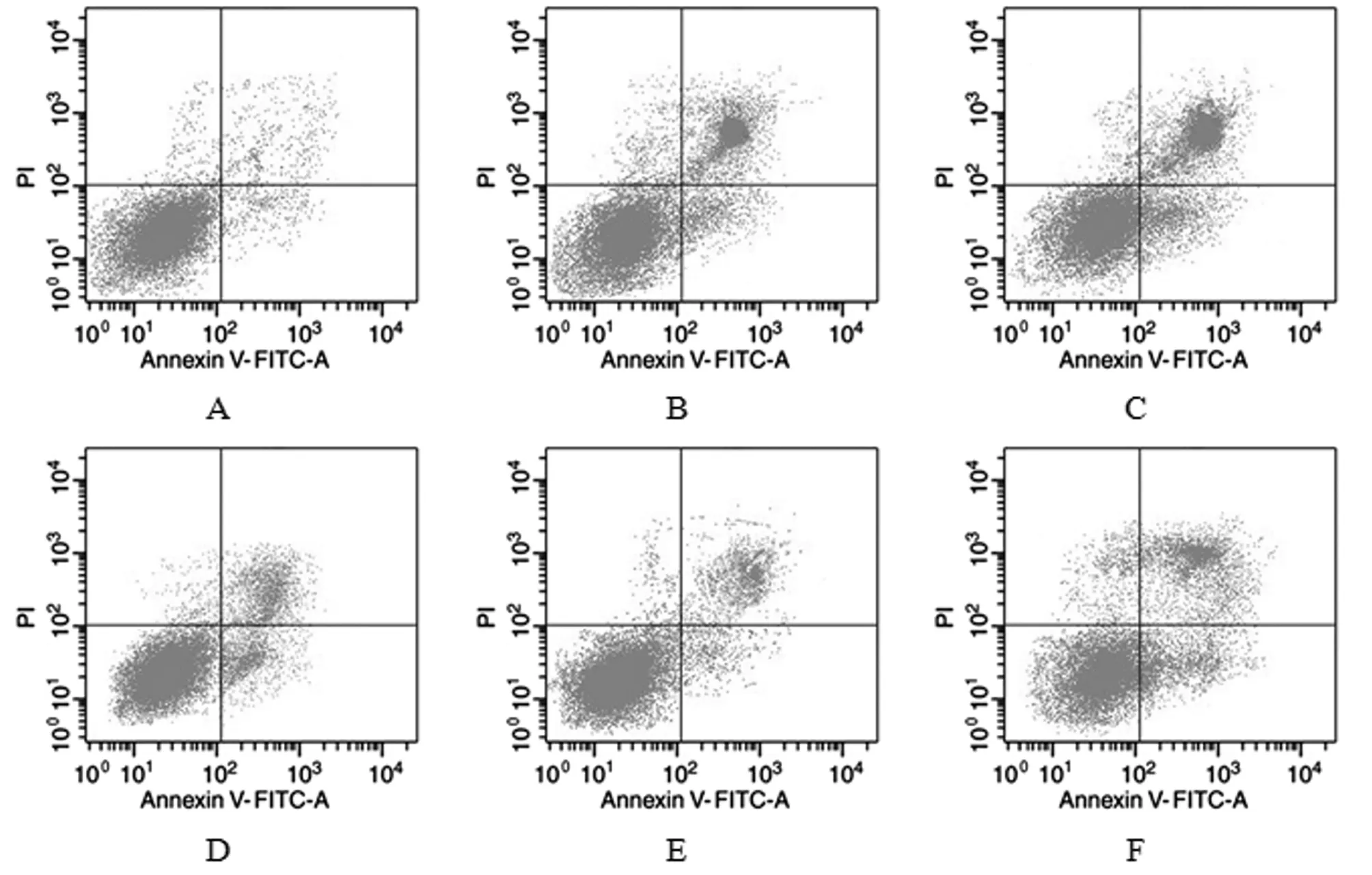
图1 6组rBMECs的凋亡情况;A 对照组;B 模型组;C NC inhibitor组;D miR-181a inhibitor组;E miR-181a inhibitor+si-NC组;F miR-181a inhibitor+si-SIRT1组
2.4 6组rBMECs屏障功能比较 与对照组比较,模型组透过rBMECs的FITC-Dextran的浓度显著增加(P<0.05);与模型组比较,miR-181a inhibitor组和miR-181a inhibitor+si-NC组FITC-Dextran浓度明显降低(P<0.05);与miR-181a inhibitor组比较,miR-181a inhibitor+si-SIRT1组FITC-Dextran浓度明显升高(P<0.05)。见表5。
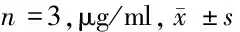
表5 6组透过rBMECs的FITC-Dextran浓度比较
2.5 6组rBMECs内VE-cadherin、SIRT1和凋亡相关蛋白的表达 与对照组比较,模型组rBMECs内VE-cadherin、SIRT1、Bcl-2表达显著降低,Bax、Caspase-3的表达显著升高(P<0.05);与模型组比较,miR-181a inhibitor组和miR-181a inhibitor+si-NC组细胞内VE-cadherin、SIRT1、Bcl-2表达明显升高,Bax、Caspase-3的表达明显降低(P<0.05);与miR-181a inhibitor组比较,miR-181a inhibitor+si-SIRT1组Bax、Caspase-3表达明显升高,VE-cadherin、SIRT1、Bcl-2表达明显降低(P<0.05)。见图2,表6。

图2 6组VE-cadherin、SIRT1和凋亡相关蛋白的表达;A 对照组;B 模型组;C NC inhibitor组;D miR-181a inhibitor组;E miR-181a inhibitor+si-NC组;F miR-181a inhibitor+si-SIRT1组
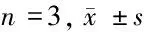
表6 6组rBMECs内VE-cadherin、SIRT1和凋亡相关蛋白的表达
2.6 6组rBMECs内ROS及SOD、MDA、GSH水平 与对照组比较,模型组rBMECs内ROS、MDA水平显著升高,SOD、GSH水平显著降低,差异有统计学意义(P<0.05);与模型组比较,miR-181a inhibitor组和miR-181a inhibitor+si-NC组细胞内ROS、MDA水平明显降低,SOD、GSH水平明显升高,差异有统计学意义(P<0.05);与miR-181a inhibitor组比较,miR-181a inhibitor+si-SIRT1组ROS、MDA水平明显升高,SOD、GSH水平明显降低,差异有统计学意义(P<0.05)。见表7,图3。
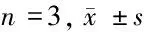
表7 6组rBMECs内氧化应激指标水平比较

图3 6组ROS生成量(荧光探针法×400);A 对照组;B 模型组;C NC inhibitor组;D miR-181a inhibitor组;E miR-181a inhibitor+si-NC组;F miR-181a inhibitor+si-SIRT1组
3 讨论
BBB完整性是中枢神经系统动态平衡的重要元素之一。BMECs是脑微血管的主要组成部分,也是构成BBB的主要元素,维持健康的BMECs对维持BBB的完整性和脑稳态起主要作用[16]。研究发现在缺血性中风期间,BMECs的凋亡增加,BBB被破坏,是缺血性中风早期死亡的主要原因[17]。本项研究中,我们成功建立了由缺氧诱导的rBMECs模型,表现为细胞凋亡增加,细胞增殖减少,氧化应激增加和细胞屏障功能障碍(FITC-Dextran浓度增加、VE-cadherin表达下降)。同时发现rBMECs凋亡的增加伴随着miR-181a的显著上调;而下调miR-181a的表达有助于促进rBMECs增殖,减少细胞凋亡,保持细胞屏障功能的完整。但其作用机制尚不清楚。
氧化应激是缺血性中风的重要事件,氧化应激的特征在于ROS产生和抗氧化应激之间的不平衡[18]。在缺血性中风后,ROS的迅速增加使抗氧化防御能力不堪重负,这些ROS可以破坏细胞大分子,导致自噬、细胞凋亡和坏死。先前的研究表明,ROS是导致内皮细胞受损和随后的内皮功能障碍的关键因素[19]。因此,ROS介导的氧化应激可能是导致rBMECs凋亡的重要因素。本研究中,我们发现下调miR-181a的表达可以通过降低ROS和MDA水平并提高抗氧化剂(SOD和GSH)来减轻氧化应激;提示下调miR-181a的表达可减轻氧化应激反应。
本研究还发现在miR-181a表达下调的同时SIRT1的mRNA和蛋白表达增加。SIRT1是NAD+依赖性脱乙酰基酶,已被证明是miR-181a的靶基因,在细胞分化、凋亡、氧化应激等多种生物学过程中发挥重要作用;研究发现SIRT1在血管内皮细胞中具有潜在的抗氧化应激活性[20];SIRT1的激活可减轻老年BMECs的氧化应激并恢复血管生成能力[21]。体外和体内研究表明在脑缺血/再灌注大鼠和氧糖剥夺(OGD)诱导人BMECs的细胞凋亡和氧化应激中,激活SIRT1,可降低ROS的产生和凋亡相关蛋白的表达水平,增加抗氧化酶(SOD、GSH)的水平,对海马神经元发挥神经保护作用[22,23]。Kong等[24]发现抑制miR-181a可上调SIRT1,减少神经元凋亡和氧化应激反应,保护海马免受癫痫病侵袭。本研究同样显示转染miR-181a inhibitor后,miR-181a的表达下调,而SIRT1的mRNA和蛋白表达增加,且Bcl-2表达增加,Bax、Caspase-3表达、rBMECs凋亡明显降低;为了进一步明确miR-181a/SIRT1对rBMECs增殖、凋亡的影响,本研究将si-SIRT1与miR-181a inhibitor共转染至rBMECs,结果显示干扰SIRT1的表达能明显逆转miR-181a inhibitor对缺氧诱导的rBMECs增殖、凋亡的作用;提示下调miR-181a的表达可通过上调Sirt1的表达,进而抑制缺氧诱导的rBMECs凋亡并促进rBMECs增殖。
综上所述,下调miR-181a的表达可促进缺氧诱导的rBMECs增殖、抑制rBMECs凋亡;其作用机制可能与与上调SIRT1的表达有关。此外本研究仅从体外细胞水平上进行了初步探究,尚需要进行体内动物研究进一步明确miR-181a对缺血性中风的影响。
