基因编辑技术在培育抗病毒水稻育种中的应用
2022-05-16温国琴
温国琴
(朔州师范高等专科学校 自然科学系,山西 朔州 036002)
在基因技术不断发展的时代背景下,对生物携带的遗传信息进行编辑已经成为一种可实现的操作[1-2],在对生物遗传信息进行定向操控时,其操作的对象也逐渐由原本大范围的核酸酶[3]、锌指核酸酶(Zinc Finger Ncleases,ZFNs)逐渐转变为细小的类转录激活因子效应物核酸酶(Transcription-like Activator Effector Nucleases,TALENs)[4],直至现阶段,已经可以实现的对CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR-Associated Nuclease9,Cas9)进行相应的编辑操作[5]。这种操作方式不仅更加简单,表现出的应用潜力也是巨大的,可以在极大程度上缩短水稻定向基因培育的时间成本。因此,将其应用到遗传育种领域的研究之中是十分具有潜力的[6]。
为此,本文提出了基因编辑技术在培育抗病毒水稻育种中的应用研究,并通过试验测试验证了设计方法在提高水稻抗病毒能力方面的价值。通过本文的研究,也希望可以为现代农业的发展提供有价值的参考。
1 利用CRISPR/Cas9进行基因敲除处理
在自然条件下,水稻细胞在针对病毒的攻击进行DSBs修复时,HDR出现的概率相对较低,因此利用CRISPR/Cas9对水稻育种进行研究时,首先就是敲除水稻上的致死基因[7]。在病毒的攻击作用下,决定水稻抵抗能力的因素是水稻中奔达松敏致死基因BEL对病毒的抗性。结合该基本原理,去除染色体中表现出相关病毒的抗性功能缺失的基因是最快速提高其抗病毒能力的关键[8]。为此,首先要利用CRISPR/Cas9技术的编码优势,设计具有高抗病毒性的BEL突变体基因序列,并将其嵌入到经过特异性优化的pSpCas9基因片段中,以pSpCas9基因片段的起始基因和终止基因为目标,编码水稻拟U6-26的启动子。在此基础上,借助获得的BEL突变体的基因序列,以sgR-NA为编辑设计的靶标序列,将转化水稻愈伤基因编辑到pSpCas9基因片段中,此时的表达载体为BEL突变体。其具体操作方式如图1所示。

图1 CRISPR/Cas9基因敲除操作方式
需要注意的是,在进行基因敲除处理时,水稻染色体上原有的部分纯合突变体可能会表现出对pSpCas9基因片段的过敏反应,这就意味着pSpCas9基因片段中存在部分编码基因出现了杂交制种特定,此时需要进一步优化Cas9基因序列。优化的目标是提高pSpCas9基因片段在水稻中的表达效率,降低过敏反应对水稻原有基因稳定性的影响。具体的实施方法是针对水稻的OsCAO1和OsLAZY1基因实施定点突变,CRISPR/Cas9通过基因诱导突变的方式将水稻植株中所有产生过敏反应的基因作为突变诱导的靶基因,令ospds突变体以上一位编码序列为基础进行基因改良。在此基础上,利用CRISPR/Cas9的载体作用对水稻的植酸合成关键酶基因ZmIPK2进行PEG介导处理,使得水稻在病毒攻击作用下,植酸合成机制不会受到影响,水稻的品质能够保持在稳定的状态。
2 利用CRISPR/Cas9进行精确基因编辑
除了敲除水稻染色体上病毒抗性功能缺失的基因外,提高水稻抗病毒能力的另一个手段就是利用CRISPR/Cas9技术对基因进行编辑操作,直接在其基因中导入具有高抗性的基因。对此,具体的操作可以分为单碱基编辑、基因替换和基因插入3种方式。在采用基因编辑方式实现该过程时,CRISPR/Cas9基因编辑技术利用NbPDS作为编辑基因的载体,将双链DNA Donor作为编辑基因转化的催化剂,此时的外源DNA是以修复模板的形式存在的,以水稻DNA子区域为编辑的靶位点,严格按照模板对基因进行编辑。在完成初期的编辑后,经过同源重组,编辑基因会与水稻原有基因发生替换反应。此时最重要的操作环节就是避免编辑位置的DNA出现断裂。因此需要借助CRISPR/Cas9基因编辑技术对替换中出现的错误进行修复。当采用基因替换的方式在水稻染色体中嵌入高抗性基因时,同样需要利用CRISPR/Cas9基因编辑技术提供外源DNA Donor,将DNA Donor的末端与非同源末端水稻OsEPSPS连接,替换对应区间的编码信息,这样就可以直接获得抗病毒的水稻。当采用基因插入的方式在水稻的染色体中嵌入目标基因时,首先要利用CRISPR/Cas9技术在水稻基因组中的安全位置插入抗病的基因合成元件,以水稻原有基因的一条单链DNA片段作为模板,运用第二代基因编辑工具对其进行复制。Cas9切口酶在靶位点切断原有的DNA双链,并实现对碱基的替换操作。完成替换后,利用APOBEC1脱氨酶对切口位置进行处理,确保基因蛋白的完全融合,确保靶位点的插入基因稳定发挥作用。
3 实例分析
在上述基础上,以早籼稻为测试材料进行了基因水稻育种效果试验测试,以此进一步分析基因编辑技术在培育抗病毒水稻育种中的应用效果。
3.1 测试方法
考虑到早籼稻属中熟偏迟早籼品种类型,且具有较长的生育期,一般在108~111 d,因此受病毒攻击的阶段性更长,且在栽种阶段,早籼稻具有株型紧凑的特征属性,因此分蘖力相对较弱。采用CRISPR/Cas9技术对其基因进行编辑处理后,将早籼稻的OsPIN9作为靶位点,进行特异性编辑。最后分别在相同面积和土质的地块进行栽种,面积均为100 m2,并观察其生长状态。
3.2 测试结果
在上述基础上,分别统计了2组试验田中水稻的设置情况,其结果如图2所示。

图2 水稻基因处理前后长势对比图
从图2中可以看出,未处理的水稻在幼苗阶段就表现出病毒污染特征,整体长势较弱,出现了明显的黄叶。在此基础上,为了进一步分析CRISPR/Cas9技术处理后水稻的抗病毒效果,统计了相应的基础生长数据信息以及对病毒性疾病的感染情况,其结果见表1。
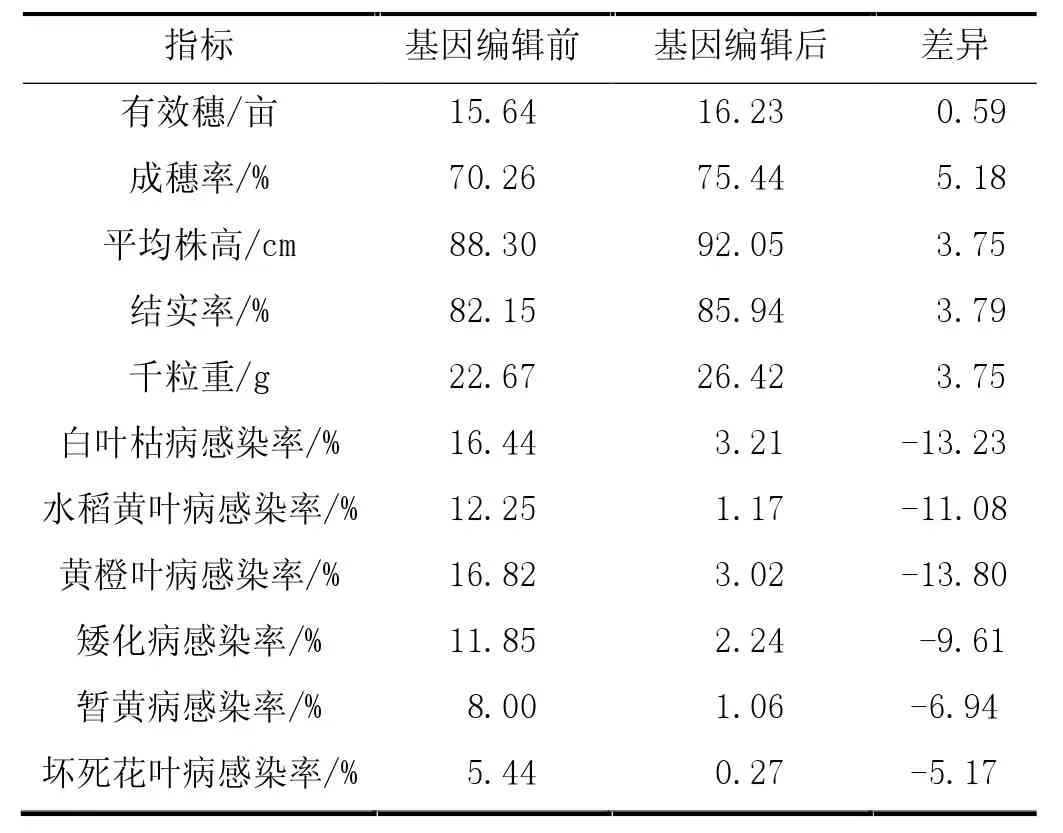
表1 基因编辑前后早籼稻生长数据信息
从表1中可以看出,经过基因编辑的早籼稻不仅植株高度得到了一定提升,有效穗、成穗率以及结实率也都得到了明显改善,且水稻结实质量也得到了改善,千粒重由原来的22.67 g提升至26.42 g,这是因为其感染白叶枯病、水稻黄叶病、黄橙叶病、矮化病、暂黄病以及坏死花叶病的概率大大降低,表明编辑技术可以实现对水稻的抗病毒培育。
4 结束语
水稻作为我国主要的粮食作物之一,是关系到人们基本生活质量和饮食安全的基础性因素。在病毒的作用下,水稻的产量以及结实质量都会受到直接影响。本文提出基因编辑技术在培育抗病毒水稻育种中的应用研究,分别从病毒抗性功能缺失基因敲除和高抗性基因嵌入的角度展开研究,实现了对水稻抗病毒能力的全面提升,优化了水稻的产量以及结实质量。
