塔尔油对蛋白核小球藻抑藻效应及机理研究
2022-05-13王燕燕赵梦醒刘廷志
王燕燕 赵梦醒 刘廷志
(天津科技大学天津市制浆造纸重点实验室,天津,300457)
淡水水域藻类大量繁殖导致河流湖水等颜色变化的现象被称为“水华”,海水的这种现象被称为“赤潮”[1]。水体富营养化可引起浮游植物迅速增殖,使水中溶解氧量下降,水生生物大量死亡。目前,控制“水华”的方式虽然有很多,如物理法、化学法和生物法等,但将其大规模应用时均存在操作难度较大、成本较高、破坏水体生态系统且不能从根本上解决水体富营养化的问题。化感作用和化感抑藻的研究为“水华”藻的治理提供了一个新思路,已逐渐被人们广泛认识和接受[2]。近年来,化感作用被广泛应用于藻类控制研究中,并取得较好的效果,但化感物质来源和提取过程中产生的大量剩余物问题越来越被广泛关注。低成本、高效、安全、环境友好的化感物质来源成为人们研究的重点[3]。
化感物质的种类很多,可将其分成五大类:芳香族、脂肪族、类萜、含氧杂环和含氮化合物,这些物质大都对藻类具有化感作用[4]。不同种类和来源的化感物质对藻类的抑制作用不同,多数研究者认为,化感物质主要使叶绿素A含量减少,影响细胞的光合产物,并通过改变抗氧化酶活性,损害细胞膜内的超微结构,使藻细胞受到破坏,最终影响藻类的生长。此外,有些化感物质还会损坏藻类细胞结构,导致细胞解体[5]。来源于陆生大型植物的化感物质因其抑藻效果显著、来源广泛、生物安全性好等特点成为近年来的研究热点。塔尔油作为一种松木硫酸盐法制浆过程中产生的副产物,其产量大且来源稳定。塔尔油中含有脂肪酸、萜类及甾类等化学物质[6-7],这些物质与植物的化感物质具有相似性,因此通过研究塔尔油对藻类的抑藻控藻效果,不仅能够开辟一种全新的陆生植物化感物质来源,还可提高制浆造纸副产物的经济价值,符合生物质精炼的概念,具有深远的经济及环境效益。
1 实验
1.1 实验材料
蛋白核小球藻(FACHB-29):采用SE培养基培养,光照强度为(4000±100)lx,温度为(25±1)℃,光暗比为12 h∶12 h恒温光照培育,每天定时摇瓶2~3次,至对数生长期将其接种后用于抑藻研究。塔尔油购自美国劳特公司。
1.2 实验方法
1.2.1 蛋白核小球藻的抑藻效果研究
将蛋白核小球藻用SE培养液培育到对数生长期,作为藻种应用,接种10%。将塔尔油用二甲基亚砜(DMSO)溶解并适当稀释,将不同浓度梯度的塔尔油溶液添加到接种好的蛋白核小球藻的培养基中,每个样品中加入的塔尔油体积相同,为300μL(150 mL培养液),并控制塔尔油浓度分别为100和150 mg/L,对照组中只加入300μL DMSO,然后进行培养并定期取样检测。
采用血球计数板测定藻细胞密度,通过与对照组对比计算抑藻率。藻液吸光度和除藻后吸光度分别通过测定508、285 nm处吸光度进行计算,采用0.45 μm的膜过滤去除藻细胞。
1.2.2 塔尔油对蛋白核小球藻的抑藻机理研究
叶绿素A含量的测定:超声波辅助热乙醇提取叶绿素A并进行测定[8]。
藻蛋白、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活力测定参照文献[9]进行。
藻液Zeta电位和粒径采用Zeta电位仪(FPA,德国AFG)、激光粒度仪(LS13 320,美国Beckman Coulter)进行测定。
采用SYBR greenⅠ(SYBR)和碘化丙啶(PI)双染色上流式细胞仪(CyFlow Cube6,德国Partec)检测藻细胞的存活率[10]。
2 结果与讨论
2.1 塔尔油对蛋白核小球藻抑制效果研究
2.1.1 塔尔油对蛋白核小球藻藻细胞密度的影响
在接种好的蛋白核小球藻液中加入浓度分别为100及150 mg/L的塔尔油(实验组),以研究塔尔油对蛋白核小球藻细胞(以下简称藻细胞)生长的影响,结果如图1所示。
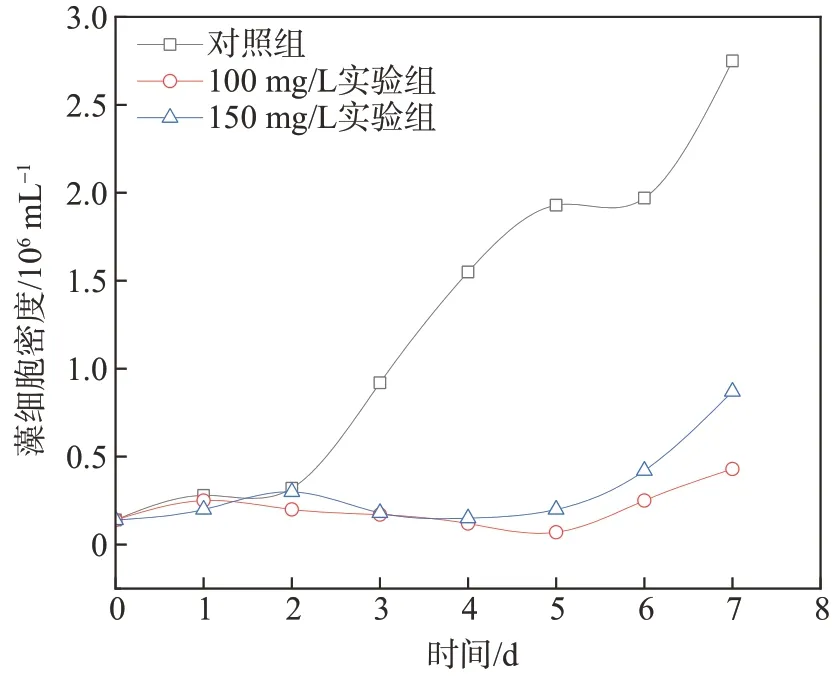
图1 塔尔油对藻细胞密度的影响Fig.1 Effect of tall oil on algae cell density
从图1可以看出,对照组藻细胞密度随培养时间的延长逐渐升高,呈现为正常的S型曲线。而2个实验组中,藻细胞生长曲线与对照组完全不同,100、150 mg/L实验组藻细胞密度在培养前期基本没有较大变化,藻细胞增殖不显著,第5天之后,实验组藻细胞密度呈缓慢上升趋势,但始终比对照组的藻细胞密度低很多。实验组藻细胞密度远低于对照组,说明塔尔油对藻细胞的生长确实起到了抑制作用。在第5~6天,对照组藻细胞密度出现平台期,而后开始快速增大,按照正常生长规律,第6天后的藻细胞密度快速增大应该与进入衰退期藻细胞的死亡和碎解有关,分解产生的碎片干扰了血球计数。李丽娟[11]在研究杨木APMP制浆废水中化感物质对蛋白核小球藻的抑制作用时也发现,添加化感物质对前期藻细胞生长的抑制作用非常明显,然而后期也出现增长趋势。Nakai等[12]在研究植物浸提液对铜绿微囊藻的抑制作用时也发现,在浸提液投加8天后其抑藻作用减弱,这与本研究得到的结果类似,推测应该是与藻细胞密度计数手段有关。
从图1还可以看出,在藻细胞培养前2天,塔尔油有一定抑藻作用,但并不是很明显,这是因为正常藻细胞生长在接种后也有一个平台缓冲期,接入的藻种需要一段时间适应,繁殖相对较慢,因此加入和不加入抑藻物质差异并不显著。到第3天后,藻细胞进入快速增殖阶段,塔尔油对藻细胞的抑制作用开始表现出来,抑藻率达到80%左右,后期随着时间的延长,塔尔油对藻细胞的抑制作用始终维持在较高的水平,塔尔油浓度为100 mg/L时的抑藻率最高达到88%。吴湘等[13]在研究黄花水龙化感物质对铜绿微囊藻的作用效果时发现,当添加75~150 mg/L化感物质时,其抑藻率达80%以上,即认为黄花水龙化感物质具有较好的抑藻效果,本研究的化感物质浓度及抑藻效果与前人研究结果基本相当。
2.1.2 塔尔油对蛋白核小球藻液吸光度的影响
藻液吸光度是藻类生长的一个主要参数指标,藻液吸光度主要与藻细胞密度有关,可用以确定藻类生长速度。在培养后期,藻液吸光度除与藻细胞密度有关外,还与培养液中溶解的叶绿素等色素含量相关。除藻细胞外,藻液吸光度主要由溶解性色度物质贡献,与藻细胞生长健康状态直接相关,健康细胞很少向培养液中释放有色物质。图2所示为塔尔油对蛋白核小球藻液(以下简称藻液)过膜除藻前后吸光度的影响。
从图2(a)可以看出,除第4天略有波动外,对照组的藻液吸光度整体呈持续升高趋势,这是由于健康细胞藻液吸光度与藻细胞密度相关,藻细胞密度不断增大表现为藻液吸光度不断提高,众多研究证明藻液吸光度值与藻细胞密度值具有较好的相关性,可用以衡量藻类的生物量[14-16]。图2(a)中,塔尔油浓度为100和150 mg/L实验组藻液的吸光度值从第1天开始即出现剧烈升高趋势,随后吸光度值提高速度逐渐放缓。仅靠藻细胞的生长繁殖,不可能使藻液吸光度急剧升高,同时对照组也显示正常生长的藻细胞不可能使藻液吸光度出现此种趋势。
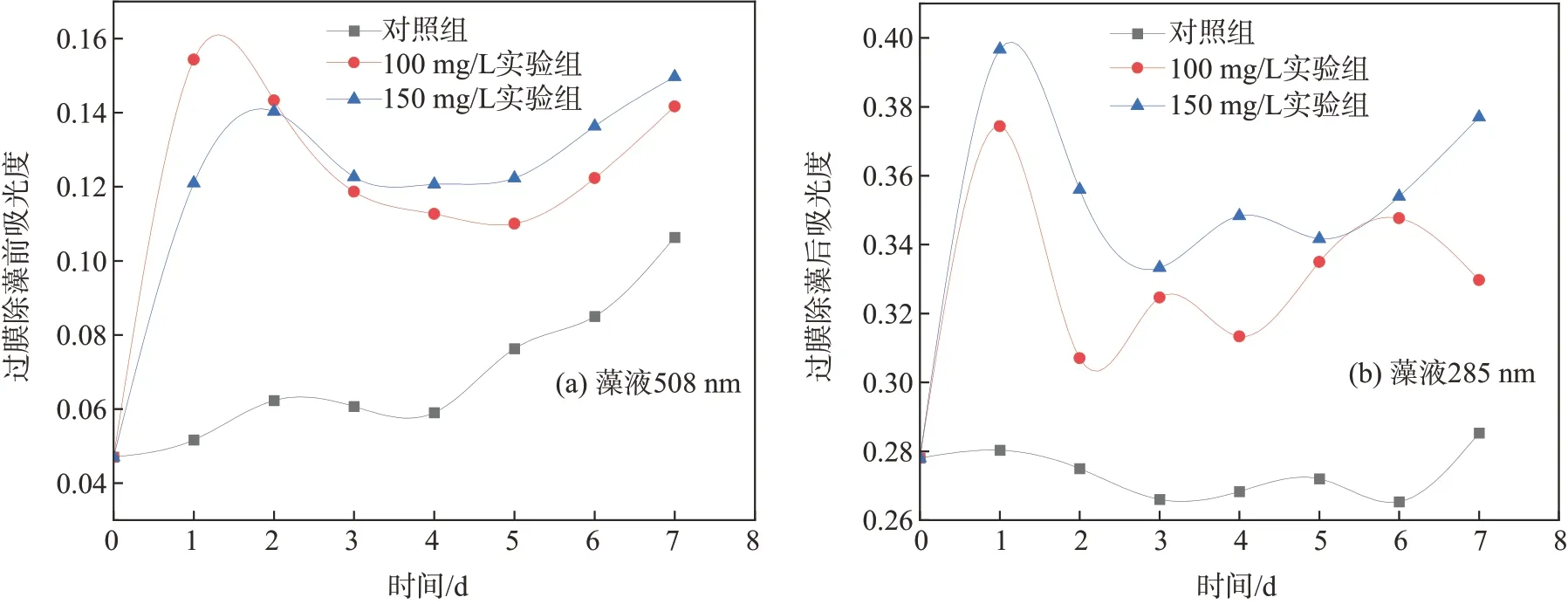
图2 塔尔油对藻液吸光度的影响Fig.2 Effect of tall oil on theabsorbanceof algaeliquid
图2(b)中,过膜除藻后对照组吸光度前期一直很低,这是因为在正常生长状态下,藻细胞比较健康,很少向培养液中释放有色物质,而第6天之后,过膜除藻后藻液吸光度却迅速升高,这主要是因为随着培养时间延长,大部分藻细胞进入衰退期,藻细胞死亡比例增加,细胞内有色物质被释放出来,使得吸光度升高。而图2(b)中,过膜除藻后实验组的藻液吸光度从加入塔尔油后即急剧升高,24 h内达到最高值,然后降低,后又呈缓慢波动升高趋势。这可能是因为塔尔油的加入影响了藻细胞的健康状态,导致藻细胞结构遭到破坏或藻细胞死亡,藻细胞内的有色物质大量溶出,从而使藻液吸光度升高。刘光涛等[17]采用高剂量壬酸对铜绿微囊藻和混合培养藻类进行处理,随后分别对2种藻液的光密度值进行测定;结果显示,其藻液光密度值在早期也出现了急剧升高现象,研究者认为是壬酸致使藻类死亡,其残余物干扰了测定结果。
从塔尔油对藻细胞密度和藻液吸光度的影响可以看出,塔尔油的确具有显著的抑藻效果。
2.2 塔尔油对蛋白核小球藻的抑藻机理研究
2.2.1 塔尔油对蛋白核小球藻叶绿素A含量的影响
藻细胞中的叶绿素A含量通常可以反映藻细胞的生长和光合作用状态[18]。图3显示了加入塔尔油后蛋白核小球藻叶绿素A含量的变化趋势。

图3 塔尔油对蛋白核小球藻叶绿素A含量的影响Fig.3 Effect of tall oil on thechlorophyll Acontent of Chlorella pyrenoidosa
由图3可知,对照组和实验组叶绿素A含量在培养期前2天均出现下降现象。对照组叶绿素A含量的下降可能是由于藻细胞接种后有一个适应平台期,适应期内的藻细胞繁殖相对缓慢,叶绿素A分解速度大于增长速度,因此总体呈下降趋势。从第3天开始,对照组藻细胞度过适应平台期,进入快速增殖的对数生长阶段,藻细胞生长旺盛,叶绿素A含量快速上升;第5天以后,叶绿素A含量又开始剧烈下降。这是因为藻细胞经过5天培养,进入衰退期,藻细胞活力下降,因此叶绿素A含量下降,但总体仍远高于实验组。在整个培养过程中,实验组叶绿素A含量始终保持较低水平。有研究认为,有些化感物质可以破坏藻细胞的叶绿素A,影响藻细胞的光合作用和同化产物的产生,从而达到抑制藻细胞生长的目的[19]。朱传雪等[20]在研究荷花种植水对巢湖蓝藻的抑制作用时发现,荷花种植水可使蓝藻细胞内的叶绿素A含量下降,研究者认为荷花代谢化感物质可破坏蓝藻细胞并使其丧失光合作用。Ni等[21]在研究缓释情况下亚油酸对铜绿微囊藻的化感效应时发现,亚油酸缓释微球实验组的叶绿素A含量下降明显,与本实验结果相似。
2.2.2 塔尔油对蛋白核小球藻抗氧化酶的影响
图4显示了培养第3天塔尔油对蛋白核小球藻的藻蛋白含量及SOD和CAT酶活力的影响。
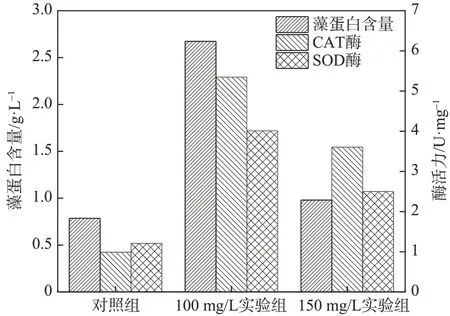
图4 塔尔油对蛋白核小球藻抗氧化酶的影响Fig.4 Effect of tall oil on theantioxidant enzyme of Chlorella pyrenoidosa
当外界条件改变时,藻细胞体内的SOD和CAT酶活力会短时间提高以消除生长环境出现的超氧根离子,从而维持细胞的正常生长[22]。由图4可知,加入塔尔油后藻细胞的SOD和CAT酶活力均呈应激性提高。与对照组相比,100和150 mg/L实验组CAT酶活力从0.99 U/mg分别增至5.35和3.60 U/mg,为对照组的5.4和3.6倍。同样,藻细胞SOD酶活力受塔尔油的影响出现激增,从对照组的1.21 U/mg分别增至2.50和4.01 U/mg,为对照组的2.1和3.3倍。这可能与蛋白核小球藻受塔尔油“胁迫”时产生的应激反应有关。Li等[23]在三叶草水提物对铜绿微囊藻的化感作用研究中发现,当刚加入三叶草水提物时,铜绿微囊藻的SOD和CAT酶活力应激性提高,这与本实验中塔尔油作用于藻细胞的结果相似;Shao等[24]在研究邻苯三酚对铜绿微囊藻的化感作用时也发现,在邻苯三酚“胁迫”下,铜绿微囊藻的SOD和CAT酶活力均出现了氧化应激性提高;Hong等[25]研究发现,芦木碱对铜绿微囊藻的SOD和CAT酶活力也有影响,并注意到在早期细胞暴露时,芦木碱可以诱导提高CAT酶活力,但后期则会降低铜绿微囊藻的SOD酶活力。
塔尔油的加入会对蛋白核小球藻产生一定“胁迫”作用,蛋白核小球藻的抗氧化系统在短时间通过提高SOD酶活力来降低这种氧化性损伤。在受到环境“胁迫”时,细胞可能还会合成逆境蛋白用以对抗环境[26]。从图4可以看出,实验组藻蛋白含量也出现了上升,应该是藻细胞合成了逆境蛋白以应对外界环境的变化所致。
2.2.3 塔尔油对藻液颗粒粒径的影响
从藻细胞密度曲线(见图1)可以发现,培养第5天测定的抑藻率最高。取抑藻率最高时的藻液,并对其进行颗粒粒径测定,结果如图5所示。
从图5可以看出,与对照组相比,实验组藻液颗粒粒径出现了最大粒径和平均粒径变大、最小粒径变小的现象。对照组藻液颗粒的平均粒径约为94.1μm,且颗粒粒径分布在1~400μm之间,而加入塔尔油的100、150 mg/L实验组藻液颗粒平均粒径分别增大到126.4和124.2μm。颗粒粒径分布变得更加分散,最小粒径从对照组的1μm下降到实验组的0.4μm,100 mg/L实验组颗粒在400~800μm也有分布,而150 mg/L实验组颗粒最大粒径甚至达到1000μm。从图5还可以看出,对照组颗粒粒径在1~8和100~400μm之间有2个明显的分布峰,加入了塔尔油的实验组颗粒粒径在1~8μm之间的分布峰基本消失,100 mg/L实验组颗粒粒径更均匀地分布在2~60μm之间,150 mg/L实验组颗粒粒径在20~60μm之间出现了新的分布峰。综合以上分析可知,塔尔油在一定范围内可使蛋白核小球藻液颗粒粒径分布变得更加分散,表现为峰宽变大,粒径范围变大。这是由于塔尔油一方面可使蛋白核小球藻细胞分解破碎,从而使藻液颗粒粒径变小,另一方面可使藻细胞更加趋向于絮聚,使得藻液颗粒粒径增大。杨茹君[27]在研究重金属对海洋浮游植物生长过程中的粒度效应时发现,添加Pb(Ⅱ)可改变赤潮异弯藻的粒径,出现最大粒径增大、最小粒径减小的现象,这与本实验结果相似。

图5 塔尔油对藻液颗粒粒径影响Fig.5 Effect of tall oil on the particle size of algae liquid
2.2.4 塔尔油对藻液Zeta电位的影响
Zeta电位是表征分散体系稳定性的重要指标,已有许多研究表明,藻液的Zeta电位对藻细胞的聚集或分散有影响[28-29]。
图6为加入塔尔油后培养期不同阶段蛋白核小球藻液Zeta电位的变化情况。从图6可以看出,蛋白核小球藻液Zeta电位均为负值且在-13~-36 mV之间波动;实验组藻液Zeta电位绝对值明显低于对照组,这可能是由于加入塔尔油后,蛋白核小球藻细胞受到了破坏,从而释放大量的胞内有机物,藻细胞更容易粘附,从而增大其絮聚趋势,这也解释了在藻细胞计数时显微镜下细胞成团的现象。培养过程中也可以明显看出,实验组中存在絮体在瓶底沉淀的现象。郑利娟等[30]在探究碱度对混凝去除铜绿微囊藻及其分泌有机物的影响时发现,随着碱度的增大,藻液Zeta电位绝对值逐渐减小,体系的稳定性逐渐减弱,有助于絮体形成,与本实验现象相似。
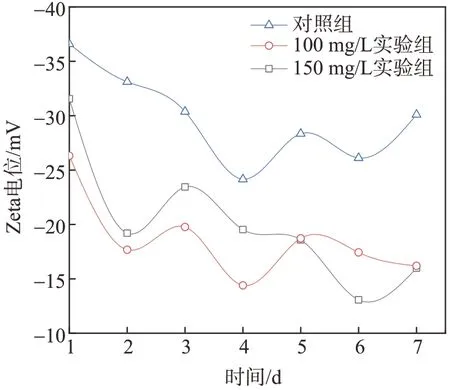
图6 塔尔油对藻液Zeta电位的影响Fig.6 Effect of tall oil on the Zetapotential of algaeliquid
2.2.5 塔尔油对蛋白核小球藻杀灭效果研究
为研究塔尔油对藻细胞的杀灭作用,取培养第5天藻细胞(抑藻率最高),经染色后用流式细胞仪对其生存状态进行分析,结果如图7所示。
依据死亡、活细胞所处的区域,设定合适的“门”,将其划分为活性区与非活性区。对比图7中对照组和实验组的死亡、活细胞比例可以发现,对照组中活细胞比例达47.2%,生长状态良好,死亡细胞仅占9.7%;而加入塔尔油后,藻细胞死亡细胞比例增加,且塔尔油浓度越高,死亡细胞比例越大,100 mg/L实验组死亡细胞比例达62.8%,150 mg/L实验组死亡细胞比例增至75.7%,说明高浓度的塔尔油不仅造成藻细胞结构损伤,还可以导致藻细胞死亡。

图7 塔尔油对蛋白核小球藻细胞死亡率影响Fig.7 Effect of tall oil on the mortality of Chlorella pyrenoidosa cell
2.2.6 塔尔油对蛋白核小球藻细胞结构的影响
图8为培养第5天蛋白核小球藻细胞的SEM图。图8(a)和图8(b)为正常培养状态下蛋白核小球藻的细胞生长状况,在正常生长条件下,藻细胞圆润、饱满,细胞个体分明且表面光滑,细胞分裂较旺盛。与对照组相比,加入塔尔油的实验组藻细胞形态出现了明显的变化。由图8(c)和图8(d)可知,加入塔尔油的实验组藻细胞表面开始凹陷,随着塔尔油浓度的增大,藻细胞完全失去其完整性,细胞破裂,并且细胞个体不分明,常见多个细胞粘合在一起(见图8(e)和图8(f))。这可能是由于塔尔油破坏了藻细胞的抗氧化酶,使藻细胞内的氧自由基积累过多,过高的自由基含量导致藻细胞发生膜脂过氧化,最终出现凹陷甚至破裂现象。段书惠[5]在研究大黄有机提取物对铜绿微囊藻的生长中发现,大黄提取物能够致使蓝藻细胞表面出现空洞凹陷,这与本实验结果相似。陈国元等[31]在香蒲和铜绿微囊藻共培养时发现,香蒲对铜绿微囊藻的亚显微结构造成了严重影响,并认为因为共培养时水生植物对藻类产生氧化“胁迫”,增加了藻细胞内活性氧,细胞膜脂过氧化,藻细胞被严重破坏。

图8 塔尔油对蛋白核小球藻细胞结构的影响Fig.8 Effect of tall oil on the cell structure of Chlorella pyrenoidosa cell
3 结论
以塔尔油为化感物质,研究了塔尔油对蛋白核小球藻的抑藻效果,并对其机理进行了初步探究。
3.1 在蛋白核小球藻接种初期加入100和150 mg/L塔尔油,均对蛋白核小球藻有明显抑制作用,抑藻率整体维持在80%以上,最高可达88%,且塔尔油浓度(100、150 mg/L)对抑藻率影响不大。
3.2 塔尔油的加入可使蛋白核小球藻的叶绿素A含量显著下降,而藻细胞的藻蛋白含量及抗氧化酶活力则会在塔尔油的刺激下应激性提高;塔尔油可降低藻液Zeta电位绝对值,增加藻细胞絮聚的趋势;粒径分布研究结果表明,塔尔油的加入一方面使部分细胞分裂成细胞碎片,另一方面由于絮聚作用会导致藻液平均颗粒粒径大幅增大。另外,塔尔油可破坏藻细胞结构,藻细胞表面发生凹陷并最终破裂。
