胆酸转运蛋白调控胆汁酸代谢的分子机制
2022-05-13李明巧余思睿
潘 琼, 李明巧, 谭 雅, 余思睿, 柴 进
(陆军军医大学第一附属医院消化内科 全军消化病研究所胆汁淤积肝病中心,重庆 400038)
胆汁 (bile) 主要成分包括水和胆汁酸(bile acid)。 胆汁酸代谢包括胆汁酸的合成、转运、加工、排泌及肠肝循环(enterohepatic circulation)等过程,对机体脂质的消化吸收、糖脂代谢及能量代谢具有重要意义[1-2]。体内胆汁酸的稳态对维持机体正常生理状态起关键作用。胆汁形成和排泌障碍可导致胆汁酸稳态失衡, 致使肝细胞内胆汁酸过量积累,引起肝脏和(或)血液内胆汁酸显著升高,从而造成胆汁淤积。 胆汁淤积轻则造成肝损伤,重则导致肝纤维化、肝硬化、甚至死亡[3-4]。 胆汁淤积情况下,肝脏可产生适应性反应(adaptive response),一方面下调胆固醇 7α 羟化酶(cholesterol 7 alpha-hydroxylase,CYP7A1)和胆固醇 12α 羟化酶(sterol 12 alpha-hydroxylase,CYP8B1)基因抑制胆汁酸的从头合成,减少肝细胞内胆汁酸的生成;另一方面,通过调控肝细胞膜上胆酸转运蛋白(bile acid transporter)的表达而减少肝细胞对胆汁酸的摄入、 增强其排泌,包括胆酸摄取蛋白(bile acid up-take transporter)如牛磺胆酸钠共转运多肽 (sodium-taurocholate cotransporting polypeptide,NTCP)/SLC1OA1、 有机阴离子转运多肽 (organic anion-transporting polypeptide,OATP)1B1 和OATP1B3 等表达降低和胆酸排泌蛋白如多药耐药蛋白 (multidrug resistance protein,MRP)3/ABCC3、MRP4、OATP3A1 和有机溶质转运体 (organic solute transporter alpha-beta,OSTα/β/SLC51A-B)等表达升高[5-9]。 最终,通过上述两方面的适应性调控, 达到减少肝细胞内胆汁酸积累的目的,从而减轻胆汁淤积性肝损伤。 关于胆汁淤积的治疗, 目前获批准使用的药物仅有法尼醇X 受体(farnesoid X receptor,FXR)激动剂熊去氧胆酸(ursodeoxycholic acid,UDCA) 和奥贝胆酸(obeticholic acid,OCA)。 近期文献报道,过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR) 激动剂苯扎贝特 (bezafibrate)、 非诺贝特(fenofibrate)等贝特类药物对胆汁淤积[如原发性胆汁性胆管炎(primary biliary cholangitis, PBC)]治疗效果良好[10]。 但总体来说,目前胆汁淤积治疗药物数量有限,而且疗效有一定的局限性。因此,研究和探讨胆酸转运蛋白调控胆汁酸代谢的分子机制,对寻求治疗胆汁淤积的关键靶点具有重要的科学意义和临床价值。
胆汁酸的合成和转运
胆汁酸在肝细胞中以胆固醇为原料,以经典合成途径和替代合成途径合成[2]。 胆汁酸关键合成酶包括 CYP7A1、CYP8B1、胆固醇 27α 羟化酶(sterol 27 alpha-hydroxylase,CYP27A1)等,其中 CYP7A1 是经典合成途径的关键限速酶。 有文献报道当小鼠中CYP7A1 敲除时,胆汁酸合成减少并不能被其他胆汁酸合成酶所代偿[11]。
正常生理条件下, 肝脏每天合成的胆汁酸并不能满足肠内营养物质的消化和吸收。仅约5%胆汁酸随粪便排泄,95%以上的胆汁酸通过肠肝循环重吸收和再利用。 肠肝循环过程包括:进食引起胆囊收缩,储存胆汁酸通过胆汁流进入肠道。 游离胆汁酸在小肠和结直肠通过扩散作用被动重吸收, 而结合胆汁酸在回肠由定位于肠上皮细胞顶膜的胆酸摄取蛋白顶端钠离子依赖性胆汁酸转运体 (apical sodium-dependent bile acid transporter,ASBT/SLC10A2)主动重吸收至小肠黏膜细胞后,与胆汁酸结合蛋白 (ileal bile acid binding protein,IBABP)结合,再由小肠黏膜细胞基底膜的OSTα/β重吸收入门静脉。重吸收的胆汁酸经门静脉运输至肝细胞窦状隙,经由肝细胞基底膜侧胆酸摄取蛋白NTCP 和OATP1 从肝窦状隙血液内摄取胆汁酸至肝细胞内。肝细胞内摄入的胆汁酸和从头合成的胆汁酸, 通过肝细胞内一系列胆汁酸代谢酶的加工后,由肝细胞胆管面膜的胆酸排泌蛋白胆盐输出泵(bile salt export pump,BSEP/ABCB11)、磷脂酰胆碱转运蛋白 (phosphatidylcholine translocator,MDR3/ABCB4)等排泌至毛细胆管,并储存于胆囊中,下次进食再次排入肠道[12-13](见图1)。
胆汁酸的合成和转运对维持正常情况下胆汁酸池的稳态至关重要,而在胆汁淤积情况下,胆汁酸的合成和转运也会产生适应性改变,以降低肝细胞内积聚的毒性胆汁酸对肝细胞的损伤。而胆汁酸的合成由关键核受体FXR 所调控,同时,FXR 还可调控胆酸转运蛋白的表达,从而影响胆汁酸的转运[14]。 因此,核受体FXR 在胆汁酸的合成和转运中起关键作用。
胆酸转运蛋白摄入和排泌胆汁酸的分子机制
胆酸转运蛋白主要分布在肝脏、肠道、肾脏等脏器。按对胆汁酸的转运功能可分为胆酸摄取蛋白和胆酸排泌蛋白(见图1)。 按照胆酸转运蛋白在极性化细胞的分布,可分为极性化细胞基底侧膜转运蛋 白 ( 如 MRP3、MRP4、OATP3A1、OATP1B1、OATP1B3、OSTα/β、NTCP 等 ) 和 顶 膜 转 运 蛋 白(BSEP、MRP2、MDR3 等)。 胆酸转运蛋白在肝细胞主要定位于基底侧膜及胆管面膜,受胆汁酸、FXR、SHP、FGF19 等多种因素的调节。
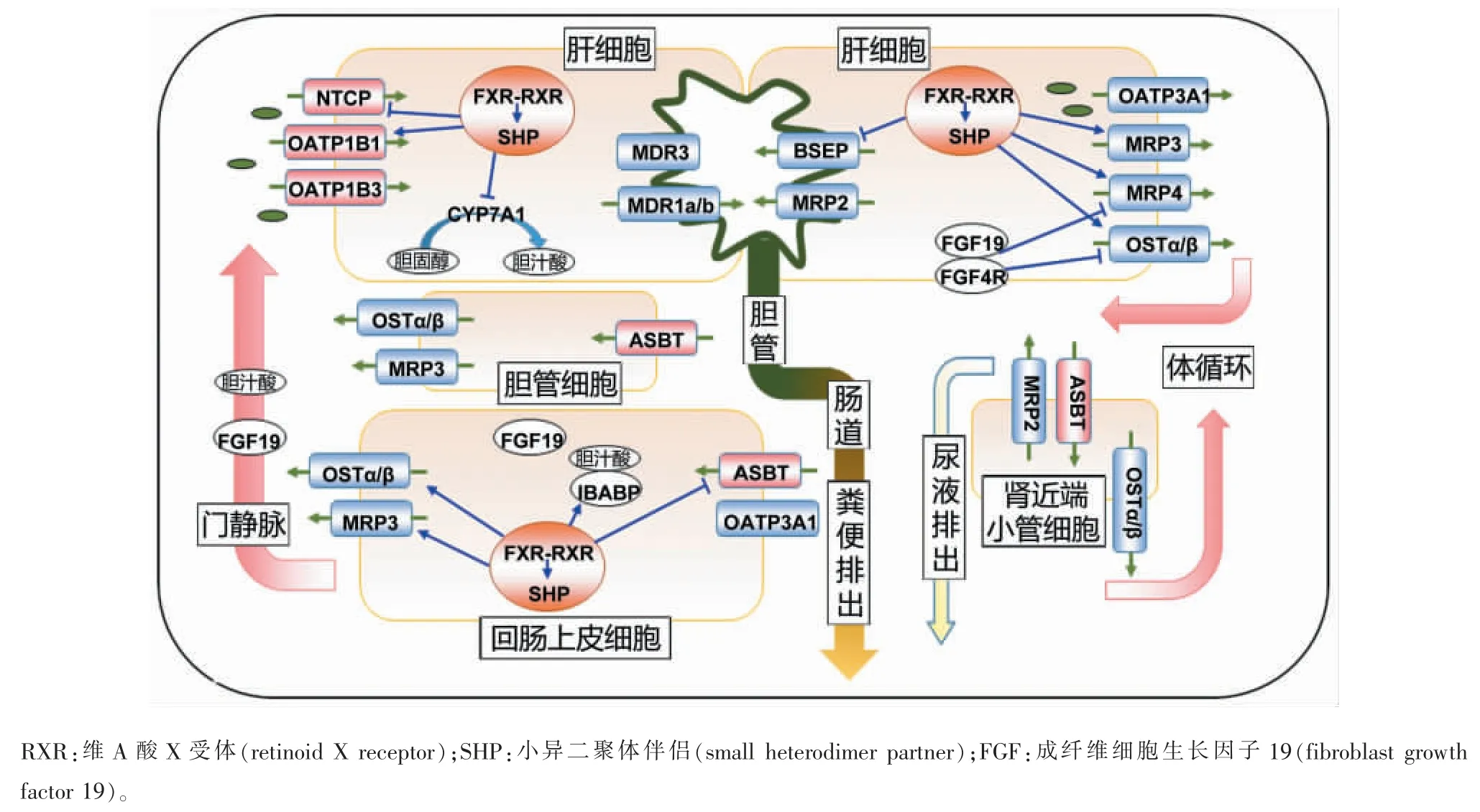
图1 胆汁酸的肝肠循环及代谢调控
一、胆酸摄取蛋白NTCP 调控肝细胞对胆汁酸的摄入
NTCP 是位于肝细胞基底侧膜的胆汁酸摄取转运体, 介导约90%的胆汁酸从肝血窦中进入肝脏,以结合型胆汁酸为主[15-16]。 胆汁酸可通过直接或间接的分子机制调控NTCP 表达,主要包括改变核受体 FXR、SHP、 维 A 酸受体 α:RXRα (retinoic acid receptor α: α,RARα: RXRα) 等和核转录因子肝细胞 核 因 子 1 (hepatocyte nuclear factor,HNF)-1、HNF-4、肝脏受体类似物1(liver related homologue-1,LRH-1)等的活性。 在胆汁淤积情况下,胆汁酸可激活FXR,诱导 SHP 表达,SHP 不仅可干扰 RARα:RXRα 结合到NTCP 启动子的活性而抑制NTCP 的转录,也可通过抑制 HNF-4α、HNF-1α 和 LRH-1 的表达进而抑制NTCP 表达[17]。 而在胆汁淤积情况下,关键胆酸摄取蛋白NTCP 的适应性下调,可明显减少肝细胞对胆汁酸的摄入,一定程度上缓解胆汁淤积性肝损伤。有文献报道,NTCP 抑制剂能有效缓解胆汁淤积肝损伤[18]。 此外,SLC10A1 p.R252H 突变会致使NTCP 功能丧失, 从而导致高胆汁血症的发生[19]。 虽然也有文献报道SLC10A1 p.S267F纯合子突变与高胆汁酸血症密切相关[20],而我们最新研究表明SLC10A1 p.S267F 纯合子突变小鼠并未呈现高胆汁酸血症的表型[21]。 这提示,出现该种现象的原因,一方面是人与小鼠胆汁酸主要成分截然不同,另一方面可能是SLC10A1 p.S267F 突变并未导致NTCP 蛋白完全失活,其丧失的功能可被其他胆酸摄取蛋白如OATP1B1 等所代偿。 更有趣的是, 小鼠SLC10A1 基因敲除能减轻饮食诱导的肥胖症,其机制可能是NTCP 缺失而减少肝脏从血浆中摄取胆汁酸,从而增加血浆中胆汁酸水平,降低血浆胆固醇水平, 抑制肠道脂肪吸收和增加能量消耗,由此减轻肥胖和肝脂肪变[22]。
二、胆酸转运蛋白OATP 调控胆汁酸的摄取与排泌
OATP 属于溶质载体有机阴离子(solute carrier organic anion,SLCO)超家族,广泛分布于肝、肾、脑和胎盘等组织,参与多种底物的运转,包括前列腺素、甲状腺素、雌激素、胆汁酸、他汀类药物等[23]。
OATP1B1 和OATP1B3 定位于肝细胞基底侧膜,从肝血窦中摄取胆汁酸,受核受体FXR、SHP、HNF-4α 等调控[21]。 OATP1B2(OATP1B 和 OATP1B3的小鼠同源基因) 敲除小鼠肝内胆汁酸重吸收减少,肠道及血清中胆汁酸增加;并且胆汁酸可刺激肠道表达FGF15(FGF19 的小鼠同源基因),FGF15激活肝脏中成纤维细胞生长因子受体4(fibroblast growth factor receptor 4,FGFR4), 从而抑制肝脏中CYP7A1 表达,减少肝内胆汁酸合成[24]。 有文献报道,OATP1B1 和OATP1B3 基因突变可导致其转运功能缺失,与隐性遗传病Rotor 综合征密切相关[25]。
此外,我们团队发现并鉴定了肝细胞基底侧膜一种新的胆酸排泌蛋白OATP3A1, 该蛋白在胆汁淤积时表达显著升高,能增强肝细胞外排胆汁酸,减轻肝细胞内胆汁酸的积累[9]。 具体机制包括:在胆汁淤积下, 肠道内聚集的胆汁酸可刺激FGF19高表达,并随血液进入肝脏激活核因子κB(nuclear factor-κB,NF-κB)及细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)信号通路,诱导转录因子特异性蛋白1 (specificity protein 1,Sp1)及NF-κB 入核而靶向结合到OATP3A1 启动子区、上调其启动子活性,从而诱导OATP3A1 的表达[9]。
三、胆酸排泌蛋白OSTα/β 调控胆汁酸的重吸收与排泌
OSTα/β(SLC51A/B)是一种由 OSTα 和 OSTβ构成的异源二聚体, 广泛表达于人体各类组织器官,尤其是肠道和肝脏组织。 OSTα 和 OSTβ 定位在肝细胞、肠上皮细胞的基底侧膜上,在小肠黏膜细胞重吸收胆汁酸, 使胆汁酸经血液循环回到肝脏;在肝细胞促进胆汁酸排泌到血液, 再由肾脏经尿液排出体外[26]。 在正常情况下,小鼠肝内 OSTα/β表达水平低,但在胆汁淤积情况下,胆汁酸可诱导OSTα/β 的表达增加, 增强肝细胞外排胆汁酸。OSTα 和 OSTβ 的表达主要由核受体 FXR、LXR、SHP、核转录因子LRH-1、细胞因子FGF19(小鼠为FGF15)等所调节[16]。有研究表明,SLC51A 基因敲除后,胆汁酸可在肠上皮细胞内积聚激活核受体FXR而上调FGF15 表达;FGF15 经血液循环至肝脏与其受体FGFR4 结合激活ERK 信号通路抑制胆汁酸合成关键限速酶CYP7A1 的表达,从而抑制胆汁酸的从头合成。 与此同时,肝内核受体(constitutive androstane receptor,CAR)表达上调,诱导肝内Ⅰ相胆汁酸羟化/解毒酶(CYP2B10 和CYP3A11)、Ⅱ相肝脏解毒酶(SULT2A1 和UGT1A1)和Ⅲ相胆汁酸排泌蛋白 (MRP2 和MRP3) 表达增加, 以及肾内MRP2 和MRP4 表达增加, 减少血清和肝脏胆汁酸积聚,增强胆汁酸从尿液排泄,最终减轻胆汁淤积[27]。 近期文献报道,OSTβ 基因突变可导致其功能丧失,患儿呈现胆汁淤积、慢性腹泻、严重脂溶性维生素缺乏等症状[28]。 而OSTα 基因突变致使其蛋白功能丧失,患儿呈现出胆汁淤积、肝纤维化和先天性腹泻等[29]。 这提示 OSTα 和 OSTβ 在胆汁酸的转运中发挥关键作用,其功能缺失可导致胆汁淤积的发生。
四、胆酸排泌蛋白BSEP 调控胆汁酸的外排
BSEP 主要表达于肝细胞胆管面膜, 是胆汁酸从肝细胞排泌到胆管的主要转运体,也是胆盐依赖性胆汁流形成的限速因子, 其表达主要由核受体FXR、RXR 所调控[30]。 近期有研究发现,肝脏特异性敲除紧密连接蛋白2(tight junction protein 2,TJP2)可明显减少BSEP 和解毒酶CYP2B10 的表达水平,降低胆汁酸外排引起肝内胆汁淤积[31]。 此外,BSEP有300 种遗传突变,包括错义、无义、移码或剪接突变,与多种类型的胆汁淤积性肝病密切相关。例如,BSEP 基因突变可导致原发性家族性肝内胆汁淤积症 2 型 (primary familial intrahepatic cholestasis type-2,PFIC-2)、 良性复发性肝内胆汁淤积症 2 型(benign recurrent intrahepatic cholestasis type-2,BRIC-2)、 妊娠期肝内胆汁淤积症(intrahepatic cholestasis of pregnancy,ICP)等[32]。 近期,我们团队报道了世界首例由Semaphorin7A(SEMA7A)p.R148W 纯合突变所致的一种新型PFIC[21]。该患者初诊时主要临床表型为肝损伤和高胆汁酸血症,通过影像学、血清生化、自身抗体谱等检查和检验后,排除目前已知的肝病;经过对该家系进行全基因组测序(whole genome sequencing,WGS)和生物信息分析后发现该患者存在SEMA7A p.R148W 错义突变的纯合子。 随后通过构建SEMA7A p.R145W(与人的SEMA7A p.R148W 同源)纯合子突变小鼠后重现了该患者临床表型, 并通过机制研究发现SEMA7A p.R145W 突变可激活蛋白激酶C(protein kinase C,PKC)来减少肝细胞胆管面膜关键胆酸排泌蛋白BSEP 和MRP2 的表达, 致使胆汁排泌障碍,导致肝内胆汁淤积的发生。
五、MDR 维持肠道内胆汁酸稳态
MDR 属于ABC 转运蛋白家族的转运蛋白,目前研究已经证实MDR1 (ABCB1) 和MDR3(ABCB4,小鼠同源基因为MDR2)与胆汁酸的转运密切相关。
MDR1 主要表达于肝、肠、肾等器官组织,参与胆汁酸、药物代谢物等转运。 肝脏MDR1 主要表达于肝细胞胆管面膜,对肝细胞内胆汁酸向毛细胆管排泌起重要作用。 与肝组织相比,MDR1 在肠道和血脑屏障可能具有更重要的功能,主要包括:正常情况下,胆汁酸可刺激肠道CD4+T 效应细胞刺激回肠MDR1 的表达而维持肠道内胆汁酸稳态;当MDR1 缺乏时,肠道T 细胞在肠道微生物的作用下失去稳态, 出现肠黏膜功能障碍并诱导克罗恩病,证明MDR1 对肠上皮细胞的氧化应激具有保护性作用[33]。
MDR3 主要表达于肝细胞胆管面膜上,能够特异性将肝细胞内磷脂酰胆碱(phosphatidylcholine,PC)转运至脂质双分子层的外层,参与胆汁的形成[34]。有研究证实,初级胆汁酸中的PC 减少将导致胆盐对胆管的毒性增加, 从而引发胆汁淤积性肝病,这项研究表明了胆汁酸中正常的PC、胆盐和胆固醇浓度比例的重要性;而MDR3 基因突变致使其功能缺失可导致PC 与胆盐比值的改变, 进而引起PFIC-3、ICP、低磷脂相关性胆石症、药物性肝损伤等[35]。 此外,有研究表明,MDR3 磷酸化对维持胆汁酸池稳态起关键作用, 当其磷酸化被抑制,PC 的排泄显著减少,胆汁酸池失衡,胆盐析出形成胆结石[36]。
六、胆酸排泌蛋白MRP 调控胆汁酸的外排
MRP 属于 ABC 转运蛋白家族, 现已证实MRP2、MRP3 和 MRP4 与胆汁酸排泌密切相关。 此外,胆酸排泌蛋白 MRP2、MRP3、MRP4 外排胆汁酸属于主动转运, 因此, 也可以称之为胆酸排泌泵。MRP2 定位表达于肝细胞胆管面膜和肾上皮细胞顶膜;而MRP3 和MRP4 主要定位表达于肝细胞基底侧膜。
在胆汁淤积情况下(如PBC),肝脏MRP2 表达显著增加,可将胆汁酸外排至毛细胆管,减少肝细胞内毒性胆汁酸的积累[37];此外,肾上皮细胞MRP2表达上调可将胆汁酸外排至近端小管,促使胆汁酸从尿液排出[38],从而减轻胆汁淤积。 我们团队前期研究发现,在梗阻性胆汁淤积情况下PKC 被激活,诱导细胞骨架蛋白Ezrin Thr567 磷酸化,促进肝细胞胆管面膜MRP2 的内吞和泛素化途径降解而加重肝内胆汁淤积[7]。 此外,我们新近研究也发现SEMA7A p.R145W 突变可通过激活PKC 减少肝细胞胆管面膜BSEP 和MRP2 的表达,导致一种新型的进行性家族性肝内胆汁淤积[21]。 另外,脓毒症也可激活磷脂酰肌醇 3-激酶 (phosphoinositide 3-kinase,PI3K))/Akt 信号通路, 而 PI3Kγ 可抑制 MRP2 的表达,从而加重胆汁淤积性损伤[39]。
肝细胞基底侧膜MRP3 在正常情况下表达极低,而在胆汁淤积情况下显著增高,其主要受核转录因子 LRH-1 和核受体 RXRα:RARα 所调控[40-41]。前期我们团队发现MRP3 在梗阻性胆汁淤积肝组织中高表达, 并且血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)可刺激其高表达,其具体可能的机制为:胆汁淤积下,血清TNF-α 水平上调,可激活c-Jun 氨基末端激酶/应激活化蛋白激酶(c-Jun N-terminal kinase/stress-activated protein kinase,JNK/SAPK)信号通路诱导核转录因子SP1 和LRH-1 的表达,增强MRP3 启动子活性而使MRP3 表达上调[6]。
综上所述, 胆酸转运蛋白 MRP2、MRP3 和MRP4 在胆汁酸排泌和胆汁淤积肝病中起极其重要的作用,因此,药物靶向上述蛋白能增强胆汁酸外排,减轻胆汁淤积性肝损伤。近期文献报道,丹参酮ⅡA、 人参皂苷Rg1 等可以通过激活核因子E2相关因子2 (nuclear factor erythroid 2-related factor 2,Nrf2)上调肝细胞膜 MRP2、MRP3 和(或)MRP4基因表达而促进胆汁酸外排, 减轻对胆汁淤积、乙酰氨基酚(acetaminophen,APAP)等所致的肝损伤[40,42-43]。此外,当 BSEP 表达显著减少时,孕烷 X 受体 (pregnane X receptor,PXR) 被激活, 诱导上述MRP 的表达水平, 而此时,MRP4 表达的增高比MRP3 更加显著[44]。 此外,MRP4 基因敲除可导致严重的胆汁淤积,MRP3 基因敲除可引起高胆红素血症,提示MRP4 可能以转运胆汁酸为主,而MRP3 可能以转运胆红素为主[45-46]。
七、胆酸摄取蛋白ASBT 调节肠道胆汁酸的重吸收
ASBT 又称回肠胆酸转运蛋白 (ileal bile acid transporter,IBAT), 是胆汁酸池稳态的主要决定因素。 ASBT 表达在近端肾小管上皮细胞和胆管上皮细胞膜上较少,主要表达于回肠细胞顶膜。 在正常情况下,回肠末端肠上皮细胞顶膜上的ASBT 重吸收的胆汁酸与胆汁酸结合蛋白(ileal bile acid binding protein,IBABP)结合,通过肠上皮细胞基底侧膜OSTα/β 进入血液循环; 在肝血窦被肝细胞基底侧膜胆酸摄取蛋白NTCP 摄入。 IBABP 是在回肠上皮细胞主要表达的胞浆蛋白,受FXR 所调控,并与胆汁酸结合,调节肠道胆汁酸的重吸收[47]。 ASBT 在肾脏也具有重吸收胆汁酸的作用,胆汁酸的硫酸化能够阻断ASBT 对胆汁酸的转运作用,增加粪便及尿液中胆汁酸的排泄[48]。
ASBT 的表达主要由转录因子和核受体等所调控。 在胆汁淤积状态下,胆汁酸通过激活FXR-SHP信号通路,减少ASBT 启动子活性,抑制ASBT 的表达,减少肠道胆汁酸重吸收,从而减轻胆汁淤积。目前已经发现ASBT 在其5’ 非编码区与HNF1-α有3 个结合位点,证明ASBT 的表达也可能依赖于HNF1-α[49]。 此外,研究表明肠细胞增殖相关转录因子尾型同源异形盒(caudal-type homeobox,CDX)在食管以及肠道细胞中能激活ASBT 启动子, 调控ASBT 的表达; 转录激活因子激活蛋白-1(activator protein-1,AP-1) 是由 c-Jun 和 c-Fos 组成的异源二聚体,与ASBT 启动子上游AP-1 作用元件结合,增强 ASBT 表达, 与下游 AP-1 作用元件结合抑制ASBT 活性[50-51]。 在生理条件下,肠道菌群可通过GATA 结合蛋白 4(GATA binding protein 4,GATA4)抑制ASBT 在肠道对胆汁酸的重吸收[52]。
此外,前期研究已经表明,慢性特发性便秘、2 型糖尿病和高脂血症均已将ASBT 作为治疗靶点。 也有文献报道,SLC10A2 基因突变与非酒精性脂肪性肝病、胆汁淤积性肝病、炎症性肠病(inflammatory bowel disease,IBD)等疾病发病有关联[51]。 因此,ASBT 不仅与胆汁淤积肝病密切相关,同时也与其他消化系统疾病的发生有关。
未来与展望
综上所述,胆酸转运蛋白调节胆汁酸代谢是一个相互交错、相互协作的复杂分子网络。比如,胆汁酸可通过调节核受体的活性而调控胆汁酸的合成,而同时,胆汁酸又可对胆酸转运蛋白进行负反馈调控。此外,胆汁酸稳态与否,也与机体糖脂代谢和能量代谢密切相关。 在胆汁淤积情况下,胆酸转运蛋白的适应性变化能够有效减轻肝细胞内胆汁酸的积累,从而减轻胆汁淤积肝损伤。但是,目前该领域仍然存在几个问题需进一步研究:①胆酸转运蛋白的分子调控机制仍不清晰;②是否有新的胆酸转运蛋白(胆酸摄取蛋白和胆酸排泌蛋白)的存在有待考证。总之,对胆酸转运蛋白的研究,不仅可以加深对胆汁淤积肝病发病机制的理解,同时也可能为胆汁淤积的临床治疗提供新的靶点和线索。
