黄果龙葵幼苗对镉胁迫的生理生长响应
2022-05-13周蛟潘远智赵胤刘思丽贾茵姜贝贝邬梦晞张璐徐倩王凯璐曾勇
周蛟 潘远智 赵胤 刘思丽 贾茵 姜贝贝 邬梦晞 张璐 徐倩 王凯璐 曾勇

摘要: 黄果龙葵(Solanum diphyllum)是茄科的小灌木,已有的研究对黄果龙葵的镉(Cd)响应知之甚少。该研究采用水培控制试验,在160 μmol·L Cd胁迫下,测定了黄果龙葵幼苗在不同胁迫时间点(0、0.5、1、3、7、19 d)的生长、耐性系数(TI)、Cd富集特性、超氧化物歧化酶(SOD)活性、渗透调节物质和光合色素等指标。结果表明:(1)在胁迫0~3 d时Cd对黄果龙葵幼苗的生长无显著影响。胁迫3~19 d时表现为明显抑制,且毒害随胁迫时间延长而加重。与对照组相比,Cd胁迫使黄果龙葵幼苗的生物量降低13.28%~62.40%。(2)黄果龙葵幼苗的最大Cd积累量为60.14 μg·plant,其地上部份的Cd积累量占植株的15.46%~35.24%。(3)丙二醛(MDA)含量呈上升趋势,根的MDA含量最大增幅为对照组的5.25倍。SOD活性、游离脯氨酸、可溶性糖、叶绿素a、叶绿素b和类胡萝卜素的含量均呈先升后降的趨势。(4)黄果龙葵幼苗的耐性系数TI随胁迫时间延长而降低,最小值为0.64。综上结果认为,黄果龙葵是一种潜在的Cd忍耐植物 ,其幼苗对高浓度的Cd胁迫在短时间内具有一定程度的耐性,并且黄果龙葵可能通过渗透调节和根系固持来缓解Cd毒害。该研究结果为寻找合适的植物修复材料提供了理论依据。
关键词: 黄果龙葵, 镉, 生理生长, 渗透调节, 光合色素
中图分类号: Q945文献标识码: A文章编号: 1000-3142(2022)04-0628-11
Physiological and growth responses of Solanum diphyllum seedlings to Cd stress
ZHOU Jiao PAN Yuanzhi ZHAO Yin LIU Sili, JIA Yin JIANG Beibei WU Mengxi ZHANG Lu XU Qian WANG Kailu ZENG Yong
( College of Landscape Architecture, Sichuan Agriculture University, Chengdu 611130, China )
Abstract: Solanum diphyllum is a kind of small shrub of Solanaceae, and little has been known about its Cd tolerance ability in the existed researches so far. In order to investigate the physiological responses, growth responses and Cd tolerance characteristics of S. diphyllum seedlings, we conducted a hydroponic experiment with 160 μmol·L Cd stress to determine the indexes of growth (taproot, height, stem diameter, leaf number, biomass, and root to shoot ratio), tolerance index (TI), Cd content, Cd accumulation characteristics, SOD activity, osmotic adjustment substances (MDA, free proline and soluble sugar), and photosynthetic pigment (Chlorophyll a, Chlorophyll b and carotenoid) in different stress time (0, 0.5, 1, 3, 7, 19 d). The results were as follows: (1) Compared with controls, Cd had no significant effects on the growth of S. diphyllum seedlings when stress time was 0-3 d; Obvious Cd toxicity was aggravated with the prolonging of Cd stress time (3-19 d); During the period of experiment, Cd stress reduced the total biomass of S. diphyllum seedlings by 13.28%-62.40%, root suffered the most serious biomass damage among different plant tissues. (2)The maximum Cd accumulation of the whole plant was 60.14 μg·plant, for root and shoot the maximum Cd accumulation were 43.49 μg·plan and 16.65 μg·plant respectively, Cd accumulation of shoots accounted for 15.46%-35.24% of the whole plant. (3)MDA content of S. diphyllum seedlings increased with the increase of stress time, the maximum increase of MDA content in roots was 5.25 times that of control; SOD activity, contents of free proline and soluble sugar, as well as photosynthetic pigment contents increased at the beginning and then decreased. (4) Tolerance index (TI) showed a different tendency, it decreased with the increase of stress time, and the minimum value of S. diphyllum seedlings during the whole period of experiment was 0.64. The above results indicate that S. diphyllum seedlings have a certain degree of tolerance to high concentration of Cd stress (160 μmol·L), which suggests that it is a potential Cd tolerance plant. The osmotic adjustment and root retention might be the main methods of S. diphyllum seedlings to alleviated toxicity to plant growth caused by Cd. This research provides a theoretical basis for finding suitable phytoremediation materials.
Key words: Solanum diphyllum, Cd, physiological growth, osmoregulation, photosynthetic pigment
近年来,人口的急剧增加、化学肥料的滥用和城市进程的加快导致了我国土壤重金属污染加剧(Wu et al., 2018),其中镉(cadmium,Cd)以高达7.0%的点位检出率位居重金属污染物榜首(环境保护部和国土资源部,2014)。生物非必需元素Cd具有移动性高、毒性强、不易降解的特点,Cd的过量积累会对植物造成极大伤害(Carvalho et al., 2020)。植株形态的改变是Cd毒害最直接的表现(刘柿良等,2015),研究表明根系是土壤Cd进入植物的第一道关卡,Cd毒害影響根系伸长发育,阻碍植物营养物质吸收(Boc'ov et al., 2012)。Cd随根系向地上部分转移会破坏光合反应中心,使光合色素降解,降低光合作用效率(Parmar et al., 2013),从而影响叶片光合作用,降低植物生物量。Cd胁迫还会诱导植物氧化应激,使植物细胞膜脂过氧化(罗巧等,2019),改变细胞膜完整性,扰乱细胞水平衡等。植物会以多种响应方式缓解Cd毒害,其中渗透调节是植物缓解毒害的重要手段之一。Majumdar等(2018)和Semida 等(2018)的研究表明Cd胁迫会促进游离脯氨酸、可溶性糖等物质的合成参与渗透调节,以维持细胞膜完整性,从而保持细胞水势,抵抗毒害。此外,重金属对植物的影响往往是持续的变化过程,因此,研究植物耐受重金属胁迫的时间动态响应具有重要意义。
植物修复技术是公认的治理土壤重金属污染的友好途径,超富集植物在植物修复技术中具有重要作用(Ali et al., 2013)。经典的Cd超富集植物的定义(Barker & Brooks, 1989)为(1)在高浓度Cd污染条件下正常生长;(2)地上部分(或叶片)的Cd含量超过100 mg·kg DW;(3)富集系数(地上部分Cd含量/土壤Cd含量)>1;(4)转运系数(地上部分Cd含量/根系Cd含量)>1。由此可见,即使植物的重金属修复能力由生物量和重金属含量共同决定,但重金属的含量往往更受关注,而生物量的积累却容易被忽视。目前,发现的超富集植物普遍具有生物量低、生长缓慢等缺点(Singh et al., 2016),这严重阻碍了植物修复技术的发展。实践应用中重金属含量低但生物量大的植物可能比重金属含量高但生物量小的植物具有更高的植物修复效率(Wu et al., 2010)。因此,寻找适宜的植物修复材料是植物修复技术应用的关键。
茄科茄属的龙葵(Solanum nigrum)(Xu et al., 2012)和少花龙葵(S. photeinocarpum)(Zhang et al., 2011)均已被证明是Cd的超富集植物,但两者在生物量积累方面不占优势。黄果龙葵(S. diphyllum)与龙葵和少花龙葵为同科同属植物(Hariri & Irsyam, 2018),其生物适应性强,目前在临床上应用较多,可全株入药,有散瘀消肿、清热解毒的功效。作为小灌木的黄果龙葵在生物量、生长速度上皆有优势,但目前国内外关于黄果龙葵的研究主要集中在药理(El-Sayed et al., 2009)、核型鉴定(徐秀芳等,2004)和植物入侵(Pandey et al., 2018; 王秋萍等,2019)等方面,鲜有研究关注黄果龙葵的重金属Cd响应特征(Singh et al., 2019; Wu et al., 2020)。所以,为探究黄果龙葵是否具有应用于植物修复的潜力,本研究以黄果龙葵为试验材料,采用水培的方法,研究黄果龙葵对高浓度Cd胁迫的生理生长响应及其Cd忍耐性,以期为土壤Cd污染的植物修复材料选择提供新的思路和理论依据。
1材料与方法
1.1 试验材料
黄果龙葵种子购于种子园艺公司,挑选大小一致且颗粒饱满的种子,将其浸泡在浓度为1.0% 的NaClO溶液中20 min以进行表面消毒,种子消毒后用去离子水洗净。将消毒后的黄果龙葵种子于2019年2月中旬置于光照培养箱催芽,光照培养箱设置光照处理14 h,黑暗处理10 h。待种子长出四片真叶后挑选长势一致的幼苗作为供试苗,供试苗于2019年3月下旬进行移苗。
1.2 试验设计
水培试验于2019年3月—2019年5月在四川农业大学成都校区大棚内进行,整个试验期间对水培箱进行连续通气防止植物烂根。试验期间大棚内平均温度为(29.02±8.16) ℃,平均相对湿度为52.87%±10.04%。将供试苗移栽于Hoagland全营养液(大量元素为四水硝酸钙945 mg·L,硝酸钾607 mg·L,磷酸二氢铵115 mg·L,七水硫酸镁493 mg·L;微量元素为乙二胺四乙酸二钠铁 30~40 mg·L,硼酸2.86 mg·L,硫酸锰2.13 mg·L,硫酸锌0.22 mg·L,硫酸铜0.08 mg·L,钼酸铵0.02 mg·L)中培养16 d,期间每3 d更换一次营养液。选择发育良好、长势一致的黄果龙葵植株进行Cd胁迫处理(Cd)。根据前期预实验,设定Cd胁迫浓度为160 μmol·L(以CdCl·2.5HO进行添加),以不添加Cd为对照(CK),胁迫组和对照组重复3次。Cd处理期间保持水培箱内Cd胁迫浓度不变,植物随机区组排列。分别在不同时间点(0、0.5、1、3、7、19 d)随机于胁迫组和对照组采取植株,植株收获后将其浸入浓度为20 mmol·L的乙二胺四乙酸二钠(EDTA-2Na)溶液中20 min以去除表面吸附的Cd,随后用去离子水洗净。
1.3 测试指标与方法
1.3.1 生长指标及耐性系数测定分别于不同采样时间点在胁迫组(Cd)和对照组(CK)各随机选取3株黄果龙葵植株,测定植株主根长、株高、茎粗、叶数。将各植株样品分为根、茎、叶(地上部分包括植株茎、叶),于烘箱中105 ℃杀青,80 ℃烘干至恒重并称量。
黄果龙葵的耐性系数(tolerance index,TI)计算(Feng et al., 2018; Wu et al., 2018):
TI=(LH+WR+WS+WL)/4
式中:TI是黄果龙葵的Cd耐性系数;LH、WR、WS和WL分别是胁迫组与对照组的株高、根生物量、茎生物量和叶生物量的比值。
1.3.2 Cd含量和积累量测定将植株的各组分干样粉碎研磨,过1 mm筛备用,称取样品0.200 0 g置于消解罐中,采用HCl-HNO(v∶v=5∶4)消化,消解样品放置过夜后用微波消解仪(CEM MARS-5)消解,用ICP测定Cd含量。Cd积累量由Cd含量和生物量的乘积计算。
1.3.3 生理生化指标测定分别在不同采样时间点于胁迫组和对照组各收集1份植物组分样品,叶、根经去离子水冲洗后取混合样品,每份样品来自随机选取的3株黄果龙葵植株,重复3次,取样后材料迅速固定于液氮。超氧化物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四唑还原法测定,丙二醛(malondialdehyde,MDA)含量参照硫代巴比妥酸方法测定,游离脯氨酸采用磺基水杨酸法测定,可溶性糖采用蒽酮比色法测定,叶绿素a、叶绿素b和类胡萝卜素含量采用乙醇-丙酮提取法测定(王文龙,2014)。
1.3.4 材料处理各指标采样完成后,收集所有剩余的植物材料于实验室重金属废弃物处理点,集中送往专业公司处理。
1.3.5 数据处理数据处理和统计分析采用软件SPSS 20.0进行,用单因素方差分析(one-way ANOVA)和多重比较(Duncan)检验Cd胁迫时间对黄果龙葵形态、Cd含量、Cd积累量、SOD活性、MDA含量、游离脯氨酸含量、可溶性糖含量、叶绿素a含量、叶绿素b含量和类胡萝卜素含量的影响和差异显著性,用独立样本t检验(independent-samples t Test)比较胁迫组和对照组的组间差异显著性,采用Pearson法进行相关性分析(双尾检验)。显著性水平设定为P<0.05。图表绘制采用 Microsoft Excel 2019进行。
2结果与分析
2.1 Cd胁迫对黄果龙葵幼苗表观形态的影响
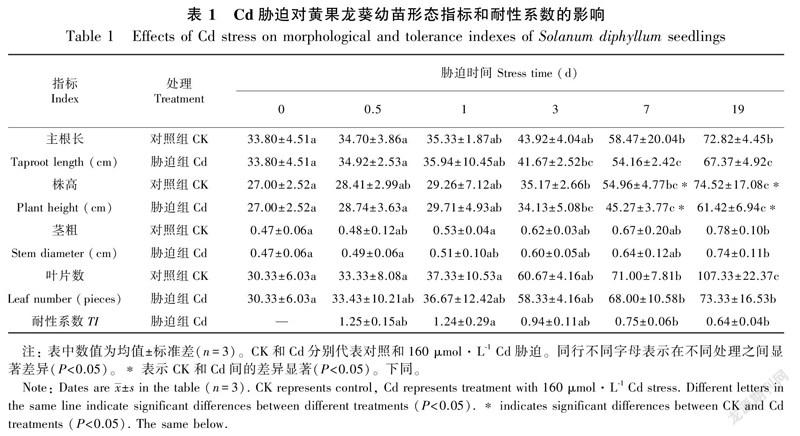
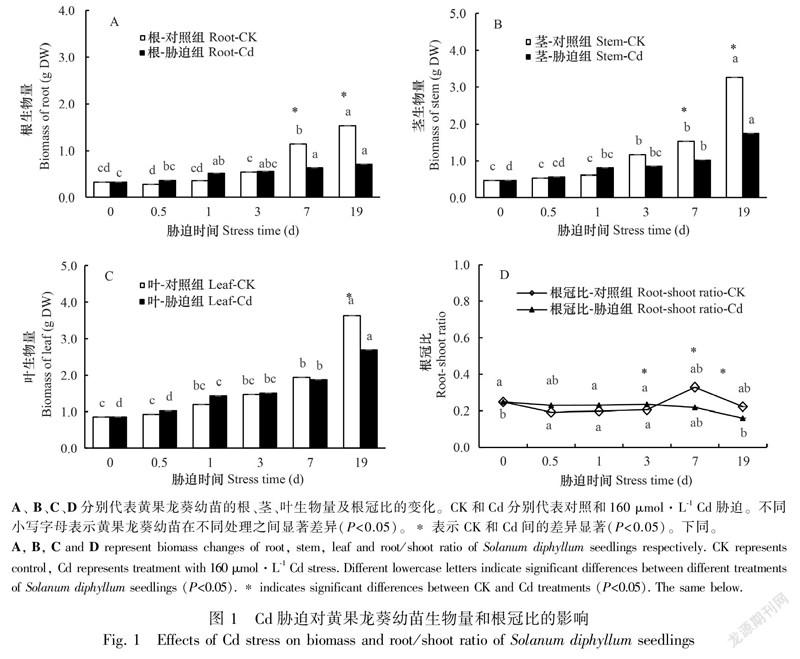
与对照组相比,Cd胁迫下黄果龙葵幼苗的主根长、株高、茎粗和叶数在胁迫小于1 d时略有增加。随胁迫时间延长,植株主根长、株高、茎粗和叶数均低于对照,但除株高外其余指标差异均不显著(P>0.05)。耐性系数(TI)结果显示,TI随Cd胁迫时间增加而逐渐减小,在胁迫19 d时出现最小值0.64(表1)。此外,Cd胁迫显著降低了黄果龙葵幼苗根、茎在胁迫7~19 d的生物量积累,叶的生物量积累在19 d时显著降低(P<0.05)。根、茎和叶的生物量与对照组相比分别降低了44.75%~53.81%、26.94%~46.58%和3.37%~26.10%,其中根系受损最严重,但Cd胁迫并没有明显改变各组分生物量在植株整体的占比,胁迫组和对照组的生物量从大到小均依次为叶>茎>根(图1)。根冠比的单因素分析结果显示,0~3 d时胁迫组和对照组的根冠比较稳定,3~19 d时胁迫组的根冠比有显著的下降趋势(P<0.05),对照组的根冠比有上升趋势但差异不显著(P>0.05)。同时胁迫组与对照组相比,Cd胁迫使3~19 d的根冠比下降(P<0.05)(图1)。结果表明,高浓度Cd在长时间胁迫时会一定程度抑制黄果龙葵幼苗的表观形态生长。
2.2 Cd胁迫对黄果龙葵幼苗Cd含量和积累量的影响
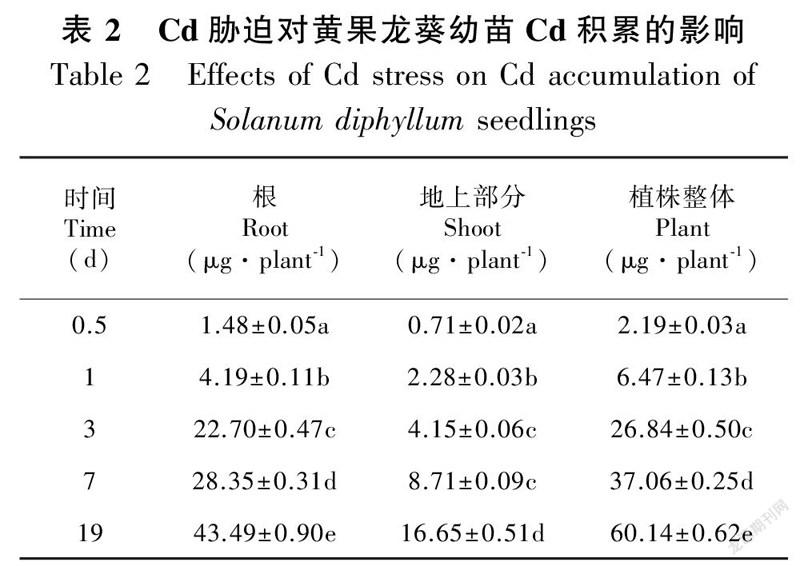
单因素分析结果表明,Cd胁迫下黄果龙葵幼苗的根和地上部分的Cd含量随胁迫时间延长显著增加(P<0.05)。根和地上部分的Cd含量变化范围分别为4.04~61.29 mg·kg和0.44~3.75 mg·kg(图2)。同时,Cd积累量也随胁迫时间延长显著增加(P<0.05),整个过程中根和地上部分的Cd积累量分别占植株整体的64.76%~84.54%和15.46%~35.24%。胁迫19 d时,根系和地上部分的Cd积累量较0.5 d分别显著增加29.39倍和23.45倍(P<0.05)(表2)。结果表明大量的Cd富集于黄果龙葵幼苗的根系。
2.3 Cd胁迫对黄果龙葵幼苗SOD活性的影响
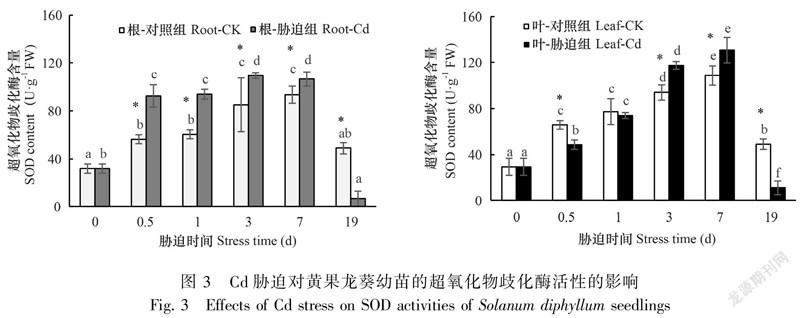
Cd胁迫使黄果龙葵胁迫组和对照组之间的根、叶SOD差异显著(P<0.05),根和叶的SOD均在19 d时低于对照。与对照组相比,Cd在胁迫前7 d顯著增加了根系的SOD活性(P<0.05),增幅范围为13.93%~64.60%,并且根的SOD在0.5 d时显著高于对照组(P<0.05);叶片的SOD活性升高较根系缓慢,其增幅在3 d后显著高于对照组(P<0.05)(图3)。结果表明,高浓度Cd胁迫下,黄果龙葵幼苗能通过迅速提高SOD活性以响应Cd胁迫。
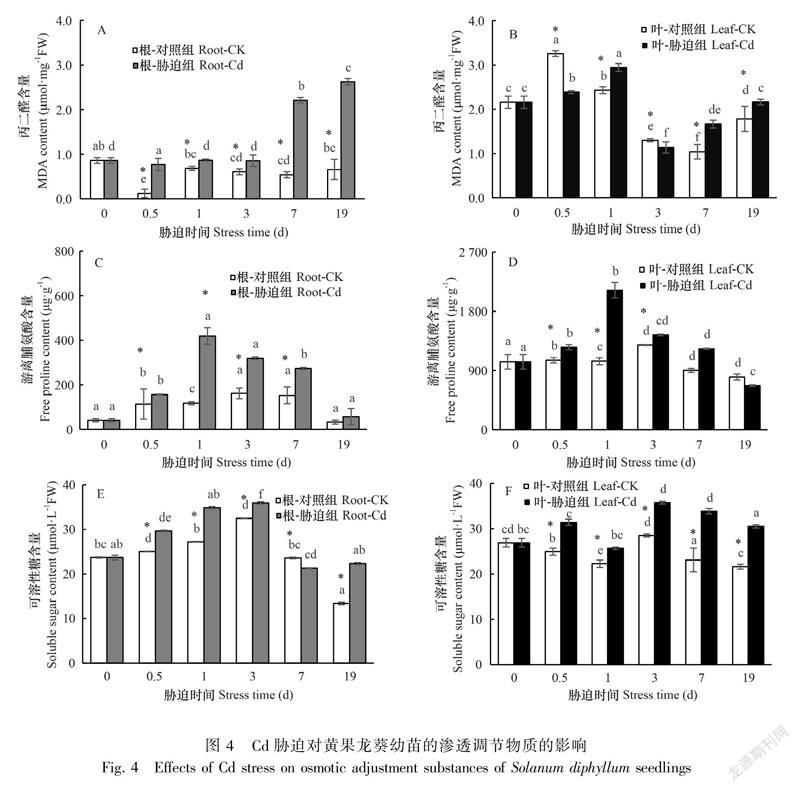
2.4 Cd胁迫对黄果龙葵幼苗渗透调节物质的影响
Cd处理使胁迫组与对照组之间根、叶的渗透调节物质差异显著(P<0.05)。与对照组相比,Cd胁迫使根的MDA含量显著增加(P<0.05),增幅为26.90%~525.62%,根的MDA在Cd处理19 d时达到差异最大值(图4:A)。叶的MDA含量在胁迫7 d后呈显著增加趋势(P<0.05)(图4:B)。与对照组相比,Cd胁迫也使游离脯氨酸含量显著增加(P<0.05)。Cd胁迫下根系的游离脯氨酸含量增幅为37.49%~252.47%,叶片游离脯氨酸的增幅为12.05%~103.26%,叶片的游离脯氨酸含量在胁迫19 d时首次低于对照(图4:C-D)。与对照组相比,Cd胁迫同样也使可溶性糖含量显著增加(P<0.05),根系可溶性糖含量在19 d时出现胁迫组和对照组的最大差值,叶片则在7 d时出现最大差值(图4: E-F)。结果表明,黄果龙葵幼苗的渗透调节物质能够通过一定程度的增加积极响应高浓度的Cd胁迫。
2.5 Cd胁迫对黄果龙葵幼苗光合色素含量的影响
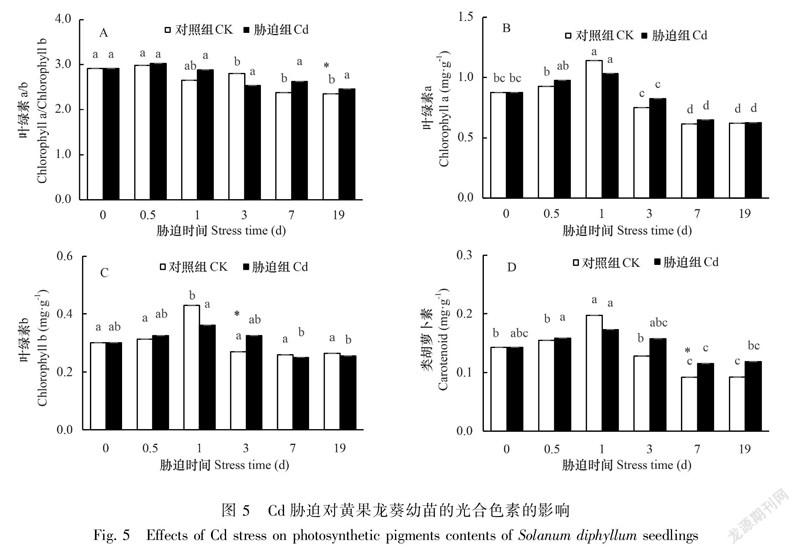
黄果龙葵幼苗的叶绿素a、叶绿素b和类胡萝卜素的含量均呈先升后降的趋势。但组间差异分析显示胁迫组和对照组的叶绿素a差异不显著(P>0.05),叶绿素b仅在3 d时差异显著(P<0.05),类胡萝卜素在7 d时差异极显著(P<0.05),叶绿素a/b在19 d时差异极显著(P<0.05)(图5)。结果表明,高浓度Cd胁迫扰乱了黄果龙葵幼苗的光合色素合成。
2.6 Pearson相关性分析
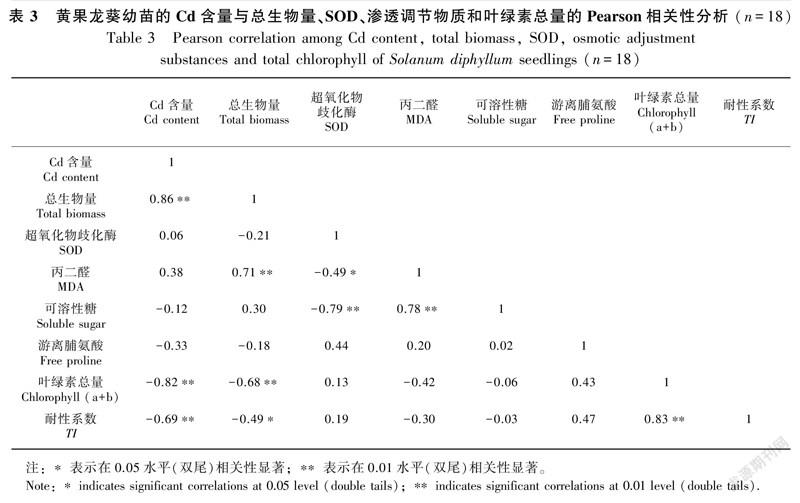
Pearson相关性分析表明,黄果龙葵幼苗的Cd含量与总生物量极显著正相关(P<0.01),与叶绿素总量和TI极显著负相关(P<0.01),但与SOD、MDA、可溶性糖和游离脯氨酸的相关性不显著(P>0.05)(表3)。这表明总生物量、叶绿素总量和TI对黄果龙葵幼苗的Cd积累特性的影响力较强。
3讨论
3.1 Cd胁迫对黄果龙葵幼苗的生理生长影响
Cd对植物的毒害取决于物种和胁迫浓度,存在时间效应(Liu et al., 2020)。研究表明超过植物耐受阈值的Cd胁迫会显著影响植物生长,严重时导致植株死亡,故植株生长的表观形态可以作为评价植物逆境耐受力的指标之一(贾茵等,2020)。本试验中,Cd对黄果龙葵幼苗的毒害症状在脅迫3 d后出现,但仅株高降低差异显著(P<0.05)。黄果龙葵幼苗根系和叶片的生物量降低幅度大,这与Cd胁迫对龙葵(刘柿良等,2015)和小报春(贾茵等,2020)的研究结果一致。究其原因,可能是根细胞壁中的蛋白质、多糖、羟基(-OH)和羧基(-COOH)等物质易于Cd配位结合,大量分布于根系的Cd抑制了根系酶活、细胞分裂和养分吸收,导致根部细胞死亡(Boc'ov et al., 2012),从而使根系出现了生长缓慢、发黄烂根等严重的受损情况。而后Cd通过根系进入植物地上部分,与叶绿体酶的硫基(-SH)等结合,破坏叶绿体机构,使植株叶片黄化掉落。与对照组相比,正常进行光合作用的叶片大量减少,从而直接影响植物物质积累。本试验中胁迫小于1 d时,胁迫组的主根长、株高、茎粗、叶片数及生物量与对照相比有一定程度的增加,但不显著(P>0.05)。这可能有两方面原因:一是由于黄果龙葵的某种“保护机制”,在一定程度内增强各种生理反应以抵抗Cd毒害,如研究证明茅苍术(孙永娣等,2018)和小报春(贾茵等,2020)在短时间的Cd胁迫下会增强光合作用以缓解毒害;二是因为“Hormesis”兴奋效应,短时间内黄果龙葵幼苗吸收的Cd有限,少量的Cd促进了植物生长(Carvalho et al., 2020)。Cd胁迫在3~19 d显著降低了黄果龙葵幼苗的根冠比,说明经过一定时间的高浓度Cd胁迫后,根的生物量降低幅度更大,根系对Cd更敏感。本研究结果与郭智等(2009)对超富集植物龙葵的根冠比研究结论相似;而与刘柿良等(2015)对白车轴草的研究结论相悖,他们认为Cd胁迫下植物提高根冠比有利于获取养分以维持生长。此外,我们还测定了黄果龙葵的TI,试验期间,黄果龙葵TI最小值为0.64(19 d)。Lux等(2004) 定义Cd胁迫下TI>0.60的植物为高耐受植物,因此,本试验结果表明,黄果龙葵幼苗对高浓度Cd胁迫具有较高的耐受性。
3.2 Cd胁迫对黄果龙葵幼苗的Cd吸收和分布影响
本研究结果表明,不同胁迫时间显著影响黄果龙葵幼苗的Cd吸收,其含量和积累量均随胁迫时间延长而增加(P<0.05)。Cd在黄果龙葵幼苗根和地上部分的分布差异明显,植株整体和地上部分的最大Cd含量分别为11.69 mg·kg和3.75 mg·kg。由于试验设置的不同,不同植物的Cd富集情况存在差异。与其他植物相比,黄果龙葵的Cd含量低于Cd的超富集植物,如忍冬在25 mg·kg Cd胁迫处理下地上部分Cd含量达300 mg·kg(刘周莉等,2013),滇苦菜在10 μmol·L Cd胁迫处理下地上部分Cd含量达270 mg·kg(汤叶涛等,2010)。但高于同科属植物,如高Cd积累品种番茄在3 mg·kg Cd胁迫处理下植株Cd含量达3.06 mg·kg(杨佳敏等,2021)。
植物重金属积累量取决于植物组织的重金属含量和生物量,重金属积累量是衡量植物是否适用于植物修复技术实践的重要指标之一,反映了植物的重金属提取能力。试验期间,黄果龙葵幼苗地上部分的Cd积累总量逐渐增大,这有利于植物修复技术过程中污染物的去除;黄果龙葵幼苗的最大Cd积累量为60.14 μg·plant,高于Sun等(2007) 研究中同科属的植物茄子(S. nelongena)(11 μg·plant)和超富集植物龙葵(46 μg·plant),表明黄果龙葵具有较强的Cd积累能力。这是因为较大的生物量使得黄果龙葵幼苗拥有较高的Cd积累量,同时Pearson相关性分析也表明,Cd含量和总生物量之间极显著正相关(P<0.01)。根是植物与土壤直接接触的重要器官,对重金属具有截留作用,能够通过如类金属硫蛋白(MTs)、植物螯合肽(PCs)或谷胱甘肽(GSHs)等的螯合作用以减轻毒害。本试验中根是黄果龙葵幼苗Cd积累量最大的部位,其吸收分布结果与小报春(贾茵等,2020)和水稻(Srivastava et al., 2014)的研究相似,但异于龙葵和少花龙葵等超富集植物。这表明黄果龙葵并不具备将大量Cd有效转移至地上部位的能力,但能将大量的Cd截留固定于根系,说明根系的固持可能是黄果龙葵缓解Cd毒害的机制之一。
3.3 Cd胁迫对黄果龙葵幼苗SOD和渗透调节物质的影响
一般而言, 严重的Cd胁迫会破坏植物细胞结构,当植物细胞膜组成、结构和透性发生改变时,细胞膜外的有毒物质即可进入细胞。植物为抵抗胁迫会产生渗透调节物质进行响应,当植物的抗氧化系统平衡被破坏后,过量ROS的积累会加重细胞膜脂过氧化程度,甚至导致细胞死亡(Muradoglu et al., 2015)。丙二醛(MDA)是细胞膜脂过氧化的主要产物之一,其含量的高低可以反映膜脂过氧化程度并且能进一步加剧膜系统损伤(罗巧等,2019)。本试验中,Cd胁迫使黄果龙葵幼苗的根、叶MDA含量显著上升,说明此时黄果龙葵体内膜脂过氧化程度加重,膜系统损伤加重,影响碳代谢途径。这与水蓼的MDA对Cd胁迫的响应相似(葛依立等,2020)。根系的MDA含量增加更快更显著,可能是因为大部分的Cd被截留固持在根部,高浓度的Cd胁迫使得根部ROS的产生效率高于清除效率。SOD是植物抗氧化保护系统的第一道防线,研究表明当植物受到逆境胁迫时,SOD催化O转化为O和HO,能在一定范围内维持活性氧的平衡,以适应Cd胁迫。通常的,SOD活性会随胁迫程度加重而增加,但调节能力有限。高浓度Cd胁迫下SOD的缓解能力会受到限制,究其原因可能是由于Cd与Mn、Cu、Zn的相似性,Cd能取代Mn-SOD、Cu-SOD和Zn-SOD的金属辅基,从而导致SOD的活性氧清除能力降低。此外,Cd同样能与SOD的-SH结合,破坏催化中心。本试验中,Cd胁迫使SOD呈先增后降的变化趋势,表明短时间内Cd胁迫能够诱导黄果龙葵幼苗SOD活性增加,这能够在一定程度上缓解Cd毒害。但长时间的胁迫毒害超出SOD对O的正常歧化能力范围,从而破坏了黄果龙葵细胞膜的完整性和酶系统。游离脯氨酸和可溶性糖是植物维持渗透调节的主要成分(张东等,2020)。游离脯氨酸能增加蛋白质水合作用,为植物应对胁迫提供能量。可溶性糖是植物合成有机溶质的基础和能量来源。它们的积累能够降低细胞水势,维持细胞膨压和细胞膜的完整性,对于增强植物抗逆能力具有重大意义。已有研究表明,脯氨酸浸泡黄瓜种子可增强Cd耐性(Semida et al., 2018),水稻的脯氨酸含量會随Cd胁迫增强而增加(Majumdar et al., 2018),刺槐在Cd胁迫下可溶性糖含量也增加(Jia et al., 2017)。但植物渗透调节能力亦有限,当超过一定限度该调节能力即降低。本试验中,Cd胁迫显著增加了黄果龙葵脯氨酸和可溶性糖的含量,说明黄果龙葵可能通过提高渗透调节物质积累,从而维持原生质胶体的稳定性和细胞膜的完整性,以此缓解Cd胁迫对代谢产生的不利影响。但是,它们随胁迫时间的增加先升高后降低,这可能是因为到胁迫后期,Cd毒害严重,黄果龙葵膜脂过氧化程度加重,细胞膜破裂,脯氨酸和可溶性糖的合成减少,渗透调节减轻Cd毒害的作用开始逐步减弱。
3.4 Cd胁迫对黄果龙葵幼苗的光合色素的影响
植物进行光合作用的基础是光合色素。有研究表明严重的Cd胁迫会破坏叶绿体结构,影响光合色素的合成,扰乱植物生长(Parmar et al., 2013);同时也有研究表明一定程度的Cd胁迫可增强植物的光合作用(孙永娣等,2018;贾茵等,2020)。与对照组相比,各时间点除1 d外,叶绿素a、b和类胡萝卜素含量均有一定程度上升,但仅叶绿素b在3 d时和类胡萝卜素在7 d时差异显著。光合色素的上升可能是植物生长发育的结果,也可能是因为黄果龙葵幼苗为缓解Cd毒害需要更多能量,而光合作用是有机物积累的直接来源,所以促进了叶绿素a、叶绿素b和类胡萝卜素等的合成。光合色素的下降则可能是因为黄果龙葵体内钙二信使的非生物逆境信号转导被阻碍。钙调蛋白CAM能将Cd胁迫转化为植物的感知信号,启动下游蛋白质的磷酸化或去磷酸化,调节光形态建成等生理过程。但Cd与Ca的相似性可能会使Cd竞争Ca载体蛋白和通道,扰乱下游信号转导过程,从而使叶绿素的合成减少。Cd与叶绿素酶的结合也会加速其分解。同时,胁迫组的叶绿素a/b在19 d较对照组有显著增加,说明此时叶片中叶绿素b对Cd胁迫更加敏感。
4结论
黄果龙葵幼苗在160 μmol·L Cd胁迫下,其MDA含量、Cd含量和Cd积累量均随胁迫时间增加而增加,根系是Cd吸收最多的部位;SOD活性、渗透调节物质(游离脯氨酸和可溶性糖)、光合色素(叶绿素a、叶绿素b和类胡萝卜素)含量都呈先升高后降低的趋势,其生理生长指标和TI的变化结果共同显示黄果龙葵拥有较强的Cd忍耐性,渗透调节和根系固持可能是黄果龙葵缓解Cd毒害的部分机制。综上,黄果龙葵能在一定程度耐受高浓度的160 μmol·LCd胁迫,是一种潜在的Cd忍耐植物。
参考文献:
ALI H, KHAN E, SAJAD M, 2013. Phytoremediation of heavy metals-concepts and applications [J]. Chemosphere, 91(7): 869-881.
BOC'OVĆ B, HUTTOVÁ J, LIPTÁKOVÁ L, et al., 2012. Impact of short-term cadmium treatment on catalase and ascorbate peroxidase activities in barley root tips [J]. Biol Plant, 56(4): 724-728.
BARKER A, BROOKS R, 1989. Terrestrial higher plants which hyperaccumulate metallic elements — a review of their distribution, ecology and phytochemistry [J]. Biorecovery, 1(2): 81-126.
CARVALHO M, CASTRO P, AZEVEDO R, 2002. Hormesis in plants under Cd exposure: from toxic to beneficial element [J]. J Hazard Mat, 384(2): 121434-121443.
EL-SAYED M, MOHAMED A, HASSAN M, et al., 2009. Cytotoxicity of 3-O-(β-D-glucopyranosyl) etioline, a steroidal alkaloid from Solanum diphyllum L. [J]. Z Naturforsch C, 64(9-10): 644-649.
FENG JX, LIN YY, YANG Y, et al., 2018. Tolerance and bioaccumulation of Cd and Cu in Sesuvium portulacastrum [J]. Ecotoxicol Environ Safety, 147(8): 306-312.
GUO Z, WANG T, AO YS, 2009. Physiological responses of Solanmu nigrum L. seedling to cadmium stress [J]. J Agro-Environ Sci, 28(4): 755-760. [郭智, 王濤, 奥岩松, 2009. 镉对龙葵幼苗生长和生理指标的影响 [J]. 农业环境科学学报, 28(4): 755-760.]
HARIRI M, IRSYAM A, 2018.Catatan tentang Solanum diphyllum L. (Solanaceae) ternaturalisasi di Pulau Jawa [J]. Al-Kauniyah, 11(1): 25-32.
JIA X, ZHAO YH, LIU T, et al., 2017. Leaf defense system of Robinia pseudoacacia L. seedlings exposed to 3 years of elevated atmospheric CO2 and Cd-contaminated soils [J]. Sci Total Environ, 605-606(10): 48-57.
JIA Y, LIU CL, LAN XY, et al., 2020. Effect of cadmium stress on the growth and physiological characteristics of Primula forbesii seedlings [J]. Acta Bot Boreal-Occident Sin, 40(3): 454-462. [贾茵, 刘才磊, 兰晓悦, 等, 2020. 镉胁迫对小报春幼苗生长及生理特性的影响 [J]. 西北植物学报, 40(3): 454-462.]
LIU QQ, ZHANG YX, WANG YJ, et al., 2020. Quantitative proteomic analysis reveals complex regulatory and metabolic response of Iris lactea Pall. var. chinensis to cadmium toxicity [J]. J Hazard Mat, 400(7): 1-13.
LUX A, ANNA S, JANA O, et al., 2004. Differences in structure of adventitious roots in Salix clones with contrasting characteristics of cadmium accumulation and sensitivity [J]. Physiol Plant, 120(4): 537-545.
LIU SL, YANG RJ, MA MD, et al., 2015. Effects of cadmium stress on growth, cadmium content and nutrient distribution in Trifolium repens L. plants [J]. Acta Agric Nucl Sin, 29(3): 595-604. [刘柿良, 杨容孑, 马明东, 等, 2015. 镉胁迫对白车轴草生长、镉含量及养分分配的影响 [J]. 核农学报, 29(3): 595-604.]
LIU SL, YANG RJ, MA MD, et al., 2015. Effects of soil cadmium on growth and physiological characteristics of Solanum nigrum L. plants [J]. J Agro-Environ Sci, 34(2): 240-247. [刘柿良, 杨容孑, 马明东, 等, 2015. 土壤镉胁迫对龙葵 (Solanum nigrum L.) 幼苗生长及生理特性的影响 [J]. 农业环境科学学报, 34(2): 240-247.]
LIU ZL, HE XY, CHEN W, 2013. Lonicera japonica Thunb.—A newly discovered Cd hyper-accumulator [J]. Ecol Environ Sci, 22(4): 666-670. [劉周莉, 何兴元, 陈玮, 2013. 忍冬——一种新发现的镉超富集植物 [J]. 生态环境学报, 22(4): 666-670.]
LUO Q, WU MX, LONG Y, et al., 2019. Changes in photosynthesis and Cd accumulation characteristic of Malva pusilla Smith under different concentrations of Cd [J]. Acta Agric Nucl Sin, 33(7): 1415-1422. [罗巧, 邬梦晞, 龙月, 等, 2019. 圆叶锦葵对Cd处理的光合生理响应及Cd富集特征 [J]. 核农学报, 33(7): 1415-1422.]
MAJUMDAR S, CHAKRABORTY B, KUNDU R, 2018. Comparative analysis of cadmium-induced stress responses by the aromatic and non-aromatic rice genotypes of West Bengal [J]. Environ Sci Poll Res, 25(19): 18451-18461.
MURADOGLU F, GUNDOGDU M, ERCISLI S, et al., 2015. Cadmium toxicity affects chlorophyll a and b content, antioxidant enzyme activities and mineral nutrient accumulation in strawberry [J]. Biol Res, 48(1): 1-7.
Ministry of Environmental Protection of PRC, Ministry of Land and Resources of PRC, 2014. Bulletin of national survey on soil pollution [R]. Beijing: Ministry of Environmental Protection of PRC & Ministry of Land and Resources of PRC, 2014(5): 10-11. [中华人民共和国环境保护部, 国土资源部, 2014. 全国土壤污染状况调查公报 [R]. 北京: 中华人民共和国国家环境保护部和中华人民共和国国土资源部, 2014(5): 10-11.]
PANDEY A, PRADHEEP K, GUPTA R, 2018. Two-leaf nightshade (Solanum diphyllum L.) an addition to the flora of Delhi, India and weed risk assessment of the species [J]. Ind J Plant Genet Resour, 31(2): 164-168.
PARMAR P, KUMARI N, SHARMA V, 2013. Structural and functional alterations in photosynthetic apparatus of plants under cadmium stress [J]. Bot Stud, 54(1): 45-51.
SEMIDA WM, HEMIDA KA, RADY MM, 2018. Sequenced ascorbate-proline-glutathione seed treatment elevates cadmium tolerance in cucumber transplants [J]. Ecotoxicol Environ Safety, 154(6): 171-179.
SINGH P, SIGNGH PR, SINGH A, et al., 2019. In vitro evaluation of phytochemical and antibacterial activity of wild species of Solanum L. [J]. Iosr-Jbb, 5(1): 81-87.
SINGH S, PARIHAR P, SINGH R, et al., 2016. Heavy metal tolerance in plants: role of transcriptomics, proteomics, metabolomics, and ionomics [J]. Front Plant Sci, 6(2): 1143-1179.
SRIVASTAVA RK, PANDEY P, RAJPOOT R, et al., 2014. Cadmium and lead interactive effects on oxidative stress and antioxidative responses in rice seedlings [J]. Protoplasma, 251(5): 1047-1065.
SUN RL, ZHOU QX, SUN FH, et al., 2007.Antioxidative defense and proline/phytochelatin accumulation in a newly discovered Cd-hyperaccumulator, Solanum nigrum L. [J]. Environ Exp Bot, 60(3): 468-476.
SUN YD, CHAO JG, GU W, et al., 2018. Effect of cadmium stress on physiological and biochemical characteristics of Atractylodes lancea [J]. J Plant Physiol, 54(12): 1857-1864. [孙永娣, 巢建国, 谷巍, 等, 2018. 镉胁迫对茅苍术生理生化特征的影响 [J]. 植物生理学报, 54(12): 1857-1864.]
TANG YT, GUAN LJ, CHOU RL, et al., 2010. Antioxidative defense to cadmium in hyperaccumulator Picris divaricate V. [J]. Acta Ecol Sin, 30(2):324-332. [汤叶涛, 关丽捷, 仇荣亮, 等, 2010. 镉对超富集植物滇苦菜抗氧化系统的影响 [J]. 生态学报, 30(2): 324-332.]
WANG QP, SHEN W, ZHANG K, et al., 2019. Hypochaeris albiflora and Solanum diphyllum, two newly naturalized plants in mainland China [J]. Guihaia, 39(12): 1724-1728. [王秋萍, 沈微, 张坤, 等, 2019. 白花猫儿菊和黄果龙葵——中国大陆两种新归化植物 [J]. 广西植物, 39(12): 1724-1728.]
WANG WL, 2014. New plant physiology experiment guide [M]. Beijing: Xinhua Publishing House: 35-136. [王文龙, 2014. 新编植物生理学实验指导 [M]. 北京: 新华出版社: 35-136.]
WU CF, HUAN YM, LIU Y, et al., 2020. Effects of intercropping with two Solanum species on the growth and cadmium accumulation of Cyphomandra betacea seedlings [J]. Int J Phytoremediat, 5(12): 1-7.
WU FZ, YANG WQ, ZHANG J, et al., 2010. Cadmium accumulation and growth responses of a poplar (Populus deltoids × Populus nigra) in cadmium contaminated purple soil and alluvial soil [J]. J Hazard Mat, 177(1-3): 268-273.
WU MX, LUO Q, LIU SL, et al., 2018. Screening ornamental plants to identify potential Cd hyperaccumulators for bioremediation [J]. Ecotoxicol Environ Safety, 162(1): 35-41.
XU J, SUN JH, DU LG, et al., 2012. Comparative transcriptome analysis of cadmium responses in Solanum nigrum and Solanum torvum [J]. New Phytol, 196(1): 110-124.
XU XF, ZHANG HY, YUAN QH, et al., 2004. Studies on chromosome of three types of Solanum nigrum in China [J]. Guihaia, 24(6): 544-545. [徐秀芳, 张海洋, 袁秋红, 等, 2004. 中国龙葵复合种三类型的染色体数目研究 [J]. 广西植物, 24(6): 544-545.]
YANG JM, HE XGDL, WAN JY, et al., 2021. Screening of tomato cultivars in cadmium-polluted areas and study on their antioxidant capacity [J]. Chin J Biotechnol, 37(1): 242-252. [杨佳敏, 贺希格都楞, 万家悦, 等, 2021. 镉污染地区番茄品种的筛选及其抗氧化能力的研究 [J]. 生物工程学报, 37(1): 242-252.]
ZHANG XF, XIA HP, LI ZA, et al., 2011. Identification of a new potential Cd-hyperaccumulator Solanum photeinocarpum by soil seed bank-metal concentration gradient method [J]. J Hazard Mat, 189(1): 414-419.
ZHANG D, LIU Y, ZHANG H, et al., 2020. Response of osmotic regulators and sucrose metabolization-related enzymes to drought stress in Glycyrrhiza uralensis [J]. Acta Bot Boreal-Occident Sin, 40(5): 819-827. [張东, 刘艳, 张晗, 等, 2020. 甘草叶片渗透调节物质及蔗糖代谢相关酶对干旱胁迫的响应特性 [J]. 西北植物学报, 40(5): 819-827.]
(责任编辑李莉)
