生活饮用水中细菌总数检测的方法比较与应用
2022-05-12郑亦舟
郑亦舟
(上海浦东威立雅自来水有限公司,上海 200127)
近年来,随着人们生活品质的不断提高,对高品质饮用水的需求也愈加迫切,而饮用水中生物安全性指标是保证饮用水品质的重要一环。2018年1月4日,上海市政府发布的《上海市城市总体规划(2017—2035年)》提出“提高入户水质,满足直饮需求”。相应供给端的检测市场对于生活饮用水中微生物指标检测方法的研究也随着需求提升不断开展,各种产品化的检测试剂盒也是层出不穷。其中,供水企业常用的水中细菌总数检测方法有异养菌平板计数法(heterotrophic plate count,HPC)、酶底物法以及ATP生物荧光检测法。《生活饮用水卫生标准》(GB 5749—2006)中生活饮用水的菌落总数限值规定为<100 CFU/mL。通过样品在营养琼脂上有氧条件培养,对所得水样中含菌落的数量进行计数,以反映水中微生物的生长情况。由于培养温度高、培养时间相对短,营养琼脂HPC方法具有一定局限性,很多报道中会用R2A HPC检测异养菌数量来代替营养琼脂HPC检测样品中的微生物水平,通过一种低营养含量的培养基(R2A培养基),配合较低的培养温度和延长的培养时间,以获得更加适用于生活饮用水中微生物实际水平的检测结果[1-3]。
酶底物法(defined substrate technology,DST)在生活饮用水的检测中多被研究应用于总大肠菌群和嗜肺军团菌的检测,其灵敏度更高、操作流程简单,具有很好的应用前景[4-5]。该方法通过选择性培养基来对产生某种酶的细菌群组进行检测。但在细菌总数的检测中应用较少,理论上它可以通过选择性培养基分解色原底物从而释放色原体,使培养基呈现颜色变化,通过计数变色的孔径数量来检测水中的细菌总数。因此,酶底物法在生活饮用水细菌总数检测中的应用及其与培养法的对比是值得研究的课题。
三磷酸腺苷(ATP)生物发光法检测:ATP是细菌、藻类、植物和动物细胞等所有生命形式的主要能量载体,测量样品中ATP的浓度可以获得微生物浓度和其健康状况的关键数据。20世纪70年代中期该技术逐渐形成并产生,ATP可以存在于活性微生物细胞内(cATP,胞内ATP)和游离在细胞以外(dATP、胞外ATP),通过使用照度计来测量ATP和萤光素酶催化反应的发光强度(RLU)来进行样品中ATP浓度的定量分析。目前,已有研究表明微生物浓度和ATP含量之间存在相互关系,可以通过ATP浓度的测定来反映细菌浓度的实际情况[6]。将ATP生物荧光法用于生活饮用水中细菌总数的检测须通过膜过滤富集,同时适当添加缓冲剂、荧光剂等[7],其应用场景和检测过程的便捷性是检测市场十分关注的问题。
本文从水质检测实验室细菌总数检测方法应用的角度,通过4种生活饮用水细菌总数检测方法分别对标准物质样品、水源水样品及出厂水样品进行对比检测,以探究各检测方法所适用的检测场景,以期对高品质饮用水的保障手段进行探讨。
1 材料与方法
采集上海浦东某水厂出厂水样品和水源水样品,采购IDEXX菌落总数质控样品(产品编号:HPCQC,批号:200820),采用营养琼脂培养基(PCA)、R2A培养基、ATP试剂盒以及IDEXX SimPlate复合酶底物来对样品进行检测。
使用121 ℃下灭菌20 min的玻璃细菌瓶,预先加入少量摩尔浓度为0.001 mol/L的Na2S2O3中和出厂水中的余氯。秉持无菌操作的原则对采样龙头进行消毒后,采集水源水样和出厂水样。质控样品按照标准样品说明书制备。
1.1 培养基的成分
PCA:蛋白胨10 g、牛肉膏3 g、氯化钠5 g、琼脂10~20 g、蒸馏水1 000 mL。pH值控制在7.4~7.6,在103.43 kPa(121 ℃,20 min)下灭菌后,分装待用。
R2A培养基:酵母浸出粉0.5 g、蛋白胨0.5 g、酪蛋白水解物0.5 g、葡萄糖0.5 g、可溶性淀粉0.5 g、磷酸氢二钾0.3 g、无水硫酸镁0.024 g、丙酮酸钠0.3 g、琼脂15.0 g。pH值控制在7.4~7.6,在103.43 kPa(121 ℃,20 min)下灭菌后,分装待用。
1.2 检测方法的选择
菌落总数的检测:按照《生活饮用水标准检验方法微生物指标》(GB/T 5750.12—2006)1.1节平皿计数法的检验步骤,将水样在营养琼脂上有氧条件37 ℃培养48 h后,测量所得1 mL水样所含菌落的总数。
异养菌计数法的检测:分别用平板倾注法和平板涂布法将水样在R2A培养基上有氧条件(25 ℃)培养7 d后,测量所得1 mL水样所含异养菌菌落的总数。
酶底物法的检测:将水样加入SimPlate培养基,混匀后加入SimPlate定量盘使之装满所有的孔槽;倒置培养定量盘在(36±1) ℃培养48 h;于紫外灯下读取荧光的孔格,对照MPN表读取检测结果。
ATP生物荧光法的检测:将50 mL水样经过富集后的过滤器萃取液放入测试管,加入试剂盒配套的荧光素酶试剂,再加入稀释液后旋转摇匀并在10 s内读数;该结果减去空白值后记为样品中ATP发光强度,从而用于ATP的定量分析。
2 结果与讨论
2.1 微生物培养法对不同来源样品的检测结果
基于菌落培养原理对生活饮用水中的生物稳定性进行评价的3种方法分别是营养琼脂HPC检测方法、R2A HPC倾注检测方法、R2A HPC涂布检测方法。表1罗列了应用这3种培养方法对同一标准物质样品、水源水样品及出厂水样品检测的结果。其中,出厂水样品为生活饮用水检测实验室中常见的低浓度样品,标准物质样品的细菌总数控制在102CFU/mL数量级代表中等浓度样品,水源水样品为生活饮用水检测实验室中常见的高浓度样品。首先,对于已知浓度的标准质控样品,3种方法的检测结果都在其真值的2倍标准偏差可接受范围内,都能较好地反映水样中异养菌含量。其次,3种检测方法对中低高这3个浓度梯度样品的检测结果呈现一致性的大小排序,HPC涂布法检测结果略高于HPC倾注法检测结果,HPC倾注法检测结果略高于平皿计数法,但基本在同一数量级上。造成该结果的原因可能是HPC倾注法与HPC涂布法取样量的差异,倾注法的取样量是涂布法的10倍,因此,检测结果为乘以差异的倍数来计数最终的报告结果,其中无法排除取样量的不同而造成的结果影响。另外,温度在45 ℃左右的培养基在倾注的过程中会将某些好氧菌灭活或者会被覆盖在培养基的中间区域,在培养过程中无法生长为菌落参与结果计数,造成结果偏低。
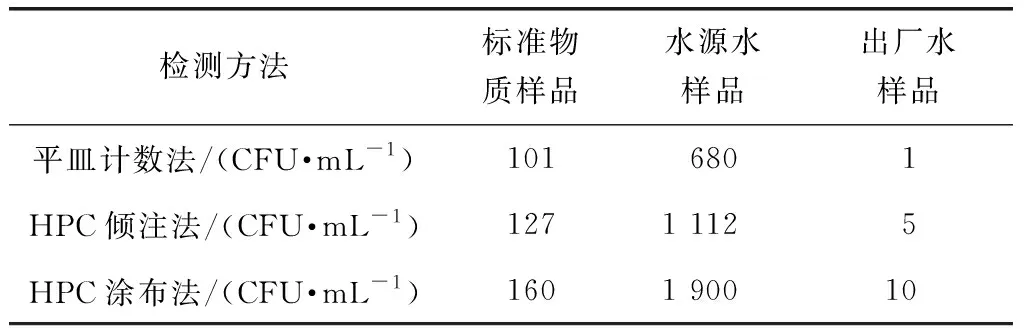
表1 培养法检测各样品结果Tab.1 Results of Each Sample Tested by Culture Method
平皿计数法与HPC计数法相比,培养基、培养时间和培养温度均不同。HPC计数法通过低营养含量配合更长的培养时间和较低的温度,使其生长的环境更接近生活饮用水,从而能够对饮用水中的一些受抑制的耐氯菌、假单胞菌等有更好的检出限和灵敏性[8]。因此,平皿计数法在较高温度和较短时间条件下,培养产生的菌落数低于HPC计数法贫营养培养基在低温和长时间下培养的菌落数。对于生活饮用水样品而言,菌落数较少,HPC计数法具有更高的灵敏度,更能反映水样中真实的生物稳定性变化。
综合3种培养方法的检测结果,R2A HPC涂布法在25 ℃下,培养7 d,所得的1 mL样品所含的菌落总数结果具有更高的灵敏性,能够更真实地反映水样中的微生物生长情况。
2.2 酶底物法对不同来源样品的检测结果
实际应用酶底物法检测生活饮用水中细菌总数的最大难点,在于其检测原理与结果计数方法和培养法完全不同而导致最后结果的表示方式不同,酶底物法的计数结果以统计学概念中最大可能数(MPN/mL)来表示,而培养法的计数结果以菌落形成数(CFU/mL)来表示。基于检测原理的限制,两类方法的检测结果不能完全等同比较。对不同来源样品的检测结果如表2所示,对于已知浓度的标准质控样品,酶底物法的检测结果能够落在其真值的3倍标准偏差可接受范围内,能够定量地反映水样中异养菌数量。对于水源水和出厂水样品,虽然计数结果表示方式不同,但其检测结果都能够和培养法在同一数量级上,最大可能数的取值整体会高于菌落生成数的数量。在实际检测市场中,由于生活饮用水国家标准的微生物指标限值由CFU/mL来计数,在一定程度上限制了酶底物法在部分市场中的应用。不过该方法有其显著的优势和适用场景,将会在下文进一步讨论。

表2 酶底物法检测各样品结果Tab.2 Result of Each Sample Detected by Enzyme Substrate Method
2.3 ATP检测法对不同来源样品的检测结果
应用ATP生物荧光法对不同来源样品的检测结果如表3所示,该方法通过使用照度计来测量ATP和萤光素酶催化反应产生的RLU,因此,所得的定量值为荧光发光的强度,间接定量计算出生活饮用水中每毫升样品ATP的含量。而本文中第二代ATP检测方法在检测生活饮用水时的富集和过滤阶段将<0.45 μm的游离ATP或溶解ATP去除在过滤器之外,因此,由过滤器萃取液中检测所得的ATP含量是cATP,更能反映生活饮用水内的微生物含量。此法的检测结果表示与酶底物法有同样的应用难点问题,由于检测原理的限制所得结果与培养法和酶底物法所得的检测结果只能在趋势性和相关性上找到一些联系,从而进行快速的判断与分析。以文中生活饮用水样品中标准物质样品的检测结果来看,ATP生物荧光检测法与营养琼脂HPC检测法之间的关系式为y=12.30x2-130.11x+247.58,相关性判定系数R2为0.821 8,具有一定的相关性。ATP生物荧光检测法与培养法之间的结果相关性研究也是国内外细菌总数检测应用研究的热点[9]。国内生活饮用水检测的多数标准和限值是以菌落总数平皿计数法的结果作为基准来衡量生活饮用水的生物安全性,但是该方法存在明显的滞后性,对于生活饮用水这样无时无刻在被使用及流动的物质而言,ATP生物荧光法此类有着较短检测时间和简易操作过程的检测方法也有一定的市场需求,有其得天独厚的检测优势。

表3 ATP生物荧光法检测各样品结果Tab.3 ATP Method Test Results of Each Sample
2.4 各检测方法检测过程比较与适用场景讨论
各检测方法检测过程的比较结果如表4所示。在方法依据上营养琼脂HPC检测法是国内主流的检测生活饮用水中微生物指标的方法,其他的3种检测方法的使用范围有限,数据量积累不多,但都有其比较明显的优势。酶底物法与ATP生物荧光法在人员要求和环境要求上只需简单的培训后在现场或户外场地即可进行试验操作,省去了人员培训的周期和场地的限制,大大增加了细菌总数检测的机动性和应急性。除此之外,ATP生物荧光法的检测时间可以控制在5 min之内出具结果,检测仪器较小、携带方便。但是其检测成本耗材价格较高,单次检测成本为培养法的数十倍,且无法将ATP的来源加以区分,也不能识别微生物的种类。有时样品或ATP提取剂等来源的某些离子会对ATP的测定造成干扰和抑制发光作用,其灵敏度仍不能满足某些样品的直接检测要求。因此,在检测低浓度微生物时,检测结果不够准确[9],产生假阳性的可能性较大[10],需结合其他技术辅助检测进一步验证。而对于浓度较高的样品,例如水源水样品,其检测结果中ATP含量可能有一部分是源于其他微生物甚至是动物或植物细胞,这时造成检测结果偏高的值是不可忽略不计的,这也是ATP检测结果会与实际样品中存在的细菌真值出现较大误差的重要原因之一。目前水质应急事件保障过程中,可行的方案是同步采集水样,采用菌落总数平皿计数法和ATP生物荧光法检测,先根据ATP生物荧光法检测结果进行一些时效性高的应急处理措施。随后水样的微生物指标达标与否需参考菌落总数平皿计数法的结果与国家标准进行符合性判定。而酶底物法可能应用的场景是移动实验室等无法很好地保证环境无菌的情况下对生活饮用水中微生物含量的检测,能够尽可能避免环境污染,保证检测结果的有效性。

表4 各检测方法检测过程比较Tab.4 Comparison of the Detecting Process of Each Detection Method
3 结论
通过应用不同检测方法分别对标准物质样品和上海浦东某水厂样品进行微生物指标的检测,ATP生物荧光检测方法检测效率最高,平均单个样品检测时间为5 min,且操作简单,适用于水质应急事件等时效性要求较高的突发事件的现场处理。在实际市场应用时,根据不同水质检测需求可配套使用多种其他检测方法。培养法中R2A HPC涂布检测方法对生活饮用水中微生物指标的检测灵敏性更高,但检测周期较长、人员和环境要求严格,在实际市场应用时需根据检测需求配套使用其他检测方法。酶底物法可用于移动实验室等无法很好地保证环境无菌情况下的细菌总数检测。
