术前增强CT在评估结直肠癌微卫星不稳定性中的价值
2022-05-12王慧慧许泽艳彭海恩梁长虹刘再毅
王慧慧,赵 可,许泽艳,3,彭海恩,梁长虹,刘再毅
1.汕头大学医学院影像医学与核医学专业,广东 汕头 515041;
2.广东省人民医院(广东省医学科学院)放射科,广东 广州 510080;
3.华南理工大学医学院生物医学工程专业,广东 广州 510006
结直肠癌(colorectal cancer,CRC)发病率居全世界恶性肿瘤的第3位,死亡率居全球第2位[1]。微卫星不稳定性(microsatellite instability,MSI)由错配修复基因发生缺陷所致,在CRC中占比10%~20%[2-3]。与微卫星稳定性(microsatellite stability,MSS)患者相比,MSI患者能从免疫治疗中获益,且预后更好。目前,临床上可通过基于病理组织标本的免疫组织化学方法、聚合酶链式反应及二代测序对CRC患者的MSI状态进行测定,但因其均依赖于有创操作所获取的组织标本,且检测费用较高[4],MSI状态并未在CRC患者中普遍检测。如果能在术前通过简单、无创的方式评估CRC患者MSI状态,就能对MSI患者进行初筛,进而协助指导治疗和评估预后。
术前影像学检查作为CRC诊断和分期的重要检查方法,在临床中广泛应用。已有研究[5-10]通过基于计算机体层成像(computed tomography,CT)或磁共振成像的影像组学方法来预测CRC患者的MSI状态,但其计算流程较为复杂,可解释性欠佳,难以在临床中实际应用。既往基于苏木精-伊红(hematoxylin-eosin,H-E)染色切片的相关研究[11-12]表明,黏液成分、坏死、肿瘤浸润淋巴细胞等病理学指标是CRC患者MSI的独立预测因子。在增强CT中,肿瘤内的低密度区域以及肿瘤强化特征等可反映肿瘤内的黏液、坏死或纤维性成分,其中低密度占比、强化形式及程度等征象已用于结直肠黏液腺癌的影像学诊断中[13-14],但较少研究探究其与CRC患者MSI状态的关系。因此,本研究旨在分析术前增强CT低密度占比以及肿瘤强化等影像学特征对CRC患者MSI的预测价值。此外,进一步探究相关影像学特征与CRC患者预后的关系。
1 资料和方法
1.1 资料
回顾并收集2010年3月—2016年3月于广东省人民医院经病理学检查确诊为CRC的患者。纳入标准:① 术前均接受腹部或盆腔增强CT检查;② 均行CRC根治性手术,且切除组织均通过免疫组织化学法检测MSI状态。排除标准:① CT检查前或术前接受新辅助治疗;② CT图像因伪影或肠道准备欠佳而影响肿瘤评估;③ 手术切缘有肿瘤残余。收集患者的年龄、性别、术前癌胚抗原(carcinoembryonic antigen,CEA)水平及MSI状态。MSI状态检测方法:通过免疫组织化学法检测4种DNA错配修复蛋白(MLH1、PMS2、MSH2、MSH6)的表达情况,来确定是否存在错配修复功能缺陷。如果1种或多种蛋白表达缺失,则会被判定为错配修复缺陷(MSI);如果4种蛋白全部表达,则判断为错配修复功能正常(MSS)。最后将纳入本研究的患者按照1∶1随机分配至训练组和验证组。本研究通过广东省人民医院伦理委员会审批,豁免患者知情同意。
采取门诊、住院复查及电话相结合的方式进行随访。术后第1年每3~6个月随访1次,术后第2年每半年随访1次,之后每年随访1次。本研究的终点事件为患者因任何原因导致死亡。生存时间为从手术日期开始至发生终点事件或最后1次随访。
1.2 CT检查方法
检查前1 d患者进半流质饮食,禁服含重金属药物。检查前禁食4~6 h。检查前15 min肌内注射解痉药物盐酸山莨菪碱20 mg(有禁忌证患者除外),减少肠蠕动伪影。
采用美国GE公司的Lightspeed VCT 64层螺旋CT机行腹部或盆腔CT平扫及增强扫描。扫描参数:管电压120 kV,管电流 250 mA,层厚1.25 mm,准直器宽度0.625 mm,球管旋转时间0.6 s,螺距0.984,矩阵512×512。增强扫描对比剂为碘普胺(含碘370 mg/mL),经肘部静脉以3.0 mL/s速率团注,剂量90~100 mL。分别于对比剂注射30、60 s后获得动脉期、静脉期扫描图像。
1.3 图像分析
由放射科医师A采用盲法阅片并评估影像学特征。评估内容:① 肿瘤位置,分为右半结肠和左半结肠或直肠,其中右半结肠包括升结肠和右侧2/3横结肠,左半结肠或直肠包括左侧1/3横结肠、降结肠、乙状结肠和直肠;② 肿瘤内低密度占比,根据低密度范围在肿瘤内的占比分为<1/3、1/3~2/3和>2/3;③ 强化程度,根据肿瘤实性成分与邻近正常肠壁的强化程度进行比较,分为低于、等于和高于正常肠壁;④ 强化形式,分为均匀和不均匀强化;⑤ 肠壁增厚形式,分为局限性和环形,或向心性和偏心性。放射科医师B采用盲法阅片对随机选取的30例患者进行上述影像学特征的评估。
1.4 统计学处理
使用R语言4.0.3版本和SPSS 26.0统计软件对数据进行统计学分析。连续变量首先进行正态性及方差齐性检验,符合正态分布及方差齐性的变量采用t检验,不符合正态分布及方差齐性的变量采用Mann-Whitney U检验比较两组间的差异。分类变量组间比较采用χ2检验或Fisher精确概率检验。采用kappa一致性检验评价2名放射科医师对影像学特征评估结果的一致性,kappa值<0.20为一致性差,0.20≤kappa值<0.40为一致性一般,0.40≤kappa值<0.60为一致性中等,0.60≤kappa值<0.80为一致性较高,kappa值≥0.80为一致性极高。
采用logistic回归方程对MSI的可能相关特征进行单因素分析,将P<0.05的特征使用前进法纳入多因素分析中。使用训练组多因素分析差异有统计学意义的特征构建CRC患者的MSI预测模型,并在验证组中进行验证。采用受试者工作特征(receiver operating characteristic,ROC)曲线及曲线下面积(area under curve,AUC)评估模型与变量的预测效能。采用Kaplan-Meier法进行生存分析,使用Log-rank检验比较不同低密度占比组生存率的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 患者资料
纳入本研究的3 8 2例患者中,男性231例,女性151例,年龄25~90岁,平均年龄(62.9±11.7)岁,MSI患者40例(10.5%)。肿瘤位置在右半结肠的患者108例(28.3%),肿瘤内低密度占比1/3~2/3和>2/3的患者分别为24例(6.3%)、38例(9.9%),肠壁环形增厚的患者308例(80.6%),肠壁偏心性增厚的患者76例(19.9%),肿瘤强化低于肠壁和高于肠壁的患者分别为70例(18.3%)、75例(19.6%),肿瘤强化不均匀的患者163例(42.7%)。训练组和验证组均为191例,在训练组和验证组中MSI患者分别为19例(9.9%)和21例(11.0%)。在训练组和验证组中,除了CEA外,患者的年龄、性别、肿瘤位置、低密度占比等的差异均无统计学意义(P>0.05,表1)。
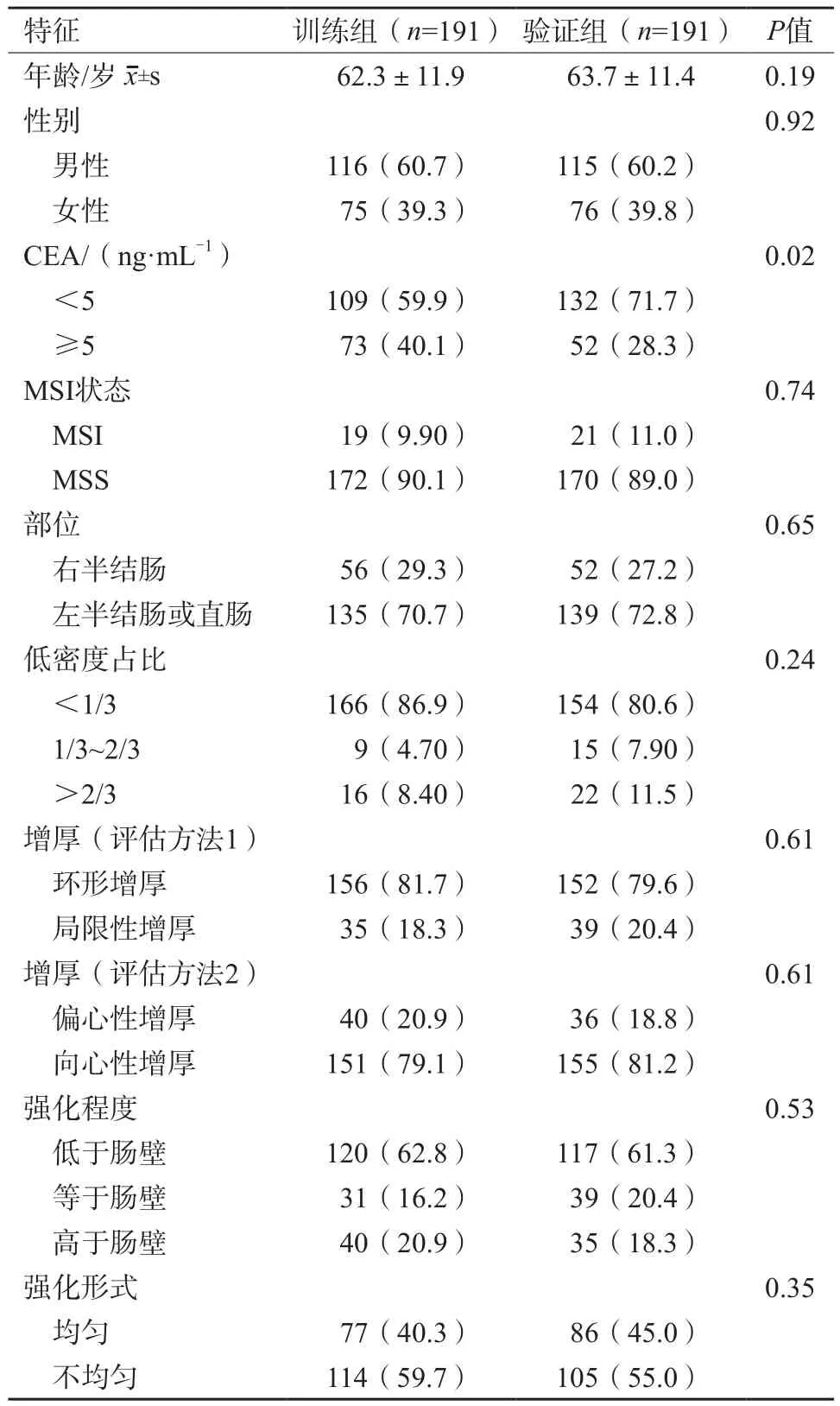
表1 训练组和验证组患者的临床及CT特征 n(%)
2.2 MSI状态的增强CT特征分布
在训练组中,CRC患者MSI多见于右半结肠、低密度占比>2/3、肿瘤强化低于肠壁和强化不均匀。右半结肠中MSI患者12例(21.4%),左半结肠或直肠中MSI患者7例(5.2%);低密度占比>2/3中MSI患者6例(37.5%),在低密度占比1/3~2/3和<1/3中MSI患者分别为3例(33.3%)、10例(6.0%);肿瘤强化低于、等于、高于肠壁中的MSI患者分别为8例(6.7%)、8例(25.8%)、3例(7.5%);强化不均匀中MSI患者14例(18.2%),而在强化均匀中MSI患者只有5例(4.4%)。在验证组中可以发现相似结果。
2.3 临床及增强CT影像学特征与MSI单因素及多因素分析
单因素分析结果显示,在训练组和验证组中,肿瘤位置、低密度占比、强化程度以及强化形式在MSI和MSS组间差异均有统计学意义。年龄、性别、术前CEA及肠壁增厚形式在MSI和MSS组间差异无统计学意义(表2)。在训练集中,将差异有统计学意义的特征(肿瘤位置、低密度占比、强化程度以及强化形式)纳入多因素分析中。结果显示,肿瘤位置(左半结肠或直肠组vs右半结肠组,OR值0.20,95%CI 0.07~0.54,P=0.002)和低密度占比(低密度占比>2/3组vs低密度占比<1/3组,OR值9.36,95% CI 2.83~31.0,P<0.001)是CRC患者MSI的独立预测因子(表3)。在验证集中发现相似的结果。图1为低密度占比的示例。
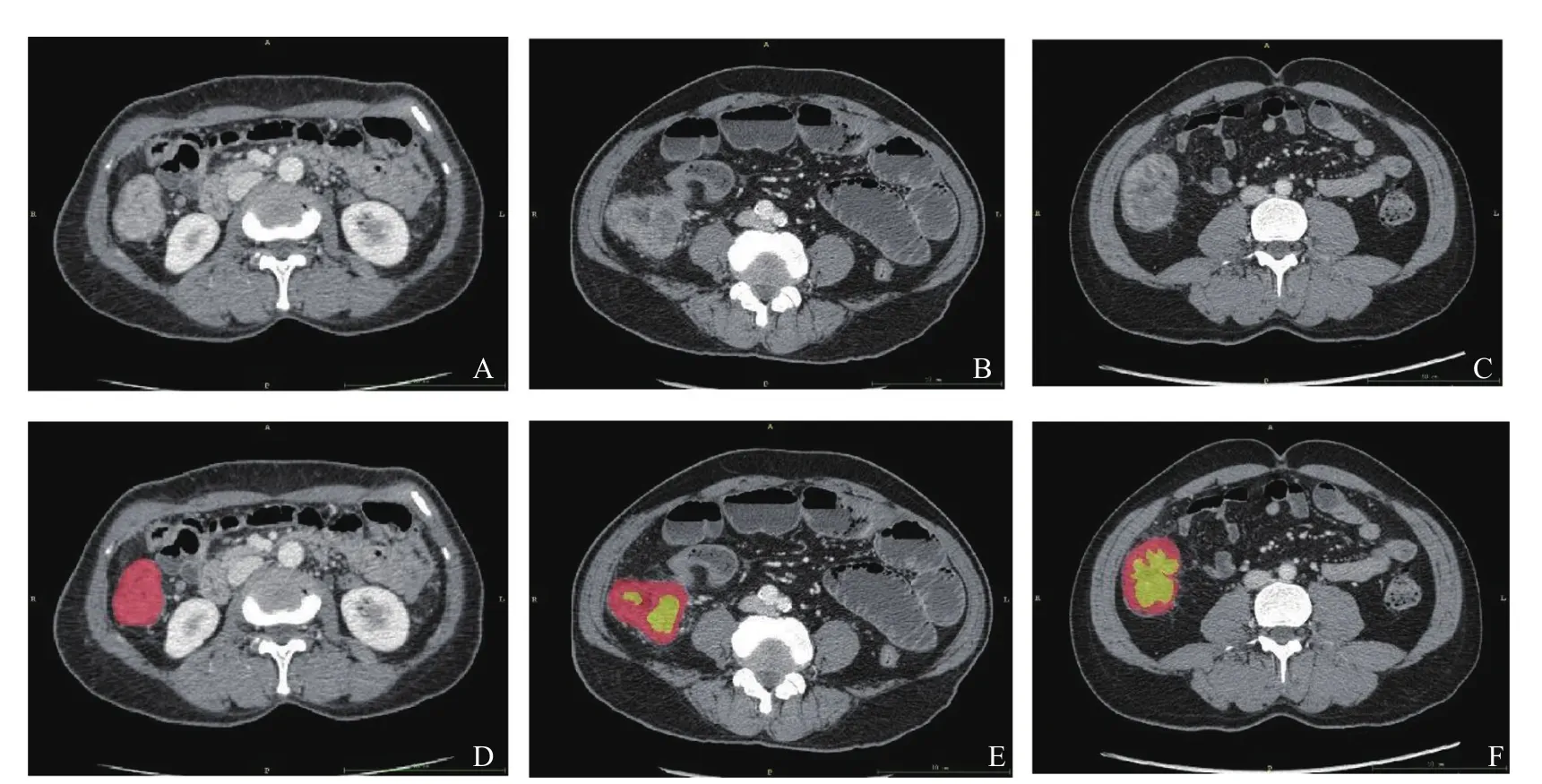
图1 CRC低密度占比示例

表2 训练组和验证组结直肠癌MSI的单因素logistic回归分析
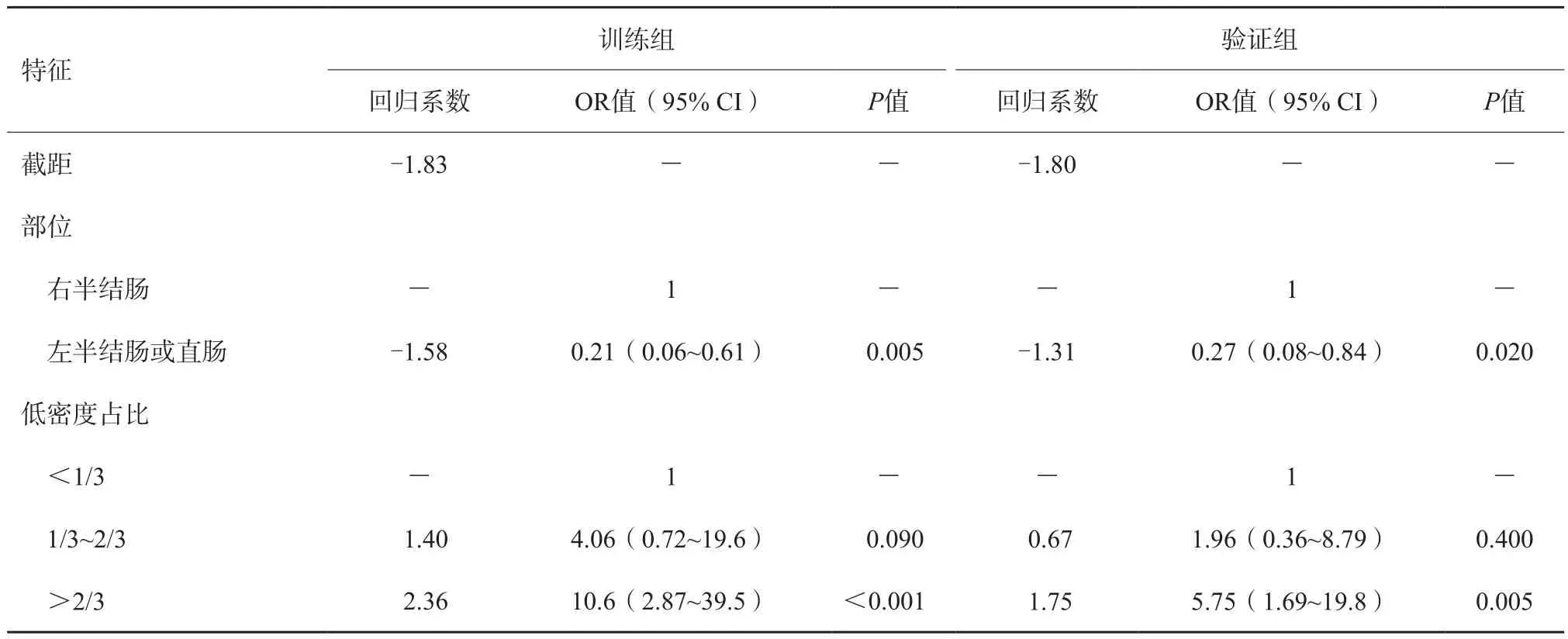
表3 训练组和验证组结直肠癌MSI的多因素logistic回归分析
一致性分析结果显示,在各影像学特征中,医师A和医师B对于肿瘤位置和肿瘤边界的评估结果一致性极高(kappa值均为1.000),低密度占比的评估结果一致性较高(kappa值为0.724,95% CI 0.481~0.967),其余影像学特征评估结果的一致性差、一般或中等(kappa值为0.164~0.444)。
2.4 MSI预测模型评估
本研究结合肿瘤位置和低密度占比构建的模型对MSI有较好的预测效能,比单一指标的预测效能更优(图2A、B)。在CRC患者中,肿瘤位置在训练组中预测效能的AUC为0.69(95% CI 0.57~0.80),准确度为73.3%,灵敏度为63.2%,特异度为74.4%;在验证组中的AUC为0.72(95%CI 0.62~0.83),准确度为75.9%,灵敏度为66.7%,特异度为77.6%。低密度占比在训练组中预测效能的AUC为0.69(95% CI 0.58~0.81),准确度为86.4%,灵敏度为47.4%,特异度为90.7%;在验证组中的AUC为0.72(95% CI 0.61~0.83),准确度为82.2%,灵敏度为57.1%,特异度为85.3%。与单一特征相比,结合肿瘤位置和低密度占比构建的模型在训练组和验证组中预测效能均有提高,在训练组中预测效能的AUC为0.80(95% CI 0.70~0.90),准确度为70.7%,灵敏度为84.2%,特异度为69.2%;在验证组中的AUC为0.75(95% CI 0.63~0.87),准确度为87.4%,灵敏度为57.1%,特异度为91.2%。
2.5 预后分析
由于低密度占比1/3~2/3和>2/3患者数相对较少,将两者合并归类为低密度占比-高;而将低密度占比<1/3归类为低密度占比-低。在完整数据集组中,低密度占比-低组的5年生存率(76.0%)略高于低密度占比-高组的5年生存率(66.0%),但差异无统计学意义(P=0.110,图2C)。在左半结肠或直肠组中,低密度占比-低组和低密度占比-高组的患者5年生存率分别为75.7%、56.2%,且差异有统计学意义(P=0.004,图2D)。在右半结肠组中,低密度占比-低组和低密度占比-高组的患者5年生存率分别为76.8%、71.7%,差异无统计学意义(P=0.910,图2E)。

图2 特征对CRC MSI的预测效能以及对患者生存率的影响
3 讨 论
MSI状态检测对CRC患者治疗方案的选择和预后判断至关重要。目前临床使用的MSI状态检测方法是对肿瘤组织标本通过免疫组织化学、聚合酶链式反应或二代测序进行检测,然而其检测费用高,而且并非每例CRC患者都适宜获取肿瘤的组织标本。在最新的CRC诊疗指南中,推荐将增强CT检查作为术前诊断及分期优先选择的一项检查方式。本研究选取增强CT检查作为图像评价基础,发现增强CT图像中获取的肿瘤位置和低密度占比与CRC患者的MSI状态相关。
既往研究表明H-E染色切片相关特征可以预测CRC患者的MSI状态。Yamashita等[15]基于H-E染色切片建立深度学习模型对MSI状态进行预测,达到了较好的预测效果,验证组中AUC为0.779~0.964。但深度学习模型较为复杂,可解释性较差。Greenson等[11]在H-E染色切片的主观病理学特征评估中发现,肿瘤内坏死、肿瘤浸润淋巴细胞及黏液成分等与MSI相关。但H-E染色切片的标本需通过有创方式获取,仍未能实现术前评估MSI状态。
影像学特征已用于评估MSI状态。基于CT或磁共振成像的手工特征或深度学习特征的影像组学方法可以对CRC患者的MSI状态进行预测,AUC为0.688~0.961[5-10]。影像组学方法可以在术前评估MSI状态,但其较为复杂,且多数纳入的影像学特征的可解释性尚不明确。
本研究发现增强CT肿瘤内低密度占比与CRC患者的MSI状态相关。在单因素分析中,低密度占比、增强程度及增强形式在MSI和MSS组间差异均有统计学意义,但在多因素分析中,三者中只有低密度占比为独立预测因子,可能是因为三者在增强CT图像中均与组织的密度相关,即存在线性关系所致。增强CT肿瘤内的低密度区域可反映上述H-E染色切片中的黏液成分及坏死组织。肿瘤位置也是MSI的独立预测因子,这与既往研究[11]结果相一致。肿瘤位置结合低密度占比预测MSI的AUC达到0.80。
本研究结果显示,发生在左半结肠、低密度占比-低组的患者预后较好。左半结肠或直肠组中,低密度占比-低组的患者5年生存率为75.7%。增强CT肿瘤内的低密度区域可反映黏液成分、坏死组织或纤维性成分。黏液成分与CRC预后的关系尚有争议,有些研究[16-17]表明黏液成分提示预后不佳,但有些研究[18-20]表明黏液成分与预后无关。坏死是实性肿瘤一个常见的特征,多是由于肿瘤快速生长缺乏足够的血供,导致微环境缺氧进而使肿瘤细胞死亡,往往提示预后不佳[21]。肿瘤发生在右半结肠时,低密度占比与预后无关,这可能与本研究纳入患者肿瘤位置在左半结肠者居多有关。
本研究存在一定的局限性。首先,本文仅纳入了部分影像学特征,可能遗漏其他与MSI相关的特征。但本研究纳入的影像学特征较易评估,且可解释性较强。其次,本研究中增强CT图像中的低密度占比为放射科医师主观评估结果,与放射科医师的经验有关。在今后的研究中将对肿瘤内低密度占比进行人工智能精准量化以提高结果的一致性。最后,本组资料为单中心的回顾性分析,可能会存在一定的选择偏倚。
综上所述,本研究发现增强CT图像中肿瘤的低密度占比是CRC患者MSI状态的独立预测因子,低密度占比与肿瘤位置相结合可预测MSI状态。术前增强CT图像中的上述指标有助于对CRC患者进行MSI的初筛。
