TRPV4-Nox2复合体对肥胖小鼠主动脉舒张功能影响
2022-05-11高梦茹
高梦茹, 韩 婧, 马 鑫,
(江南大学1. 药学院、2. 医学院,江苏 无锡 214122)
随着人们生活方式现代化、膳食结构改变以及缺少锻炼等因素影响,肥胖已经成为世界性的公共健康问题。肥胖症是一种慢性代谢性疾病,多数研究表明肥胖会引发氧化应激[1]。以往的研究表明,氧化应激常与内皮功能紊乱相关,其特点是过量的活性氧(reactive oxygen species,ROS)产生,导致一氧化氮生物利用度的降低,引发内皮细胞收缩因子增加,进而引发血管舒张功能障碍[2]。瞬时受体电位4型(transient receptor potential vanilloid type 4,TRPV4)是一种选择性的阳离子通道,可被多种因素激活,如温度、机械力、化学激动剂等[3]。最近,越来越多的证据表明,TRPV4在调节ROS产生和血管扩张中起着重要作用[4]。烟酰胺腺嘌呤二核苷酸磷酸酯氧化酶2(nicotinamide adenine dinucleotide phosphate oxidase,Nox2),已被证明是ROS产生的重要调节器[5],其他研究表明,Nox2在血管舒张功能中起着重要的调节作用[6]。TRPV4和Nox2均参与调节氧化应激和血管舒张反应,以往的研究也证明,TRPV4-Nox2能够形成复合物起作用[7],然而,探索TRPV4-Nox2复合体对肥胖引发的氧化应激和血管舒张功能影响的研究较少,因而开展了本研究,拟探讨减弱TRPV4-Nox2的耦联状态是否能帮助改善肥胖引发的氧化应激和血管舒张障碍,随后以TRPV4-Nox2复合体为靶点进行药物筛选,拟寻找一种副作用更小靶向性更高的药物,为肥胖相关并发症的治疗提供新思路和新策略。
1 材料与方法
1.1 材料
1.1.1实验动物 4周龄SPF级雄性C57 BL/6J小鼠(上海斯莱克公司),饲养于江南大学医学院实验动物中心(伦理号:JN.No 20200515c0501230[061]),于无菌、通风良好的环境进行12 h昼夜交替饲养,小鼠饲养温度在18 ℃~25 ℃,相对湿度40%~70%,适应性饲养7 d后开始正式实验。
1.1.2药品与试剂 CM-H2DCFDA染料购自美国Invitrogen公司(货号C6827),恩曲替尼(Entrectinib)购自美国阿拉丁公司(货号E302199-100 mg),佛波酯(PMA)购买自美国sigma-aldrich公司(货号P1585),GSK1016790A购买自美国sigma-aldrich公司(货号G0798)TRPV4抗体购买自Alomone公司(货号sc-130543),Nox2抗体购买自Santa-Cruz Biotech公司(货号ACC-034),Fluo-4 AM购自美国Invitrogen公司(货号F14201),腺相关病毒购自和元生物有限公司(Flt1为内皮细胞的启动子,帮助腺相关病毒靶向内皮细胞表达)。
1.1.3仪器 Wire myograph 620 M(丹麦DMT公司),激光共聚焦(德国蔡司公司),凝胶成像仪(美国伯乐公司)
1.2 方法
1.2.1模型建立及实验分组 将C57 BL/6J与敲除小鼠在检疫间隔离1周,随后随机将这些小鼠分成两组,放入饲养间饲养。饲养期间,一组小鼠喂正常饮食(含有25%脂肪),另外一组小鼠喂食高脂饮食(含有45%脂肪),期间每周定时监测小鼠体重,14周后,HFD组小鼠体重增长未超过ND组体重20%的小鼠排除,其余进行TC、LDL、HDL检测,TC,LDL有明显增加,HDL明显减少说明肥胖模型造模成功,否则排除。腺相关病毒小鼠模型构建,取ND小鼠、HFD小鼠、TRPV4 KO-HFD小鼠,随机分组,每组10只,实验组(Nox2 △3):使用尾静脉注射的方式向小鼠体内注射AAV-Flt1 Nox2 △3病毒,用以减弱TRPV4-Nox2复合体耦联强度;对照组(Vector):使用尾静脉注射的方式向小鼠体内注射载体病毒。注射浓度根据试剂说明书确定,注射后21 d,取主动脉进行免疫荧光观察,共聚焦显微镜552 nm激发光能观察到内皮细胞有明显红光,说明造模成功,否则排除。
1.2.2原代主动脉内皮细胞分离与培养 取对照组与肥胖模型组小鼠,使用二氧化碳对小鼠进行安乐死处理。打开胸腔,快速分下主动脉,使用无菌PBS清洗后,剪碎置于含胰酶(2 g·L-1)的PBS中,37 ℃水浴消化25 min,1 200~3 000 r·min-1离心5 min。收取沉淀,使用内皮细胞培养基重悬种于6孔板中,2 h后更换培养基,此后5代内可用于实验。
1.2.3血管张力试验 取小鼠的主动脉血管,分割为2 mm长度的小段,装载到肌张力仪器的槽中,进行平衡和复苏处理,随后进行曲线记录,待张力曲线稳定后,加入1 μmol·L-1的去氧肾上腺素(phenylephrine,Phe)预收缩血管,随后以浓度梯度的方式,加入乙酰胆碱(acetylcholine,ACh)并观察血管张力的变化。收集并处理数据,即可得到对照组与肥胖模型组小鼠的血管张力情况。
1.2.4免疫共振能量转移实验 细胞种于玻片上,待长至80%密度,固定30 min,通透10 min,随后使用含有1% BSA的PBS对细胞进行封闭。30 min后加入配置好的TRPV4与Nox2一抗,4 ℃过夜,随后室温孵育荧光二抗2 h。染色完成后,使用共聚焦显微镜进行代表图与FRET信号的采集。
1.2.5免疫共沉淀 冰上提取蛋白,向上清加入1/10体积Protein A+G琼脂糖珠,在4 ℃下垂直旋转混合30 min,去除非特异性结合蛋白。4 ℃,400g离心5 min,收集上清,使用BCA法测定蛋白浓度,稀释蛋白至浓度相同后,根据抗体说明书,向裂解液中加入相应抗体,随后4 ℃,垂直旋转过夜混合。d2,向混合液中加入抗体量10倍体积的Protein A+G琼脂糖珠,随后继续在4 ℃的条件下,使用垂直旋转仪混合3 h。4 ℃,400g离心5 min,收集沉淀,使用PBS清洗3次后加入50 μL的2 × SDS loading buffer。涡旋混匀,煮沸样品10 min,使用免疫印迹技术检测上清蛋白样品。
1.2.6ROS检测 分离原代主动脉内皮细胞,等待细胞生长到80%密度后,将之种入共聚焦小皿。等待细胞生长,待形态展开后,使用NPSS清洗,随后在避光的条件下染色15 min。运用共聚焦显微镜采集图像,采集时,共聚焦激发波长设置成488 nm。拍摄完成后,使用共聚焦显微镜分析软件分析荧光强度,使用对照组的荧光强度进行归一化处理,即可获到处理组ROS的相对含量。
1.2.7细胞内Ca2+检测 向HEK-293细胞中转染TRPV4质粒,24 h后,使用恩曲替尼(10 μmol·L-1)预孵育30 min,NPSS清洗,随后将5 μmol·L-1Fluo-4 染料与细胞共孵育30 min,清洗细胞去除多余染料,随后使用激光共聚焦显微镜以488 nm激发光进行信号收集,前30 s为基础信号,30 s后加入TRPV4通道激动剂GSK-1016790A(10 nmol·L-1)激活TRPV4通道,观察钙信号变化。
1.2.8Western blot实验 准备SDS-PAGE胶,向小孔中加样品,加样完成后,在恒压条件下,首先使用70 V的电压进行电泳30 min,随后换成120 V电压,电泳1~2 h。100 V,80 min进行转膜,随后,加入5% BSA进行封闭。1 h后,4 ℃孵育一抗过夜,接着室温孵育二抗1 h,使用ECL显色液进行显色,使用凝胶成像系统进行代表图采集。

2 结果
2.1 肥胖引发氧化应激、血管舒张功能障碍,并增加TRPV4-Nox2复合体耦联强度如Fig 1所示,与ND组相比,HFD组主动脉内皮细胞ROS产生增加(P<0.05,Fig 1A-B)。HFD组主动脉舒张与ND组相比,舒张功能减弱,最大舒张率明显减少(P<0.05,Fig 1C-D)。通过FRET实验,发现与对照组相比,HFD组TRPV4-Nox2复合体之间的物理相互作用强度明显增强(P<0.05,Fig 1E-F)。上述结果提示肥胖引发的TRPV4-Nox2复合体耦联强度增加,或许是肥胖引发氧化应激、血管舒张功能障碍的原因。

Fig 1 Obesity induced oxidative stress, vasodilatory dysfunction and enhanced physical association of TRPV4-Nox2 complex
2.2 减弱TRPV4-Nox2复合体耦联强度可改善肥胖引发的氧化应激及血管舒张功能障碍定点突变和免疫共振能量转移结果显示:Nox2上145-152号位的7个氨基酸是TRPV4和Nox2相互作用的关键结合位点(P<0.05,Fig 2A),以此为基础构建的腺相关病毒(AAV-Flt1-Nox2 △3)可明显减弱HFD组TRPV4与Nox2之间的物理相互作用(P<0.05,Fig 2B);TRPV4 KO-HFD组小鼠,由于不存在TRPV4蛋白,该腺相关病毒不影响TRPV4-Nox2复合体物理耦联(Fig 2C)。CM-H2DCFDA染色结果表明:在肥胖小鼠中减弱TRPV4-Nox2之间的物理相互作用,明显减少了肥胖小鼠内皮细胞中的ROS产生(P<0.05,Fig 2D)。血管张力实验结果表明:在肥胖小鼠中减弱TRPV4-Nox2之间的物理相互作用,可增加肥胖小鼠主动脉血管对ACh的响应,增加最大舒张率(P<0.05,Fig 2E);而在敲除鼠中,上述改变不存在(Fig 2F和G)。这些结果提示减弱TRPV4-Nox2复合体物理相互作用强度,可帮助减轻肥胖引发的氧化应激并恢复血管舒张功能障碍。
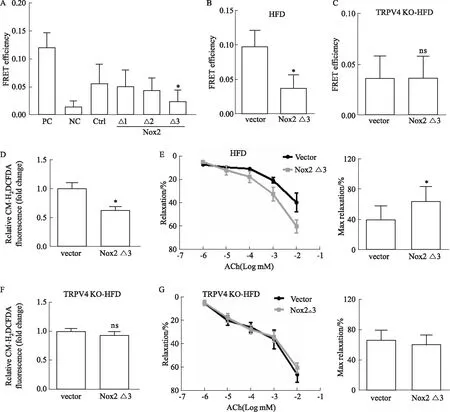
Fig 2 Decreasing association between TRPV4 and Nox2 improved obesity-induced oxidative stress and vasodilatory dysfunction
2.3 恩曲替尼不影响TRPV4和Nox2的表达与功能,仅减弱TRPV4-Nox2复合体耦联强度之前的研究发现恩曲替尼是一种可降低TRPV4-Nox2复合体耦联强度的药物[8],此处免疫共振能量转移结果再次证明这一结论:与HFD组相比,恩曲替尼明显减弱TRPV4-Nox2复合体物理相互作用(P<0.05,Fig 3A)。随后,通过Western blot实验,确认恩曲替尼不影响TRPV4和Nox2的表达(Fig 3B和D)。在HEK-293细胞中转染Nox2进行CM-H2DCFDA染色实验,使用佛波酯(PMA)作为Nox2激动剂,结果表明:Nox2激活明显增加ROS产生,而使用恩曲替尼(10 μmol·L-1,30 min)处理不影响Nox2介导的ROS产生,表明恩曲替尼不影响Nox2功能(Fig 3C)。使用转染TRPV4的HEK 293进行钙内流实验,使用GSK-1016790A作为TRPV4激动剂,结果表明,恩曲替尼不影响TRPV4介导的钙内流,表明恩曲替尼不影响TRPV4功能(Fig 3E)。上述结果提示恩曲替尼针对肥胖产生的作用,是由减弱耦联引起,而非改变了TRPV4和Nox2的表达和功能。
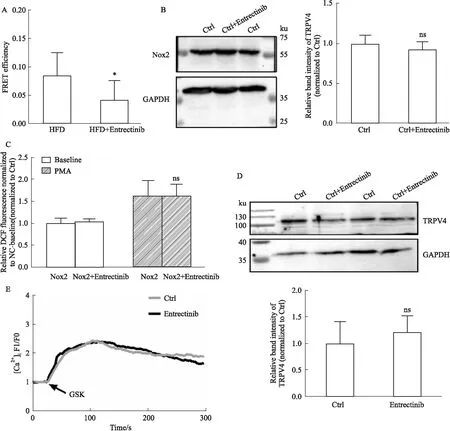
Fig 3 Entrectinib did not affect TRPV4 and Nox2 expression and function, but only decreased
2.4 恩曲替尼可改善肥胖引发的氧化应激及血管舒张功能障碍CM-H2DCFDA染色结果表明:与HFD组相比,使用恩曲替尼预孵育明显减少了肥胖小鼠主动脉内皮细胞中的ROS产生(*P<0.05,Fig 4A);血管张力实验表明:恩曲替尼(10 μmol·L-1,30 min)预孵育后,明显增强主动脉血管对ACh的响应,增加了最大舒张率(P<0.05,Fig 4B)。上述结果提示恩曲替尼可帮助改善肥胖引发的氧化应激及血管舒张功能障碍,为肥胖并发症的治疗提供了新策略。

Fig 4 Entrectinib improved obesity-induced oxidative stress and vasodilatory dysfunction
3 讨论
肥胖会引发慢性炎症、代谢紊乱、氧化应激等问题,进而引发内皮功能障碍,破坏血管舒张功能[9]。以往的研究表明,TRPV4和Nox2是其中关键调节因子,然而,很少有人将TRPV4和Nox2作为整体进行研究。本研究使用免疫共振能量转移等技术,证明TRPV4-Nox2之间存在物理相互作用,这一结论与以往的研究一致[7],同时,我们使用了肥胖模型小鼠,提供新的证据补充证明了肥胖会增加TRPV4-Nox2的物理相互作用。
ROS产生过量会引发内皮功能紊乱,进而导致一系列的疾病,其中,血管扩张功能障碍是引起广泛关注的问题之一。以往的研究表明,在正常血管中,内皮依赖性舒张主要由3种血管扩张剂[10],一氧化氮[11]、前列环素[12]和内皮衍生的超极化因子[13]介导,在不同的血管床中贡献不同。在主动脉血管中一氧化氮是主要舒张因子,而ROS的过量产生会影响一氧化氮的产生和利用度,破坏主动脉舒张,因而本研究选取主动脉血管进行研究。我们发现肥胖引发氧化应激并破坏主动脉血管的舒张功能,这一结果与以往的发现一致[14-15]。此外,本研究还提供了新的证据证明,肥胖引发氧化应激与主动脉血管舒张功能障碍是由TRPV4-Nox2复合体物理耦联强度增加引起的,减弱耦联可以减少肥胖相关的ROS产生过量和血管舒张功能障碍。
TRPV4和Nox2在全身多处均有分布,使用药物进行系统性激活会引发多种副作用[16],为减少副作用,本研究以TRPV4-Nox2复合体为靶点,进行了药物筛选,以复合体为靶点的优势在于药物靶向性的增加。以此为基础,本研究另一重要发现是找到一种以TRPV4-Nox2复合体为靶点的药物恩曲替尼,该药物不影响TRPV4和Nox2的表达与功能,而仅减弱TRPV4和Nox2在肥胖条件下的过度耦联,进而减少肥胖小鼠主动脉内皮细胞中的ROS产生,帮助恢复主动脉血管舒张功能。
综上所述,在本项研究中,我们证明在肥胖小鼠中TRPV4-Nox2复合物的物理相互作用增强,并证明这种物理相互作用的增强是导致原代主动脉内皮细胞中ROS产生增加的原因,同时,我们首次提供了证据证明这种增强的物理相互作用是造成肥胖小鼠主动脉血管舒张功能障碍的原因之一。基于这些发现,我们确认能靶向TRPV4-Nox2的药物恩曲替尼,可帮助改善肥胖引发的氧化应激与血管舒张功能障碍。这一研究为解释肥胖相关病理问题提供了新思路,同时为肥胖并发症治疗提供了新策略。
