胞质甘油醛-3-磷酸脱氢酶GAPC2参与番茄果实成熟的调控
2022-05-11王良新刘晓阳侯国艳蒋语嫣
杨 敏,龙 宇,王良新,刘晓阳,侯国艳,蒋语嫣,罗 娅
(四川农业大学园艺学院,成都 611130)
番茄是研究呼吸跃变型果实的模式植物,乙烯在其果实成熟过程中起关键作用。关于番茄果实成熟的机理研究主要集中在对乙烯合成、感知、信号传递以及下游靶标的调控机制。乙烯的生物合成始于蛋氨酸,然后分别在1-氨基环丙烷-1-羧酸合酶(1-aminocyclopropane-1-carboxylic acid(ACC)synthase,ACS)和ACC氧化酶(ACC oxidase,ACO)的作用下生成ACC和乙烯。ACS和ACO是乙烯生物合成途径中2个非常重要的酶,目前在番茄中已鉴定出13个ACS基因和6个ACO基因[1],上述基因在番茄果实成熟中均有不同的表达模式。乙烯合成后会与内质网膜上的乙烯受体(ethylene receptor,ETR)结合,负调控组成型三重反应蛋白(constitutive triple response1,CRT1)并使其失活,失活后的CRT1因无法磷酸化乙烯不敏感(ethylene insensitive2,EIN2)因子的C末端导致其羧基端被切割而游离进入细胞核促进下游乙烯响应因子的表达[2]。与此同时,EIN2正调控EIN3及EIN3-LIKE的表达,CRT1也能通过其中一条MKK9-MPK3/6级联反应直接将乙烯信号传递至EIN3[3]。乙烯响应因子(ethylene responsive factors,ERF)是乙烯信号传递途径中的最后组分,EIN3可以结合在ERF启动子区域(PERE)正调控ERF的表达,ERF蛋白则通过与下游基因启动子区域(GCC-box)相结合,调控果实的发育与成熟[4]。
除乙烯信号途径在调控番茄果实成熟过程中发挥重要作用,相关转录因子也参与番茄果实成熟的调控。近年发现 RIN(ripening inhibitor)、NOR(non-ripening) 、CNR (colorlessnon-ripening)[5]、GRAS转录调节因子4(GRAS transcriptional regulator4,GRAS4)[6]、MYB70/75/72[7-9],同源盒蛋白 ATH1(homeobox protein ATH1,BL4)[10]及 HY5 蛋白(elongated hypocotyl 5,HY5)[11]可通过调控ACO和ACS的生物合成途径以及番茄果实成熟相关基因的表达来影响其果实成熟。同时,植物激素及翻译后修饰也参与番茄果实成熟的调控。植物激素油菜素内酯类(brassinosteroid,BR)、生长素、赤霉素及其信号调控因子均被证实参与番茄果实成熟[12-13]、调节番茄光合作用、糖分积累和果实发育[14]。且在赤霉素的分解代谢途径中,调控番茄果实硬度的定量性状基因座qFIRM SKIN1(FlS1)通过调节果实硬度参与植物激素调控番茄果实发育[15]。此外,番茄组蛋白脱乙酰基酶HDT3和HDA3也能通过影响乙烯合成基因、成熟相关基因的表达以及类胡萝卜素积累来调节番茄果实成熟[16-17]。
糖酵解是植物重要的代谢途径,为脂肪酸和氨基酸的合成提供能量和前体。胞质甘油醛-3-磷酸脱氢酶(cytoplasm glyceraldehyde-3-phosphate dehydrogenase,GAPC)是糖酵解中的关键限速酶,它催化 3-磷酸甘油醛(glyceraldehyde-3-phosphate,G3P)和其辅助因子氧化型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)和磷酸盐偶联转化为1,3-二磷酸甘油酸(1,3-bisphosphglycerate,1,3-BPG)和还原型NADH[18]。除了具有糖酵解催化功能外,GAPC还是一种多功能蛋白。因GAPC自身有一个敏感的巯基开关,极易受到H2O2的氧化,目前发现GAPC还能积极响应盐、干旱、热、冷、厌氧、镉胁迫以及病原菌侵染等各种生物与非生物胁迫[19]。Liu T.F.等[20]通过抑制马铃薯中StGAPC1,StGAPC2和StGAPC3基因的表达来影响块茎蔗糖合成途径,有助于冷贮藏块茎中还原糖的积累。Luo Y.等[21]发现ABA和蔗糖可以通过抑制FaGAPC2/FaGAPCP1的表达进而调控草莓果实成熟。因此,GAPC在环境适应、植物发育以及代谢过程中都可能具有更普遍的重要性。
果实发育和成熟与能量代谢,呼吸代谢和氧化还原过程密切相关[22-23]。糖酵解是植物的主要代谢途径,对上述代谢过程具有直接影响。作为糖酵解中的关键酶之一,FaGAPC2已被证实参与非呼吸跃变模式植物草莓果实的成熟调控[21],目前并不清楚该基因在番茄中是否也具有类似作用。因此,本试验通过在番茄果实中异源表达FaGAPC2,探索FaGAPC2在不同物种中功能差异情况,并为研究番茄果实成熟机制提供研究基础。
1 材料和方法
1.1 试验材料
试验材料为大小一致,表面无损伤、无病虫害的破色期樱桃番茄(Solanum lycopersicum‘luona’)果实。2020年10月底取自中国四川省绵阳市涪城区石马镇中马绿色农场,用于后续试验。
2xTransStart®FastPfu PCR SuperMix、perfect⁃StartTMGreen qPCR SuperMix、DL 2000 DNA maker、DL 15000 DNA maker、SMART™ RACE cDNA合成试剂盒、pEASY®-Basic Seamless Cloning and Assembly Kit DNA同源重组连接试剂盒、胶回收试剂盒、BamHI、XbaI核酸内切酶、pEASY-Blunt Cloning Simple Vector、大肠杆菌(Escherichia coli)Trans 5α、根癌农杆菌(Agrobacterium tumefaciens)GV3101感受态均购于北京全式金公司。卡那霉素(Kanamycin,Kan)、利福平(Rifampin,Rif)、庆大霉素(Gentamicin,Gen)和乙酰丁香酮(Acetosyringone,As)购于四川辰马生物科技有限公司。
1.2 试验方法
1.2.1 载体构建
使用前人[24]改进的CTAB法提取草莓果实的RNA。并利用RT-PCR扩增获得草莓FaGAPC2的全长(1 011 bp)序列。同源重组克隆引物为OFaGAPC2-F(5’-CGCGGTGGCGGCCGCTCTAGAGAC GCTCTTATTCAGAACCCAGAG-3’)和O-FaGAPC2-R(5’-GATCTGCAGCCCGGGGGATCCCTCTCTTCG ATCAGTCTCCATGG-3’)。PCR扩增程序为,95℃预变性3 min,95℃变性30 s,55℃退火20 s,72℃延伸10 s,循环34次,72℃延伸5 min,12℃永久保存。同时使用双酶切法(酶切位点XbaI和BamHI)酶切过表达载体(pCAMBIA1301-35S-NOS)并进行目的基因和过表达载体的连接。将连接产物转化大肠杆菌感受态后经过夜培养挑选单菌落进行菌液PCR并测序获得重组质粒。
1.2.2 农杆菌瞬时过表达番茄果实
参考草莓果实的消毒方法[25]对番茄果实进行消毒预处理。将重组质粒35S::FaGAPC2和过表达空载分别进行农杆菌转化并在避光,28℃环境下培养24~36 h[26]。挑取单菌落于三抗(50 μg/mLKan,20 μg/mLRif和40 μg/mLGen)LB液体培养基中扩大培养并进行菌液PCR检测,随后在检测成功的重组质粒和空载中分别加入30 mL三抗LB液体培养基并培养至OD600为0.8~1.0;离心收集菌体再分别加入30 mL浸染液(200 μmol/L As,0.5 mol/LMES pH5.6,1mol/L MgCl2),25℃ 40r/min避光孵育4 h;离心收集菌体并用侵染液调节,OD600值至0.8~1.0,随后用1 mL无菌注射器分别注射番茄果皮,对照组与过表达组各注射3个生物学重复共27颗果实。将果实表面的侵染液擦净并置于人工气候箱中避光,25℃,相对湿度90%~95%培养5 d。期间观察果实表型变化,拍照收样后冻存于-80℃备用。
1.2.3 检测番茄果实中FaGAPC2的表达效率
使用多糖多酚植物RNA提取试剂盒(北京酷莱博科技有限公司)提取番茄果皮的总RNA,使用反转录试剂盒合成cDNA后便进行实时荧光定量(Bio-Rad,CFX Connect,CA,USA),qPCR引物为q-FaGAPC2-F(5’-TGTGCACGATCAAGTCAATC AC-3’)和 q-FaGAPC2-R(5’-GAGGGTCTTATGACCA CCGT-3’)。RT-qPCR扩增采用SYBR Green PreMix Ex Taq II试剂盒(TAKARA)20 μL反应,SYBR Green PreMix Ex Taq Ⅱ 10 μL,上下游引物各0.8 μL,模板 1.5 μL,H2O 6.9 μL。扩增程序为 95 ℃×2 min 1个循环,94 ℃×20 s,58 ℃×20 s,72 ℃×30 s共40个循环,扩增后50℃保温1 min,各反应以FaAc⁃tin基因(AB116565)为草莓内对照进行归一化,以SlCAC(101255715)基因为番茄果实对照进行归一化,试验重复3次。
1.2.4 番茄果实成熟相关生理指标的测定
果实硬度用质构仪(TMS-PIL0T,美国)进行测定,可溶性固形物含量用数显式糖度计(ATAGO PAL-1,日本)进行测定。果实色泽用色差仪(CR-400,柯尼卡美能达,日本)测量果实的明暗度L*、绿色到红色的变化a*以及蓝色到黄色的变化b*。测量方法是在每个水果赤道区域周围的3个不同位置进行测定。
总叶绿素和总类胡萝卜素的提取与含量测定参考Zhu M.K.等[27]的方法。称取1 g左右研磨成粉的番茄果皮,加入10 mL提取液,充分混匀,4℃条件下过夜提取,次日将混合物在4℃条件下,8 000×g离心15 min,将上清液转移到新的离心管中,以正己烷为空白对照,测定上清液在450、643和647 nm处的吸光度值,总叶绿素和总类胡萝卜素的含量按以下公式计算:
总叶绿素含量(mg/g)=(8.02×A643+20.2×A647)×V/m;
总类胡萝卜素含量(mg/g)=(A450/0.25)×V/m。
V:提取液总体积;m:样品称取量。
1.2.5 数据分析
采用Microsoft Excel 2016软件进行数据整理,使用DPS进行单因素方差分析及LSD检验,使用Origin 2019作图,图表中数据为平均值±标准差。
2 结果与分析
2.1 过表达FaGAPC2的番茄果实表型及表达量变化
利用农杆菌转染法瞬时过表达FaGAPC2,研究FaGAPC2在番茄果实发育和成熟过程中的作用。与对照组相比,过表达35S::FaGAPC2组在注射后第5天番茄果实上色较对照更缓慢(图1 A,表1)。随后分别提取对照组和过表达组果实的RNA,并选取FaActin作为内参基因进行qRT-PCR,结果表明(图1B):FaGAPC2在过表达番茄果实中的转录水平显著高于对照2.39倍,说明瞬时过表达技术体系成功将FaGAPC2在番茄果实中过表达。
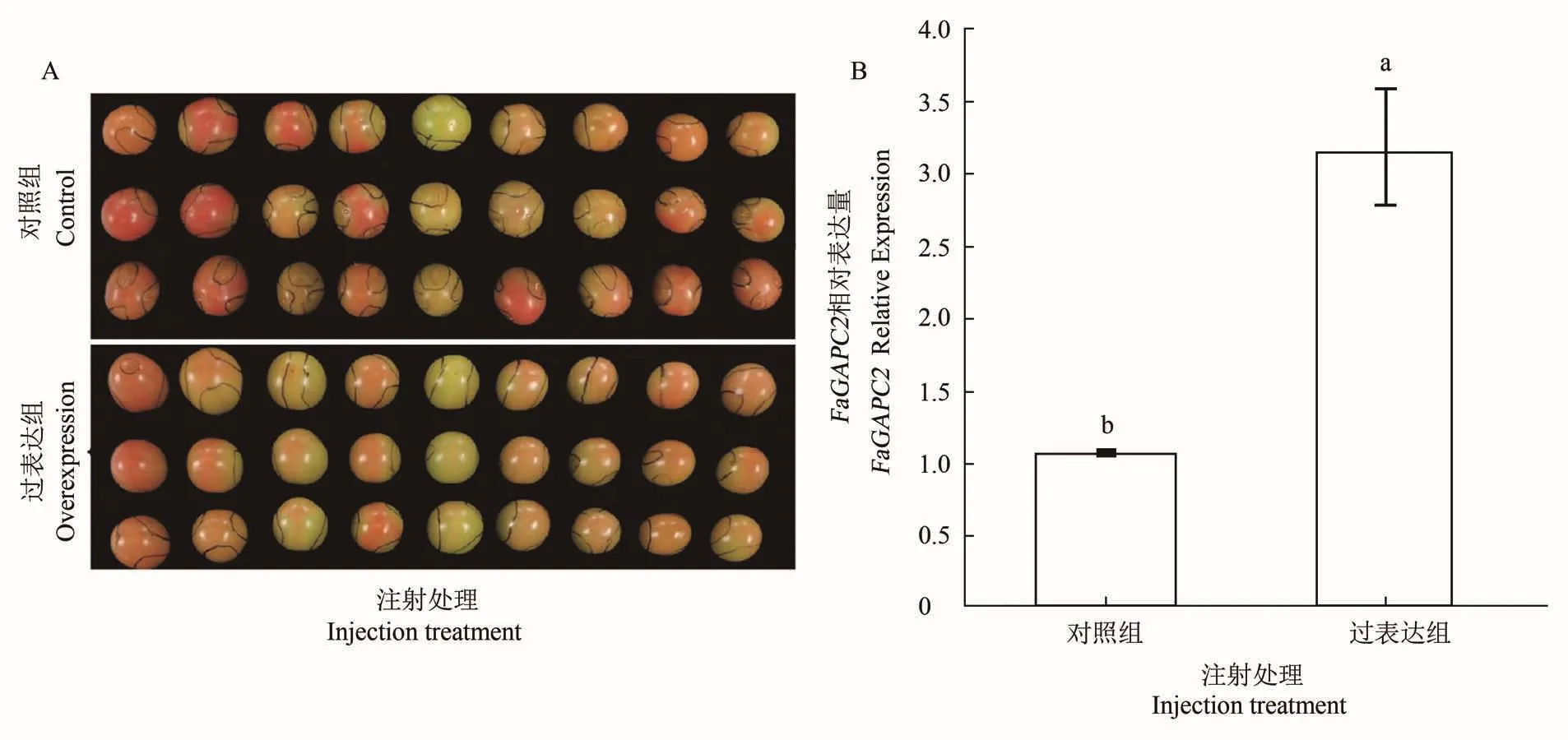
图1 农杆菌注射5 d后番茄果实表型(A)与FaGAPC2过表达水平(B)Figure 1 Phenotype of tomato fruit and FaGAPC2 overexpression level on the 5th day after Agrobacterium injection
2.2 过表达FaGAPC2对番茄果实色差的影响
果实色泽是评价果实品质及成熟度的重要指标。为进一步评价FaGAPC2在番茄果实成熟中的作用,作者测定了番茄果实色泽的亮度L*、红色度a*和黄色度b*值。结果表明(表1):对照组的L*和b*值分别是35.62和8.68,与过表达组无显著性差异,而过表达FaGAPC2组红色度a*值为2.58,对照组为6.99,显著低于对照组。由此说明过表达FaGAPC2可以延缓番茄果实上色。

表1 FaGAPC2过表达对番茄果实色泽的影响Table 1 The effect of FaGAPC2 overexpression on tomato fruit color
2.3 过表达FaGAPC2对番茄果实硬度和可溶性固形物含量的影响
硬度与可溶性固形物含量均是番茄果实成熟的两个重要品质指标。通过对注射5 d后的番茄果实进行硬度和可溶性糖的测定,结果表现为过表达FaGAPC2组番茄果实硬度为24.94 N,显著高于对照组21.18 N(图2A),但可溶性固形物含量与对照却无显著差异(图2B),说明过表达FaGAPC2对番茄果实硬度有较为明显的影响。
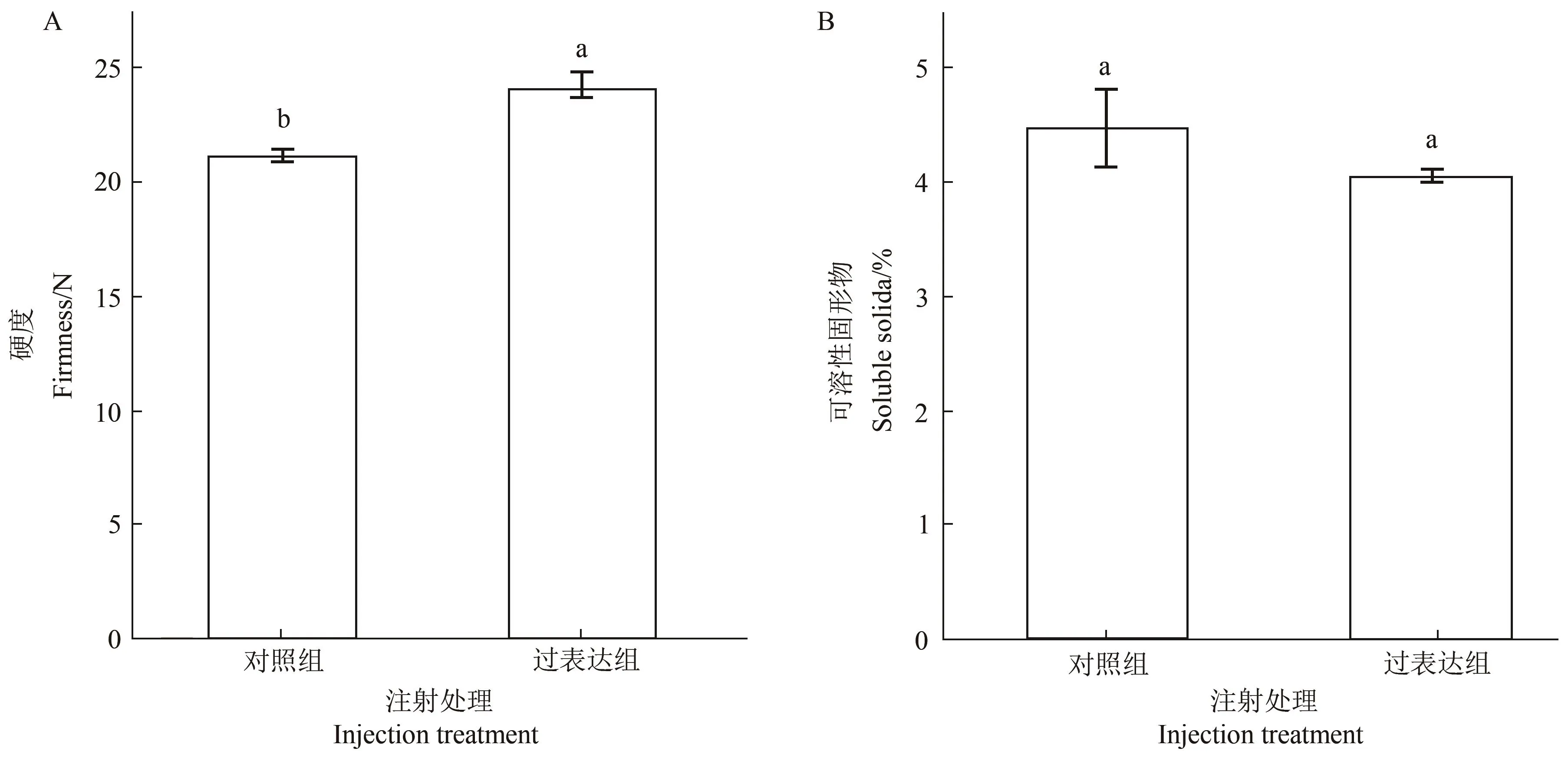
图2 FaGAPC2过表达对番茄果实硬度(A)和可溶性固形物含量的影响(B)Figure 2 The effect of FaGAPC2 overexpression on the firmness(A)and the total soluble solids content(B)of tomato fruit
2.4 过表达FaGAPC2对番茄果实总叶绿素和类胡萝卜素含量的影响
番茄果实成熟伴随着总叶绿素的降解以及类胡萝卜素的积累,为了进一步验证过表达FaGAPC2对番茄果皮颜色的影响,提取并测定了番茄果皮中的类胡萝卜素和总叶绿素含量,过表达FaGAPC2组的类胡萝卜素含量约是对照组的0.37倍(图3A),而总叶绿素含量是对照组的1.5倍(图3B)。由此说明过表达FaGAPC2可以显著减缓番茄果皮中类胡萝卜素的积累以及总叶绿素的降解从而延迟番茄果实成熟。

图3 FaGAPC2过表达对番茄果实类胡萝卜素含量(A)和总叶绿素含量的影响(B)Figure 3 The effect of FaGAPC2 overexpression on the carotenoid content(A)and total chlorophyll content of tomato fruit(B)
2.5 番茄果实成熟相关分子指标的测定
番茄果实成熟伴随着乙烯合成、叶绿素、细胞壁降解以及类胡萝卜素积累等生理生化过程。为进一步探讨GAPC2对番茄果实成熟调控的分子机制,作者利用qRT-PCR检测了1-氨基环丙烷羧酸氧化酶(1-aminocyclopropane-1-carboxylate oxidase,ACO)、1-氨基环丙烷羧酸合成酶(1-aminocyclopropane-1-carboxylate synthase,ACS)、乙烯响应因子(ethylene-responsive element factors,ERFs)、植酸合酶1(phytone synthase 1,PSY1)、叶绿体特异性番茄红素-β-环化酶(chloroplast-specific lycopene-β-cyclase,LCY)、色细胞体特异性番茄红素-β-环化酶(chromoplast-specific lycopene-β-cyclase,CYC-B)、细胞壁代谢相关基因肽蛋氨酸亚砜还原酶(peptide methionine sulfoxide reductase,E4)、1-氨基环丙烷-1-羧酸酯氧化酶(1-aminocyclopropane-1-carboxylate oxidase-like,E8)、脂 氧 合 酶(lipoxygenase,LOXB)、多聚半乳糖醛酸酶(polygalacturonase,PG)以及MADS转录因子RIN(MADS-box transcription factor RIN,RIN)和 DNA 结 合 蛋白 Pti4(DNA-binding protein Pti4,Pti4)等与番茄果实成熟相关的基因表达量。结果表明:与对照组相比,过表达组中类胡萝卜素合成途径中PSY1和CYC-B分别显著下调12.39和1.49倍,但对LCYB和LCYE的表达量没有显著影响;乙烯代谢相关基因ACO1、ACO3和ERF1分别下调12.89、3.87和3.51倍,但对ACS4的表达量无显著影响,反而过表达FaGAPC2的ACS2表达量显著高于对照组;说明过表达FaGAPC2是通过影响部分乙烯生物合成和类胡萝卜合成途径的基因表达量来影响番茄果实成熟。果实成熟细胞壁代谢相关基因E4下调5.43倍,E8、LOXB相比于对照表达量几乎为零,PG下调41.35倍,RIN下调6.67倍,Pti4的表达量也是过表达组的1.14倍(图4),表明过表达FaGAPC2对果实细胞壁代谢相关基因的表达量有所影响。由此说明,过表达FaGAPC2对于番茄果实类胡萝卜素积累、乙烯合成,特别是果实成熟细胞壁代谢相关基因表达均有较为明显的抑制作用。
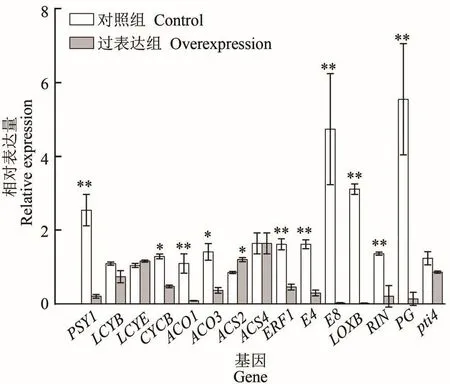
图4 FaGAPC2过表达对番茄果实成熟相关基因表达量的影响Figure 4 The effect of FaGAPC2 overexpression on the expression level of tomato fruit ripening-related genes
3 讨论
番茄果实成熟是一个复杂而高度协调的过程,包含乙烯、糖、色素以及芳香物质的积累,酸和果实硬度的降低。糖酵解是植物整体代谢网络中的核心代谢途径,通过底物、产物和中间物与其他代谢途径相联系。虽然目前已有大量关于乙烯合成信号转导、转录因子以及植物激素对番茄果实成熟的生理及分子机制研究,然而糖酵解对番茄果实成熟的影响还未见报道。目前糖酵解基因FaGAPC2/FaGAPCP1已被证明是草莓果实成熟的负调控因子[21],在番茄采后贮藏研究中也发现常温贮藏能通过加速糖酵解、蔗糖分解[28]以及有机酸利用等初生代谢途径诱导乙烯信号相关基因表达来促进果实衰老[29]。由此说明,糖酵解很有可能参与了番茄果实成熟的细胞壁代谢过程。
为证实作者的假设,本研究作者通过瞬时过表达糖酵解关键酶GAPC2来探讨其在番茄果实成熟中的作用。试验结果表明,过表达GAPC2可以显著抑制番茄果实上色,减缓叶绿素降解以及类胡萝卜素积累并提高其硬度。由此说明GAPC2作为一个负调控因子参与了番茄果实成熟的进程。为进一步证明这一结论,作者又通过qRT-PCR检测乙烯、类胡萝卜素合成途径以及与番茄果实成熟细胞壁代谢相关基因的表达量。在乙烯合成途径中,ACO是乙烯的直接前体1-氨基环丙烷羧酸(ACC)转化为乙烯的关键酶[30],本研究发现过表达GAPC2可以显著抑制乙烯合成途径关键酶ACO1、ACO3以及乙烯响应因子ERF1的表达。说明过表达GAPC2可能是通过影响乙烯合成以及乙烯调控下游成熟基因的表达来调节番茄果实成熟。在类胡萝卜素合成途径中,PSY1由乙烯诱导[31]并通过番茄红素在类胡萝卜素生物合成途径中的环化产生两种催化反应,导致β-胡萝卜素及其衍生物叶黄素分别被LCY-B和CYC-B催化,或导致胡萝卜素和叶黄素被LCY-B和LCY-E催化[32]。过表达的GAPC2对类胡萝卜素合成途径中的PSY1、CYC-B的表达有显著抑制作用,而对LCY-B和LCY-E并无显著抑制作用,以上试验结果都与此前的研究结果沉默SlHDT3或Sl⁃HDA3抑制番茄果实乙烯合成及类胡萝卜素积累相关基因结果相似[16-17]。表明过表达GAPC2可能通过影响PSY1环化作用中CYC-B催化叶黄素的生物合成从而影响番茄果实类胡萝卜素的积累。
果实软化是其成熟的一个显著特征,其根本原因是细胞壁降解。在本研究中过表达GAPC2对番茄果实细胞壁代谢相关基因E4、E8、LOXB、PG和RIN皆有极显著的抑制作用,这与SlHDA3负调节细胞壁代谢基因的表达结果相同[17],且此前在对不同品种番茄的耐储性研究中,随着低温储藏时间的延长,耐储性强的品种其细胞壁降解酶的活性更低[33]。在本试验使FaGAPC2过表达能延缓番茄果实软化以及抑制细胞壁代谢相关基因的表达,说明GAPC2可能在参与番茄果实细胞壁代谢有潜在的重要作用。
4 结论
在本研究中,我们通过瞬时过表达技术研究了胞质甘油醛-3-磷酸脱氢酶GAPC2在番茄果实成熟过程中的作用。研究结果表明,过表达GAPC2可以显著延缓番茄果实上色并提高其硬度,降低番茄果实中可溶性糖含量,显著抑制叶绿素降解和类胡萝卜素积累,进一步从基因层面分析表明,过表达GAPC2对乙烯合成、类胡萝卜素积累以及细胞壁代谢途径中的关键基因都有显著抑制作用,因此说明GAPC2作为一个负调控因子参与调节番茄果实成熟。
