叶酸受体阳性循环肿瘤细胞检测对肝细胞癌病人合并血管侵犯的诊断价值
2022-05-09林美龙王文强李剑张二雷黄志勇
林美龙 王文强 李剑 张二雷 黄志勇
肝细胞癌 (hepatocellular carcinoma,HCC)的血管侵犯与肝切除术后的复发、转移有相关性[1]。HCC发生的血管侵犯主要分为大血管侵犯和微血管侵犯(microvascular invasion,MVI)[2],大血管侵犯主要发生于门静脉、肝静脉、腔静脉及其主要分支,其中门静脉癌栓(portal vein tumor thrombus group,PVTT)是主要的大血管侵犯形式,常通过影像学检查发现;MVI是指癌细胞见于内皮细胞衬覆的血管腔内,多见于癌旁肝组织内的门静脉小分支[3],只能通过病理检查发现。循环肿瘤细胞(circulating tumor cells,CTCs)是指从原发肿瘤病灶脱落后进入到外周血液循环中的肿瘤细胞[4-6]。叶酸受体(folate receptor,FR)是一种表达于细胞膜表面的糖蛋白,它具有很强的组织及肿瘤特异性,在乳腺癌,肺癌,卵巢癌等多种实体肿瘤的细胞表面高表达[7-11]。有研究表明,肝原发肿瘤细胞表面的FR也有一定水平的表达[8]。本文探讨FR阳性CTCs(FR+-CTCs)与HCC血管侵犯的相关性及诊断价值。
对象与方法
一、对象
2020年10月~2021年8月我院收治HCC住院病人91例。纳入标准:病理学检查确诊为HCC;临床资料完善。排除标准:合并严重的心肺疾病或器质性病变;合并其他肿瘤性疾病;有叶酸服用史。病人已了解且同意加入研究。本研究符合医学伦理学要求。91例病人的一般资料见表1。根据术前影像结果和术后病理结果分为无血管侵犯(non-vascular invasion,NVI)组30例(32.97%),MVI组26例(28.57%),PVTT组35例(38.46%)。
二、方法
FR+-CTCs测试试剂盒(免疫磁珠负向筛选+靶向荧光定量PCR法)购于南通格诺思博生物科技有限公司。选取试管抽取4ml以上的HCC的病人的外周血液,去除红细胞,然后用免疫磁珠的方式去除绝大多数的白细胞,剩余样品中包含FR阳性细胞。使用特异性小分子探针对FR阳性细胞进行标记,这种特异性小分子探针由识别FR的化学小分子与寡聚核苷酸偶联形成。在小分子探针与FR阳性细胞充分结合后,洗涤去除未结合的探针;然后洗脱受体结合的探针,用于后续定量检测。利用荧光定量PCR,对FR结合的小分子探针中的寡聚核苷酸进行定量检测;最终依据校准曲线定量检测。
三、统计学方法

结果
3组病人FR+-CTCs检测值的平均水平分别为(10.52±2.21)FU/3 ml,(12.35±2.47)FU/3 ml,(14.79±3.68)FU/3 ml,3组比较差异有统计学意义(P<0.05) 。根据Kruskal-Wallis H检验,不同血管侵犯类型的病人的FR+-CTCs检测值差异具有统计学意义(P<0.05),其中NVI和MVI的FR+-CTCs检测值差异无统计学意义(P=0.085),NVI与PVTT组的FR+-CTCs检测值差异有统计学意义(P<0.05),MVI组和PVTT组的FR+-CTCs检测值差异无统计学意义(P=0.068)(图1)。采用Spearman相关性分析,FR+-CTCs检测值和HCC血管侵犯程度之间具有正相关性(r=0.499)(P<0.05)。其中FR+-CTCs检测值与MVI之间的相关性为r=0.320(P<0.05),FR+-CTCs检测值与PVTT之间的相关性为r=0.571(P<0.05)。

图1 91例HCC不同血管侵犯类型的FR+-CTCs分布范围
绘制FR+-CTCs的ROC曲线,计算ROC曲线下面积(AUC),FR+-CTCs诊断HCC有无血管侵犯的AUC为0.769(95%CI为0.668~0.869,P<0.05),差异有统计学意义,其中约登指数为0.439,临界值为12.35 FU/3 ml,敏感度为0.672,特异度为0.767。FR+-CTCs诊断MVI的AUC为0.579,P=0.312,差异无统计学意义。FR+-CTCs诊断PVTT的AUC为0.830(95%CI为0.733~0.928,P<0.05),其中约登指数为0.562,临界值为11.8 FU/3 ml,敏感度为0.829,特异度为0.733(图2)。
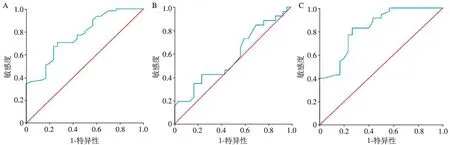
A.91例病人发生血管侵犯的ROC曲线;B.26例病人发生MVI的ROC曲线;C.35例病人发生PVTT的ROC曲线图2 FR+-CTCs在HCC不同血管侵犯类型的诊断效能
讨论
CTCs作为一种新型液体活检,已经在多种肿瘤病人的外周血液中检测出,并且显著高于健康人[12]。Cheng等[13]研究表明,CTCs对HCC具有诊断价值,与甲胎蛋白联合检测可以提升HCC诊断的有效性。有研究表明,通过上皮细胞黏附分子阳性的免疫靶点来识别并检测CTCs,发现其计数的动态变化与疾病变化进展相关[14]。Yan等[15]利用体内流式细胞术动态检测CTCs的数量变化,提出CTCs可以作为预测疾病进展和监测疗效的标志物。而且高计数量的上皮细胞黏附分子阳性CTCs预示着HCC有更高的复发率和更差的生存率[16]。HCC发生血管侵犯时,肿瘤细胞可从原发病灶迁移至血管内,形成微血管癌栓或者PVTT,导致HCC切除术后5年复发率可高达40%~70%[17]。原发病灶的肿瘤细胞侵袭血管后脱落而形成CTCs是造成肝内外播散或者远处转移的重要原因。近年来,随着对肿瘤表面特异性标志物的研究,发现FR具有很强的组织及肿瘤特异性,在卵巢癌、肾癌、子宫内膜癌、肺癌、乳腺癌、膀胱癌和胰腺癌等肿瘤中有明显的表达,但在正常组织几乎不表达。因此,FR作为一种新型的靶点来检测CTCs具有很大潜力[8]。利用FR检测CTCs在非小细胞肺癌,前列腺癌和大肠癌等恶性肿瘤上已得到应用,同时对多种肿瘤的诊断和预测疗效具有重要的临床意义[18-20]。
本研究结果表明,FR+-CTCs的检测值与HCC的血管侵犯程度呈正相关,血管侵犯程度越严重,其检测值越高,特别是发生PVTT的FR+-CTCs检测值对比NVI的检测值增加更明显。FR+-CTCs对PVTT的预测价值较高,但是对MVI的预测价值较低,无法通过FR+-CTCs数值的差异将NVI和MVI区别开来。由于HCC的CTCs的FR表达量不太高,导致HCC不同程度的血管侵犯的FR+-CTCs检测存在一定困难和遗漏,这可能是导致MVI预测价值较低的一个重要因素。
HCC常可出现PVTT或门静脉血栓(portal vein thrombosis,PVT),临床上通过影像学来对二者进行鉴别也有一定困难,存在一定的诊断误差[21-22]。有研究表明,HCC合并PVTT的发生率高达44.0%~62.2%[23];HCC通常合并肝硬化,由于血流动力学的改变,也容易出现PVT,单纯肝硬化病人PVT发生率为5%~20%[24-25],但在肝硬化合并HCC病人中PVT发生率可高达35%[26-27]。这时可以参考FR+-CTCs的数值对其加以区分,如果FR+-CTCs较高,特别是高于临界值11.8 FU/3 ml,应该注意血管侵犯的可能性。
血管侵犯与肝切除术后肿瘤的复发率高有密切相关性,术前作出是否有血管侵犯的准确诊断对于制定合理的手术方法,优化肝切除范围,尽早开展全身靶向及免疫治疗具有重要意义。本检测手段具有无创,简便,快速的优点,可以在一定程度上弥补现有影像学检查和病理学检查滞后的短板。本研究为单中心研究,纳入样本量相对不多;FR+-CTCs的检测数值也受多因素影响,包括检测仪器,试剂活性和纯度等。将来需要开展多中心、大样本量的研究,进一步深入研究FR+-CTCs检测在对MVI的预测作用,探讨治疗前后包括手术、靶向和免疫治疗前后病人FR+-CTCs水平的变化,分析FR+-CTCs水平的变化与病人预后的相关性。
