乳腺癌新辅助治疗二次活检诊断病理学应答研究进展及临床意义
2022-05-07许炳琦张国强
许炳琦,张国强
哈尔滨医科大学附属肿瘤医院乳腺整形病房,黑龙江 哈尔滨 150086
随着乳腺癌治疗方案的改善,新辅助治疗的疗效显著提升,尤其在三阴性以及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性乳腺癌患者中,由于铂类药物及双靶向药物(曲妥珠单抗联合帕妥珠单抗)方案的应用,其病理学完全缓解(pathological complete response,pCR)率得到显著提高[1-2]。同时,一些研究证实新辅助化疗与保乳率的提高相关,且切缘阴性条件下的保乳手术联合放疗与乳房全切在生存上差异无统计学意义,而新辅助治疗后达到pCR的患者与切缘阴性的保乳无本质差别,因此对pCR患者豁免手术仅行放疗在理论上具有合理性[3-5]。国外学者对于新辅助治疗后达到临床完全缓解(clinical complete response,cCR)的患者进行了豁免手术仅行放疗的临床研究,然而相对于进行手术的患者,免于手术有着较高的局部复发风险。部分研究者认为出现这种情况主要由于当时缺少先进的影像学诊断技术和穿刺活检技术,仅凭借乳房查体判断病理学反应并不足够准确[6]。
目前对新辅助治疗的评估包括基于临床查体和传统影像学检查(X线摄影、超声、MRI)。表1列举了常用于评估新辅助治疗效果方法的优缺点。临床查体和传统影像学检查在新辅助治疗过程中常用于判断肿瘤大小的变化,但有研究[7-9]报道这些方法常会造成对残余病灶的高估或低估。由于新辅助化疗过程中,肿瘤细胞逐渐减少而在初始瘤床位置出现化疗后纤维化,因此在查体时仍能触及肿块,而X线摄影以及超声检查常无法鉴别残余病灶与化疗后出现的纤维化而出现假阳性结果。一项回顾性研究[10]将几项研究结果合并分析得出临床查体、X线摄影、超声及MRI的阴性预测值(negative predictive value,NPV)分别为31%、41%、44%和65% 。

表1 新辅助化疗效果评估方法的优缺点Tab.1 The advantages and disadvantages of assessment approaches for response to neoadjuvant chemotherapy
因此,目前有国外学者提出使用影像学引导下微创活检(minimally invasive biopsy,MIB)来预测乳房残余病灶和病理学完全缓解[6,11-12]。但是,由于活检方法的多样性,以及各个中心诊断技术的差异,不同的研究得到了不同的结果。本综述探讨了目前新辅助治疗后活检技术在临床中的应用价值,早期活检诊断pCR可行性,大型前瞻性研究中活检技术对于诊断病理学反应的准确性。
1 二次活检在新辅助治疗中的临床意义
在相同的方案下,新辅助化疗与辅助化疗对患者的生存结局影响相同[13-14]。而新辅助化疗的优势之一是可以筛选出从化疗中获益的患者,即达到pCR的患者[15]。目前,美国食品药品管理局(Food and Drug Administration,FDA)已经批准将pCR作为长期生存的替代终点。因此,对pCR患者降阶梯治疗是必要的,一方面,过度的化疗会带来不必要的毒性,另一方面,目前的保乳整形重建技术的并发症发生率高,且安全性具有争议,在充分考虑安全性的前提下,对pCR患者豁免手术是值得我们追求的。但对于pCR豁免手术仍仅停留在理论阶段,目前未见采用合理的方法准确预测pCR的前瞻性研究报道。
二次活检虽然不足以准确预测pCR,但对于非pCR的诊断足够准确。一项大样本单中心回顾性研究[16]证实在新辅助化疗的过程中进行二次空芯针活检(core-needle biopsy,CNB)对于非pCR的预测具有较高的准确率,且显著优于同时对比增强MRI的预测结果[阳性预测值(positive predictive value,PPC):0.856vs0.713,P<0.001] 。CREATE -X[17]以 及KATHERINE[18]研究提示,对于新辅助化疗后未达到pCR的患者,可以从后续强化辅助化疗中获益。而在Gepartrio研究[19]中,对于2个周期新辅助化疗无效的患者,更换方案后并未显著增加pCR率。但是在新辅助治疗结束前筛选出非pCR的患者,更早地进行升阶梯治疗能否增加pCR率仍需要前瞻性临床研究证实。因此,利用二次活检技术早期筛选出对化疗不敏感的患者及时强化治疗或许可以进一步改善预后。
目前新辅助化疗的疗程问题仍有争议,指南和专家共识则推荐新辅助化疗阶段应完成既定周期数的化疗,不能完成的应在辅助化疗阶段补足周期数化疗[20-22]。但一项大规模meta分析[23]数据表明,对于pCR患者,额外的辅助化疗并未产生显著获益(辅助化疗对比未辅助化疗5年无事件生存率(event-free survival,EFS)分别为88%和86%,P=0.60)。近期发表的一项回顾性分析[24]提示HER2阳性乳腺癌新辅助4和6个周期紫杉醇联合卡铂加曲妥珠单抗(TCH)的pCR率差异无统计学意义,且两组pCR患者的4年EFS差异也无统计学意义(P=0.823)。虽然缺少更多的有关pCR患者降阶梯化疗的证据,但随着精准医学发展,利用二次活检对新辅助化疗效果较好的患者相对准确地预测pCR,或许可以更加合理地判断手术时机,从而能够避免过度无效的化疗。
2 活检诊断pCR可行性小型临床研究
早期的小型前瞻性研究主要的入组标准为新辅助化疗后cCR或影像学完全缓解(radiologic complete response,rCR)的患者,目的是通过比较不同类型的细胞学检查技术,包括CNB、细针抽吸活检(fine-needle aspiration,FNA)以及真空辅助活检(vacuum-assisted biopsy,VAB),不同穿刺针的型号,穿刺条数的多少,以及是否放置瘤床标记夹来筛选出最适合进行大型前瞻性临床研究的标准化流程(表2)。
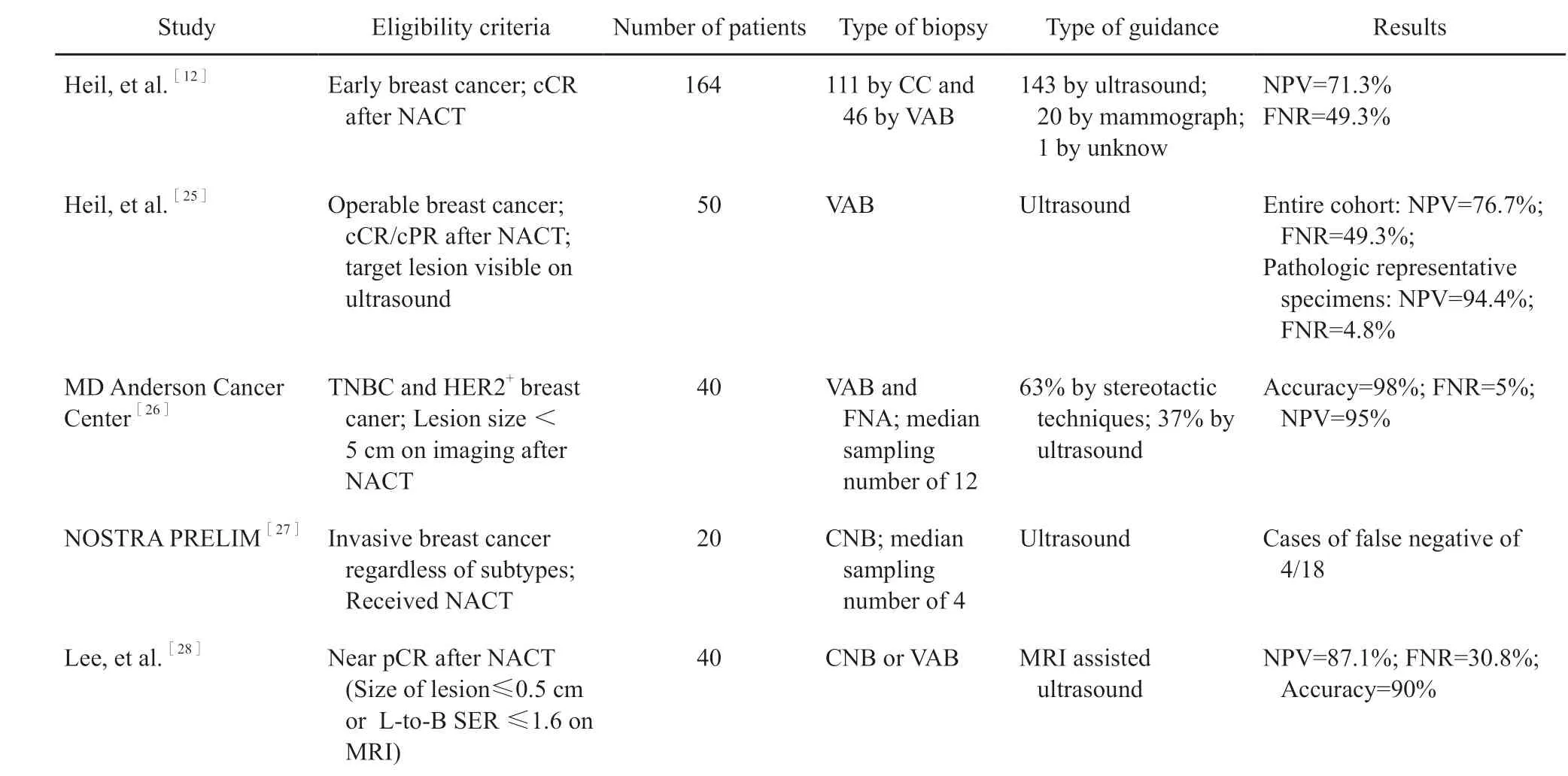
表2 活检预测pCR小型前瞻性研究Tab.2 Small prospective trails of pCR prediction by biopsy
Heil等[12]在2015年首次报道通过微创活检技术诊断乳腺癌新辅助化疗后pCR的多中心汇总、前瞻性研究结果,共入组164例新辅助化疗后cCR的早期乳腺癌患者,评估了影像学引导下空芯针切除(core cut,CC)或VAB的病理学检查结果与术后病理学检查结果,总体NPV表示预测pCR能力的大小,假阴性率(falsenegative rate,FNR)表示错误预测残余病灶的能力的大小。结果显示,NPV为71.3%(95% CI:63.3% ~ 79.3%),FNR为49.3%(95% CI:40.4% ~ 58.2%)。虽然该研究中总体NPV不足以预测pCR,但已显著高于影像学对pCR的预测能力,同时过高的FNR也表示活检对残余病灶的预测能力极差。该研究证实了在瘤床放置定位夹能够提高真阴性率,并且VAB优于CC。
根据上述研究的结果,Heil等[25]首次报道超声引导下VAB诊断pCR的小型前瞻性、单中心队列研究。该研究入组50例新辅助化疗后cCR或临床部分缓解(clinical partial response,cPR)的患者,术前行超声引导下VAB,根据穿刺样本病理学检查评估样本是否具有代表性(有残余肿瘤细胞或有瘤床组织但无残余肿瘤细胞),最终筛选出38例具有代表性的样本,其中,NPV达94.4%(95% CI:87.1% ~ 100.0%),FNR为4.8%(95% CI:0.0% ~ 11.6%)。该研究通过筛选出VAB相对准确地获得初始病灶位置的样本,提高了pCR预测的准确性,这提示了活检技术获取到准确靶病灶位置样本的重要性。
由于HER2+及三阴性乳腺癌pCR率较高,因此Kuerer等[26]进行的单中心小型前瞻性研究,入组了40例HER2+以及早期三阴性乳腺癌患者,通过超声或X线摄影引导下FNA或VAB来预测新辅助化疗后的残余病灶。结果表明,联合FNA和VAB两种活检技术的准确性高达98%(95% CI:87% ~ 100%),FNR为5%(95% CI:0% ~ 24%),NPV为95%(95% CI:75% ~ 100%)。单用VAB比FNA更加准确(P=0.012)。进一步分析提示立体定位引导下VAB准确率显著高于超声引导下VAB(P<0.05)。对假阴性结果进行分析发现残余病灶位置靠近皮肤或靠近胸壁会造成穿刺条数的不足,从而造成FNR增高。这也提示对于位置过于表浅或过深的肿瘤不适合入组此类研究。
活检条数对于准确性的影响也同样值得注意。pre-NOSTRA研究[27]仅入组20例可手术乳腺癌患者,所有患者均于确诊时在瘤床放置定位夹,经过新辅助化疗后进行超声引导下CNB,最终2例患者化疗后达到pCR,16例患者准确识别残余病灶,4例为活检假阴性。该研究中位活检条数为4条(2 ~ 6条),在设计大型研究时则会考虑增加活检条数以降低FNR。
然而,穿刺活检技术是一种有创操作,因此如何通过影像学手段避免有肿瘤残留的患者遭受二次活检的伤害也是研究者们所关注的问题。Lee等[28]的小型单中心研究利用MRI辅助下的超声引导CNB或VAB,目的是通过MRI初步筛选出那些非肿块样强化或非向心性退缩的肿瘤类型,从而增加入组患者总体的pCR率。该研究入组40例患者,总pCR率为67.5%,NPV和FNR分别为87.1%和30.8%,准确率达90.0%。因此该研究证实基于严格的MRI筛选标准下的超声引导活检能够准确地预测pCR,这对于未来大规模前瞻性临床试验具有一定的参考意义。
上述5项前瞻性小型研究采用了不同的研究设计,一些研究即使得到了较低的FNR以及较高的NPV,由于入组患者人数过少,仍然不能证实活检对于pCR的预测是准确的。但是可以提示在未来大规模研究中值得注意的问题,包括如何筛选合适的入组患者,诊断时放置定位标志,应使用VAB,新辅助治疗后应充分对瘤床进行活检以及采用合适的影像学检查手段等,只有注意到这些问题,采用更为标准的活检流程,才能提高诊断pCR的准确率,降低FNR。
3 活检诊断pCR大型前瞻性临床研究
随着上述小型研究得到较为准确的结果,多个中心开始进行大型前瞻性活检预测pCR准确率研究,目前这些研究多为近5年开始入组,在2019年圣·安东尼奥乳腺癌学术会议(San Antonio Breast Cancer Symposium,SABCS)上最早公布了4项前瞻性研究的主要结果(表3)。

表3 活检预测pCR大型前瞻性研究Tab.3 Large prospective trials of pCR prediction by biopsy
MICRA研究[29,33]入组了167例新辅助化疗后MRI评估为cCR或cPR(残余0.1 ~ 2.0 cm病灶或肿瘤大小减少≥30%)的患者,应用超声引导CNB,采用14 G穿刺针,分别对肿瘤中央及肿瘤周围进行4次采取样本。而后行标准手术(保乳或全切)。最终结果显示该研究FNR为37%,即表明有37%的患者被误判为pCR,而亚组分析表明,MRI评估为cCR的患者FNR高,cCR患者FNR为45%,而cPR患者FNR为13%,提示MRI对于pCR的判断也不够准确。
RESPONDER研究[30,34]入组398例患者,经过新辅助化疗后影像学评估为PR或CR(根据RECIST 1.1标准),通过影像学(超声或钼靶X线检查)引导下的VAB,根据穿刺样本是否能够代表之前肿瘤区域,将样本含肿瘤细胞及样本无肿瘤细胞但不具有代表性定义为阳性,而样本无肿瘤细胞且具有代表性定义为阴性,然后行标准乳腺外科手术。结果显示,对于总体队列而言,FNR为17.8%(95% CI:12.8% ~ 23.7%),而在对于不同直径穿刺针的亚组分析中,使用7 G穿刺针的FNR为0.0%(95% CI:0.0% ~ 18.5%),这提示使用直径较大的穿刺针可能有助于降低FNR。
NRG-BR005研究[31]入组的患者则均为新辅助化疗后cCR及三联影像学评估为rCR/近rCR(X线摄影显示肿块≤1 cm或无恶性钙化、超声下肿块≤2 cm及MRI下无快速上升及流出动力学的肿块),应用标志夹导向的立体定位引导多点瘤床CNB,所有患者均进行保乳手术,最终结果显示,NPV为77.5%(95% CI:66.8% ~ 86.1%),灵敏度为50.0%(95% CI:32.9% ~ 67.1%)。亚组分析显示,对于HER2+组中,NPV(89.5%)及灵敏度(60.0%)最高,但也未达到研究的主要终点(NPV>90.0%)。进一步分析显示,将非pCR定义为仅残余浸润性癌(即不包括仅残余导管原位癌和同时残余导管原位癌和浸润性癌)时,NPV(89.2%)和灵敏度(60.9%)有所提高。因此,此研究的入组标准并不适合进行未来豁免手术的研究。
一项多中心汇总分析[32]入组了新辅助化疗后至少部分临床或影像学缓解共166例患者,采用不同类型的影像学引导活检技术(超声或立体定位下CNB或VAB),以术后病理学检查结果作为参考,最终结果显示总体FNR为18.7%,NPV为84.3%。进一步进行亚组分析,对于新辅助化疗后残余影像学异常≤2 cm的患者应用VAB采样≥6条具有代表性的样本使得FNR<5%,而NPV达97.4%。这提示残余影像学异常≤2 cm且使用VAB采样至少6次可能为进一步研究的标准。
最近一项针对活检预测pCR的meta分析[35]纳入了9项相关研究,共1 030例患者,汇总后总体pCR率为49%(95% CI:40.0% ~ 57.1%),汇总灵敏度为72%,特异度为97%,受试者工作特征(receiver operating characteristic,ROC)曲线下面积为0.9,总体上假阴性率较高,达28%,对于这一部分患者应当采用标准手术治疗才不影响其生存。目前这类研究将可接受的最高FNR定义为10%,意味着活检将有肿瘤残余的患者诊断为pCR的概率最高为10%才不会转化为差异具有统计学意义的生存结局,然而该假设无明确的证据,仍需要进一步研究证实。
Heil等[36]使用多个研究组的数据集评估了4种机器学习多变量算法(弹性网损失逻辑回归、极端梯度提升树、支持向量机和深度神经网络)在预测pCR效能上的表现。其中深度神经网络显示出显著的优势,其在测试集中FNR仅为1.2%(95% CI:0.0% ~ 6.4%),在验证集中FNR低至0.0%(95% CI:0.0% ~ 12.8%)。虽然FNR可以达到研究终点,但其特异度(定义为通过活检或算法得出的乳房pCR率与手术标本pCR率之比)明显低于VAB(67.2%vs89.6%)。该研究表明机器学习算法可能在未来豁免手术研究中具有重要作用,但仍需要大规模前瞻性研究证实。
综上所述,二次活检的总体FNR为18.7% ~ 50.0%,NPV为77.5% ~ 84.3%,目前的结果与主要终点已经非常接近,但仍不能满足豁免手术的条件。为满足条件则可能需要严格限制入组标准(如排除多灶或多中心性疾病以及大范围的微小钙化灶)、操作流程(如选择VAB、大直径穿刺针并且保证具有代表性穿刺样本和穿刺条数等)以及利用机器学习算法筛选可安全豁免手术的患者。
4 二次活检相关并发症
仅几项研究报道了活检相关并发症,Kuerer等[26]小型可行性研究报道20%的患者出现不良反应,最常见的不良反应为穿刺位点出血,其次为血肿,均未超过1级。而NRG-BR005[31]研究报道7.1%的患者出现并发症,最常见的为术后血肿。Lee等[28]研究报道了1例活动性出血,1例血肿。综上所述,二次活检技术安全性较高,并不会对患者造成严重的创伤。
5 总结
二次活检技术点燃了临床医师对新辅助化疗后达到pCR患者豁免手术的希望,然而由于活检技术固有的局限性以及肿瘤对于化疗应答的异质性,使用此类技术预测pCR出现较高的FNR是难以避免的。但是,二次活检仍然可以作为评估新辅助化疗反应的工具,在早期预测出不可能达到pCR的患者,应早期进行手术治疗后续强化辅助治疗以获得更好的生存结局;或及时预测达到pCR的患者,早期手术治疗避免过度化疗。未来我们需要进一步临床研究证实早期强化治疗和不同疗程新辅助化疗对于pCR及患者预后的影响,从而实现量体裁衣的个性化治疗。
