p53 modRNA 促进人诱导多能干细胞来源早期心肌细胞分化成熟的初步研究
2022-05-07陈颖杨礼宫艺其谭瑶王会景刘明璐卢婷婷罗润娇王伟付炜
陈颖 杨礼 宫艺其 谭瑶 王会景 刘明璐 卢婷婷 罗润娇 王伟 付炜
心血管疾病是人类健康的头号杀手[1]。心肌细胞是心血管疾病研究和治疗的重要方向。然而,人来源心肌细胞获取困难,存在伦理问题,并且无法体外传代扩增,限制了心血管领域的相关研究。人体细胞重编程去分化获得的诱导多能干细胞(Human induced pluripotent stem cell,hiPSC),具有多向分化潜能,且避开了相关的伦理问题,具有广泛的应用前景[2]。通过特定的诱导分化方式,可从hiPSC 不断地获得人心肌细胞,用于药物毒性测试和筛选平台、3D 类器官的构建、疾病模型构建、细胞治疗等[3]。
然而,hiPSC 分化来源的心肌细胞属于未成熟细胞,肌节少,没有T 管,依赖糖酵解作为主要能源供应[4]。研究表明,未成熟的心肌细胞移植到大型动物模型体内可能会诱发致死性心律失常[5]。因此,干细胞来源的心肌细胞成熟不足是其应用的主要障碍。目前,促进心肌细胞成熟的方法包括延长培养时间、肌电刺激、细胞共培养、添加生物活性分子等,但这些方法存在各种问题,如效率低、成本高、效果有限或操作过于复杂[3,6]。因此,我们需要研究更为简单高效的可促进hiPSC 来源心肌细胞(Human induced pluripotent stem cell-cardiomyocyte,hiPSCCM)进一步成熟的方法。
研究表明,心脏发育最后阶段的标志是心肌细胞增殖到肥大的转变。人类的心肌细胞在出生后仅0.01%的细胞处于有丝分裂期,在青春期显著下降,几乎检测不到。然而,hiPSC-CM 在其产生后数月仍可保留分裂能力,增殖率在长时间培养后逐渐从每天30%降至<5%[7]。心肌细胞退出细胞周期是其成熟的主要标志。其中,p53 蛋白具有调控细胞周期的重要作用[8]。研究显示,抑制mTOR 通路可促进iPSC来源的心肌细胞成熟,可能与上调细胞周期调控因子p53 相关[9]。p53 是一种高度保守的转录因子,在细胞的周期调控、DNA 修复、细胞凋亡和衰老等多种细胞过程中发挥着关键作用[9]。在心肌细胞中,p53被认为是心脏转录组的关键调节因子。研究显示,心肌细胞特异性核心转录因子基因启动子上都有p53的结合位点,p53 可以在心肌细胞中调节上述转录因子的表达,从而在心肌细胞成熟相关特征上扮演重要角色[10]。因此,我们设想是否可以通过简单有效的手段调控p53 的表达,从而促进hiPSC-CM 的成熟。
化学合成修饰信使RNA(Synthetic chemically modified mRNA,modRNA)技术利用化学修饰和结构改变,对mRNA 进行改造,优化mRNA 的帽子和尾部结构,使其更加稳定,并将序列中正常的尿嘧啶替换为N1 甲基假尿嘧啶(N1-methylpseudouridine),降低其免疫原性,从而使RNA 在细胞内能高效快速表达目的蛋白[11]。传统基因过表达方法易发生外源性基因整合到宿主基因内的现象,从而造成染色体变异,且易激发宿主免疫反应而被清除,因此转染效率低且易造成严重不良后果[12]。modRNA 技术不会与宿主基因组发生整合,并且比未修饰的RNA 更加稳定且免疫原性更低,这些优良特性使modRNA 快速得到广泛的应用[13]。
本研究中,我们利用modRNA 技术表达目的蛋白、快速高效发挥作用的特性,将p53 modRNA 转染至分化早期的hiPS-CMs 中,上调细胞内p53 的表达,从而一定程度上促进心肌细胞的分化成熟。
1 材料与方法
1.1 实验试剂及仪器
TESR-E8 培养基、Y-27632、ACCUTASE 消化酶、CHIR99021(STEMCELL,加拿大),EDTA、RPMI1640、B27-INSULIN、PCR 纯化试剂盒、Xhol 酶、质粒小抽试剂盒、转录物纯化试剂盒、体外转录试剂盒、Trizol、胰酶、TopVision Agarose Tablets、6×Orange DNA Loading Dye(THERMO,美国),基质胶(CORNING,美国),心肌细胞消化液(赛贝,中国),流式细胞固定破膜液(INVITROGEN,美国),DH5α 感受态细胞(北京天根生化科技有限公司),cTnT 抗体、cTnI抗体、p53 抗体(PROTEINTECH,美国),α-actin 抗体、DMSO(SIGMA,美国),RT REAGENT KIT 试剂盒(TaKaRa,日本),SYBR PCR 试剂盒(QIAGEN,德国),PBS、高糖DMEM、双抗(HYCLONE,美国),FBS(BIOIND,以色列),DAPI(上海翊圣生物科技有限公司),驴抗兔/鼠IgG 二抗(ABCAM,英国),pUC57-p53/pUC57 -GFP 质粒、PCR 引物、4×Tris-HCl 浓缩胶配胶缓冲液pH8.8 1.5 mol/L、Tris-glycine-SDS 缓冲液、10×印迹转膜缓冲液(上海生工生物工程股份有限公司),4×Tris-HCl 浓缩胶配胶缓冲液pH6.8 0.5 mol/L、Amersham Hybond P 0.45 PVDF(GE Healthcare,美国),non-fat powder milk(BBI Life Science,美 国),tween-20、APS、TEMED、10%SDS(Sangon Biotech,美国)、SDS-PAGE 蛋白上样缓冲液、RIPA裂解液、PMSF、30% Acr-Bis(上海碧云天生物技术有限公司),Pageruler prestained protein ladder(LIFE TECHNOLOGIES,美 国),Immobilon Western HRP底物(MERK,德国),50×TAE 电泳缓冲液(北京索莱宝科技有限公司),Gelred 10 000×inwater(BIOTIUM,美国)。
倒置荧光显微镜(DMI3000B,Leica,德国),激光共聚焦显微镜(TSC SP8,Leica,德国),NanoDrop 2000(Thermo,美国),qPCR 仪(CFX-Connect,BIORAD,美国),化学发光成像仪(Amersham Imager 600,美国),电泳仪、电泳槽、微波炉、凝胶显像系统(上海天能科技有限公司)。
1.2 实验方法
1.2.1 modRNA 制备方法
参照p53/GFP CDS 序列构建pUC57-p53/pUC57-GFP 质粒。p53 CDS 序列详见NM_000546.6,GFP 的CDS 序列[14]。取质粒1 μg 与感受态细胞20 μL混合,置于冰上5 min,随后42 ℃热激60 s,加入1 mL无抗性LB 培养基于37 ℃活化1 h,取少量菌液均匀涂抹在含氨苄青霉素LB 培养板上,37 ℃过夜。挑取单菌落加入含氨苄青霉素LB 培养液中,37 ℃扩增过夜。利用质粒抽提试剂盒提取质粒(参考说明书)。用Xhol 酶对质粒进行酶切,用纯化试剂盒对酶切产物进行纯化(参照说明书),利用PCR 扩增线性质粒的CDS 序列,再次对产物进行纯化。利用3'-O-Me-m7G(5')ppp(5')G RNA Cap、AntiReverse Cap Analog、N1-甲基假尿嘧啶、GTP、CTP、ATP 等进行体外转录并纯化,随后进行磷酸化修饰处理并再次纯化。详见参考文献[15]。
1.2.2 心肌细胞分化
hiPSC 细胞系由上海儿童医学中心李彦欣教授课题组建系、鉴定,为脐带血细胞来源,捐献者签署了相关知情同意书。
6 孔板用Matrigel 铺板30 min,hiPSCs 用TeSR-E8 进行培养和扩增。
分化前2 天,按每孔100 万hiPSC 的密度将其接种于已铺胶的12 孔板上,分化第0 天加入12 μmol/L CHIR99021(用B27-Insulin 配制),2 mL/孔,分化第2 天终止,加入B27-Insulin 培养基,分化第3 天加入5 μmol/L IWP2(用B27-Insulin 配制),分化第5天用B27-Insulin 培养基换液,分化第7 天换成B27+Insulin 培养基,此后每2 天换液一次。分化第9天细胞开始出现明显搏动。
1.2.3 核酸凝胶电泳
制备10%琼脂糖溶液25 mL(含0.01%Gelred),倒入制胶板,插入梳子,室温凝固30 min,将凝胶置入电泳槽,拔去梳子,加入1×TAE 电泳缓冲液没过凝胶,将2 μL 样本与1 μL 6×载样缓冲液混合均匀,依次加入样孔中。将电泳仪调至120 V 电压,电泳30 min,利用凝胶显像系统观测条带。
1.2.4 免疫荧光染色
将细胞以合适的密度接种于共聚焦小皿上,培养过夜后去除培养基,用PBS 清洗细胞,吸弃PBS后加入4%多聚甲醛1 mL,室温固定30 min 后吸弃液体。加入PBS 漂洗3 次,每次5 min。加入0.5%Triton,室温放置10 min 后吸弃液体,加入PBS 漂洗3 次,每次5 min。加入5%BSA,室温放置2 h 后吸弃液体。加入稀释好的一抗(参照说明书),4 ℃孵育过夜,吸弃液体,加入PBS 漂洗3 次,每次5 min。加入稀释好的二抗(参照说明书),室温孵育2 h,吸弃液体,加入PBS 漂洗3 次,每次5 min。加入稀释好的DAPI(参照说明书),室温孵育5 min,吸弃液体,加入PBS 漂洗3 次,每次5 min。荧光显微镜下观察,拍照。
1.2.5 免疫蛋白印迹(Western blot)
收集细胞沉淀,加入适量RIPA 裂解液裂解细胞,冰上放置30 min,每隔10 min 涡旋一次,4 ℃下12 000 r/min 离心10 min,收集上清。用BCA 法测定蛋白浓度。在预先准备好的10%聚丙烯酰胺凝胶中加入30 μg 样品,开始60 V 电泳30 min,后120 V电泳100 min。将凝胶转移至转膜仪器中,200 mA转膜100 min,5%脱脂牛奶封闭2 h,加入稀释好的一抗(参照说明书)4 ℃孵育过夜,吸弃液体,加入PBS 漂洗3 次,每次5 min。加入稀释好的HRP 偶联二抗(参照说明书),室温孵育1 h,吸弃液体,加入PBS 漂洗3 次,每次5 min。加入显色液,在化学发光仪器下曝光拍照。
1.2.6 流式细胞分析技术
收集细胞,用流式细胞固定液室温避光孵育30 min,随后加入1 mL PBS,1 000 r/min 离心5 min,吸弃液体,加入稀释好的一抗(参照说明书)37 ℃孵育1 h,1 000 r/min 离心5 min,吸弃液体,加入稀释好的二抗(参照说明书),室温避光孵育1 h,1 000 r/min离心5 min,吸弃液体,加入400 μL PBS 重悬细胞,转移至流式管中,上机检测。
1.2.7 定量逆转录聚合酶链式反应(Real-time quantitative PCR,qRT-PCR)
吸弃培养液,每孔加入1 mL Trizol,吹打细胞,收集裂解液,冰上静置5 min,每管加入250 μL 三氯甲烷,剧烈振荡至完全乳化,冰上静置5 min,4 ℃下12 000 r/min 离心15 min。吸取上层水相500 μL至新EP 管,加入500 μL 预冷异丙醇混匀,冰上静置10 min,4 ℃下12 000 r/min 离心15 min。吸弃液体,加入75%乙醇1 mL(DEPC 水稀释)重悬沉淀,4 ℃下7 500 r/min 离心5 min,吸弃液体,重复清洗沉淀一次,吸弃液体,晾干沉淀,加入适量DEPC 水溶解沉淀。利用逆转录试剂盒将RNA 逆转录为cDNA,操作参照说明书。将逆转录产物与扩增引物、荧光染料等按照一定比例混合加入PCR 板中,上机检测。
1.3 统计学方法
采用GraphPad Prism 8.0.2 进行统计分析,数据以表示,组间比较采用非配对t 检验,P<0.05 表示差异具有统计学意义。
2 结果
2.1 p53 modRNA 制备与鉴定
modRNA 与天然mRNA 基本结构相似,由5 个主要区域构成,两端分别是5' 帽结构和3' 多聚(A)尾,其间包括5' 非翻译区(5'untranslated region,5'UTR)、开放阅读框(Open reading frame,ORF)以及3' 非翻译区(3'untranslated region,3'UTR)。ORF 区域通常编码感兴趣的蛋白质。为了制备p53 modRNA,我们首先设计了p53 的序列结构,装入pUC57质粒中。本研究中,利用modRNA 编码人源性p53,p53 modRNA 在体外转录后进行纯化,核酸电泳结果显示,构建的质粒大小4 117 bp,p53 modRNA 纯度较高,片段大小在1 500 bp 左右,与预期相符(图1)。

图1 p53 modRNA 鉴定Fig.1 Identification of p53 modRNA
2.2 hiPSC 鉴定及hiPSC 向心肌细胞分化
hiPSC 呈圆形,核质比高,排列紧密,呈克隆样生长,边缘整齐。免疫荧光染色结果显示,hiPSC高表达干性标记物Oct4、Nanog、Tra-1-60、Sox2(图2)。在hiPSC 向心肌细胞诱导分化过程中,细胞形态逐渐变为多边形,光镜下显示第9 天心肌细胞开始搏动。免疫荧光结果显示,hiPSC 诱导分化的心肌细胞高表达心肌特异性标记物α-actinin、cTnT,肌节结构较为整齐且表达丰富。对分化的心肌细胞进行流式细胞分析的结果显示,心肌细胞高表达特异性标记物cTnT,且效率超过80%(图3)。
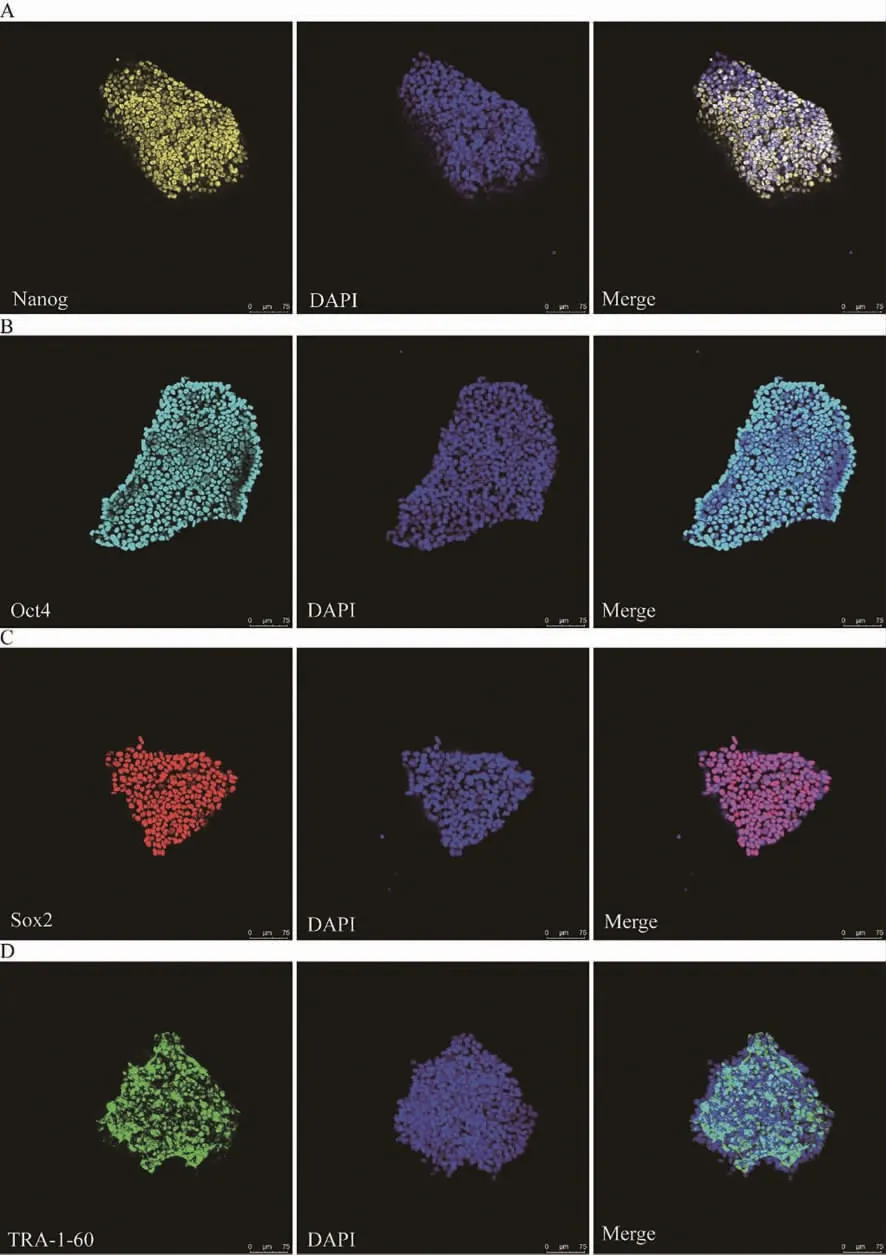
图2 hiPSC 特异性标记物鉴定(标尺=75 μm)Fig.2 Pluripotency identification of hiPSC (bar=75 μm)

图3 hiPSC 向心肌细胞分化的过程及心肌细胞鉴定Fig.3 Differentiation of hiPSCs into cardiomyocytes and identification of cardiomyocytes
2.3 p53 modRNA 转染hiPSC-CMs 后p53 表达情况
我们验证了p53 modRNA 转染hiPSC-CMs 6 h后成功表达了p53,24 h 后仍有部分表达,蛋白表达稳定,表达时间与蛋白半衰期相关(图4)。
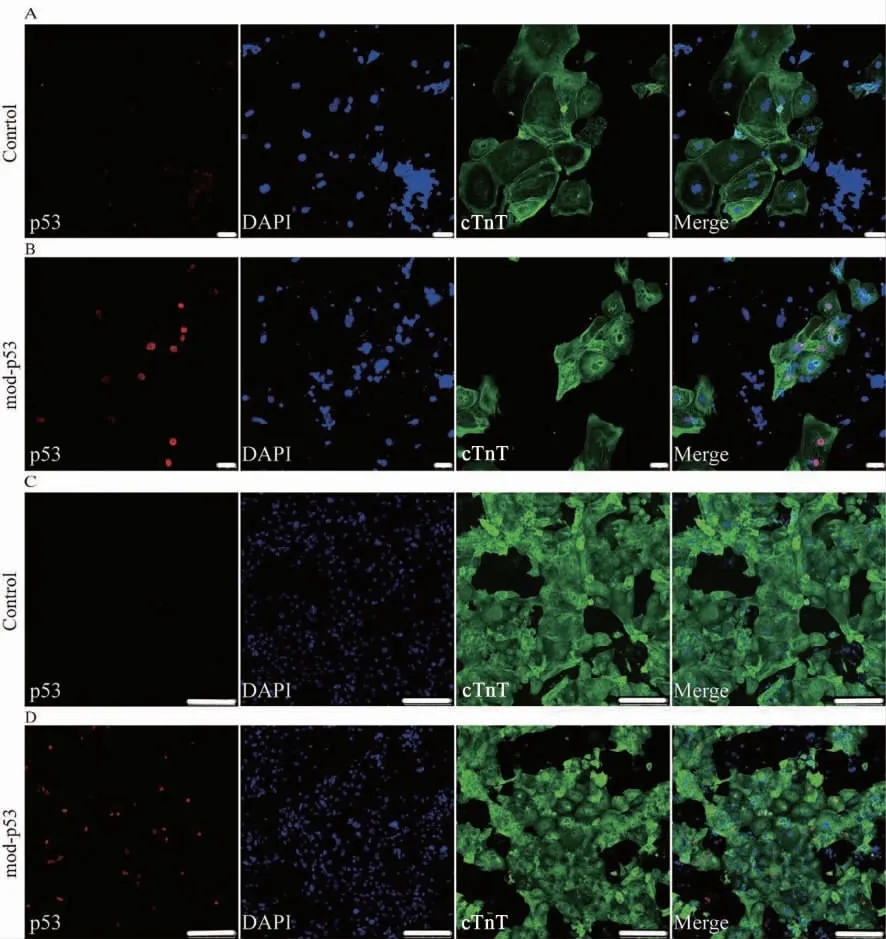
图4 hiPSC-CMs 转染p53 modRNAFig.4 p53 modRNA transfected with hiPSC-CMs
2.4 转染p53 modRNA 后hiPSC-CMs 成熟相关基因及蛋白表达情况
在心脏发育过程中,心肌细胞的成熟伴随着p53 等细胞周期调控蛋白的激活。我们测试了由p53 modRNA 介导的瞬时p53 表达是否具有类似的效果。我们将hiPSC-CMs 培养至分化且细胞开始搏动后2 d,向细胞内转染p53 modRNA,继续培养2周后对心肌成熟相关标记物进行测量。Western blot 结果显示,转染p53 modRNA 组中,心肌特异性蛋白cTnI 表达较转染GFP modRNA 的组有增高趋势,但没有显著的统计学差异。PCR 结果显示,与转染无关蛋白的组相比,转染p53 modRNA 的组增殖相关基因CCNB1 表达降低(P<0.001),钾离子通道基因KCNJ2 表达增高(P<0.05),钠离子通道基因SCN5A表达有增高趋势,心肌细胞特异性蛋白基因TNNI3表达增高(P<0.001),脂代谢相关基因PPARGC1a 表达增高(P<0.01),证明p53 modRNA 转染hiPSCCMs 可在一定程度上促进心肌细胞的成熟(图5)。
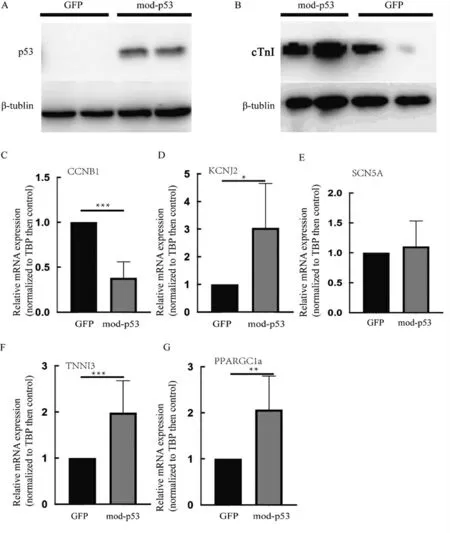
图5 hiPSC-CM 成熟相关蛋白及mRNA 的表达Fig.5 Expression of maturation related protein and mRNA of hiPSC-CM
2.5 转染p53-modRNA 对hiPSC-CM 形态的影响
为进一步探究p53 modRNA 对hiPSC 诱导的早期心肌细胞形态的影响,我们对p53 modRNA 处理后2 周的hiPSC-CM 进行细胞免疫荧光染色。结果显示,与未转染组相比,转染组心肌细胞形态趋近长棒状,细胞肌节排列更整齐且数量丰富,更接近成熟心肌细胞形态。表明p53 modRNA 作用于hiPSC 诱导的早期心肌细胞,可能促进hiPSC-CM 形态的成熟(图6)。

图6 hiPSC-CM 形态鉴定(标尺=50 μm)Fig.6 Morphological identification of hiPSC-CM (bar=50 μm)
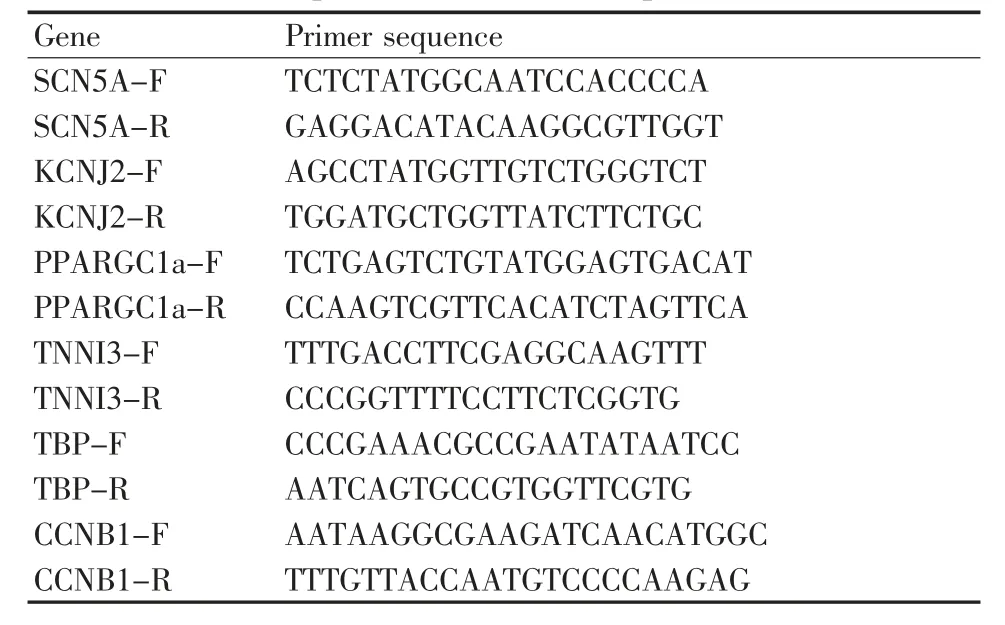
表1 荧光定量PCR 引物序列Table 1 Primer sequence of fluorescence quantitative PCR
3 讨论
本研究中,我们成功利用modRNA 技术,制备出p53 modRNA,并将其成功转染至hiPSC 分化来源的早期心肌细胞中,提高了p53 的表达,降低了增殖相关基因CCNB1 的水平,在一定程度上促进了心肌细胞的进一步分化成熟。
hiPSC 来源的心肌细胞成熟不足是心血管领域研究的重要障碍。目前,促进hiPSC-CMs 成熟的方法各有弊端,因此不适用于批量生产使用。我们需要进一步研究简单有效的获得成熟心肌细胞的方法。成熟的心肌细胞处于静止状态,并且细胞的结构和功能更加完善[16]。其中,p53 蛋白具有调控心肌细胞周期的重要作用。p53 的激活可以促使细胞进入静止状态[17]。研究发现,p53 的抑制与斑马鱼心肌增殖相关[18]。因此,本研究通过modRNA 技术调控p53 的表达,从而一定程度上促进了hiPSC-CM 的分化成熟。
modRNA 技术是一种创新性的方法,具有广泛的应用前景。传统的基因传递方法包括基于DNA 的方法和非DNA(如mRNA)的方法。第一代DNA 疗法将携带的遗传物质与宿主基因整合,可能导致细胞损伤、死亡或者肿瘤形成[19]。第二代DNA 疗法虽然不与细胞基因组整合,但仍可与细胞基因组以外的DNA 结合,并可能导致严重的细胞损伤甚至死亡[20]。mRNA 的应用也是具有挑战性的,mRNA 在细胞外极易被核糖核酸酶降解,并且这种大分子难以通过细胞膜,从而导致稳定性低且传递效率较差[21]。modRNA 通过化学修饰以及结构改变,可提高其安全性、有效性和持续时间。与传统的基于DNA 的传递方式相比,modRNA 具有许多优势。首先,modR⁃NA 不会与宿主基因发生整合,且modRNA 的作用是短暂的,没有致突变的风险。modRNA 还可有效利用细胞的翻译机制以剂量依赖的方式产生目的蛋白[22,23]。由于结构和核苷酸的修饰,modRNA 的免疫原性更低[12]。与传统方式相比,modRNA 的制备更为便捷且高效,更容易批量化生产。由于modRNA 的突出优势,已被用于不同疾病的临床研究与治疗中[13,24]。
在hiPSC 诱导的早期心肌细胞中,可以观察到转染p53 modRNA 一定程度上促进了心肌细胞肌节相关蛋白cTnI 和基因TNNI3 的表达。心肌细胞肌节的形成依赖不同肌原纤维蛋白的表达,监测相关蛋白(如cTnT、cTnI 等)的表达水平可以对iPSCCM 的成熟进行初步评价[25]。
在细胞形态和结构方面,转染组的细胞长宽比增大,形态更趋近长棒型,肌节丰富且排列整齐。成体心肌细胞形态不仅提供细胞的结构框架,而且还直接促成细胞的其他关键功能特性。高长宽比的细胞结构有利于生成长肌原纤维与横向对齐的肌节,导致有效心脏收缩力的产生[26]。未成熟的心肌细胞在平面培养时,会迅速形成扁平形状,且没有清晰的肌原纤维排列[27]。
心肌细胞收缩力的产生不仅与肌节相关,还与离子通道的活动密不可分。心肌细胞的收缩力由动作电位激发,而离子通道是心肌细胞动作电位产生的基础[28]。本研究中的q-PCR 结果显示,转染组钠离子和钾离子通道相关蛋白基因的表达相比未转染组有增高趋势;同时,脂代谢相关基因PPARGC1a表达增加,提示心肌细胞的代谢方式可能更多地向脂代谢转变。hiPSC-CMs 主要通过糖酵解产生能量[29],而在成年心肌细胞中,大约80%的能量消耗是由脂代谢提供的[30]。因此,上调p53 有可能促进了hiPSC-CMs的能量代谢转变,但是还需要进一步的实验证明。
本研究利用p53 modRNA 转染hiPSC 来源的心肌细胞,初步显示对心肌细胞的分化成熟有促进作用,但是依然需要后续透射电镜、膜片钳电生理、全面的基因分析以及体内细胞治疗的应用验证,从而进一步证明该方法促进心肌细胞成熟的可靠性和有效性。
